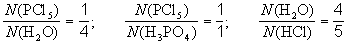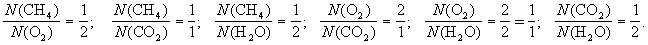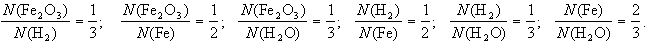Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e23b668e89500b2 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
2.2.2. Химические свойства металлов IIA группы.
IIA группа содержит только металлы – Be (бериллий), Mg (магний), Ca (кальций), Sr (стронций), Ba (барий) и Ra (радий). Химические свойства первого представителя этой группы — бериллия — наиболее сильно отличаются от химических свойств остальных элементов данной группы. Его химические свойства во многом даже более схожи с алюминием, чем с остальными металлами IIA группы (так называемое «диагональное сходство»). Магний же по химическим свойствами тоже заметно отличается от Ca, Sr, Ba и Ra, но все же имеет с ними намного больше сходных химических свойств, чем с бериллием. В связи со значительным сходством химических свойств кальция, стронция, бария и радия их объединяют в одно семейство, называемое щелочноземельными металлами.
Все элементы IIA группы относятся к s-элементам, т.е. содержат все свои валентные электроны на s-подуровне. Таким образом, электронная конфигурация внешнего электронного слоя всех химических элементов данной группы имеет вид ns 2 , где n – номер периода, в котором находится элемент.
Вследствие особенностей электронного строения металлов IIA группы, данные элементы, помимо нуля, способны иметь только одну единственную степень окисления, равную +2. Простые вещества, образованные элементами IIA группы, при участии в любых химических реакциях способны только окисляться, т.е. отдавать электроны:
Ме 0 – 2e — → Ме +2
Кальций, стронций, барий и радий обладают крайне высокой химической активностью. Простые вещества, образованные ими, являются очень сильными восстановителями. Также сильным восстановителем является магний. Восстановительная активность металлов подчиняется общим закономерностям периодического закона Д.И. Менделеева и увеличивается вниз по подгруппе.
Взаимодействие с простыми веществами
с кислородом
Без нагревания бериллий и магний не реагируют ни с кислородом воздуха, ни с чистым кислородом ввиду того, что покрыты тонкими защитными пленками, состоящими соответственно из оксидов BeO и MgO. Их хранение не требует каких-либо особых способов защиты от воздуха и влаги, в отличие от щелочноземельных металлов, которые хранят под слоем инертной по отношению к ним жидкости, чаще всего керосина.
Be, Mg, Ca, Sr при горении в кислороде образуют оксиды состава MeO, а Ba – смесь оксида бария (BaO) и пероксида бария (BaO2):
Следует отметить, что при горении щелочноземельных металлов и магния на воздухе побочно протекает также реакция этих металлов с азотом воздуха, в результате которой, помимо соединений металлов с кислородом, образуются также нитриды c общей формулой Me3N2.
с галогенами
Бериллий реагирует с галогенами только при высоких температурах, а остальные металлы IIA группы — уже при комнатной температуре:
с неметаллами IV–VI групп
Все металлы IIA группы реагируют при нагревании со всеми неметаллами IV–VI групп, но в зависимости от положения металла в группе, а также активности неметаллов требуется различная степень нагрева. Поскольку бериллий является среди всех металлов IIA группы наиболее химически инертным, при проведении его реакций с неметаллами требуется существенно большая температура.
Следует отметить, что при реакции металлов с углеродом могут образовываться карбиды разной природы. Различают карбиды, относящиеся к метанидам и условно считающимися производными метана, в котором все атомы водорода замещены на металл. Они так же, как и метан, содержат углерод в степени окисления -4, и при их гидролизе или взаимодействии с кислотами-неокислителями одним из продуктов является метан. Также существует другой тип карбидов – ацетилениды, которые содержат ион C2 2- , фактически являющийся фрагментом молекулы ацетилена. Карбиды типа ацетиленидов при гидролизе или взаимодействии с кислотами-неокислителями образуют ацетилен как один из продуктов реакции. То, какой тип карбида – метанид или ацетиленид — получится при взаимодействии того или иного металла с углеродом, зависит от размера катиона металла. С ионами металлов, обладающих малым значением радиуса, образуются, как правило, метаниды, с ионами более крупного размера – ацетилениды. В случае металлов второй группы метанид получается при взаимодействии бериллия с углеродом:
Остальные металлы II А группы образуют с углеродом ацетилениды:
С кремнием металлы IIA группы образуют силициды — соединения вида Me2Si, с азотом – нитриды (Me3N2), фосфором – фосфиды (Me3P2):
с водородом
Все щелочноземельные металлы реагируют при нагревании с водородом. Для того чтобы магний прореагировал с водородом, одного нагрева, как в случае со щелочноземельными металлами, недостаточно, требуется, помимо высокой температуры, также и повышенное давление водорода. Бериллий не реагирует с водородом ни при каких условиях.
Взаимодействие со сложными веществами
с водой
Все щелочноземельные металлы активно реагируют с водой с образованием щелочей (растворимых гидроксидов металлов) и водорода. Магний реагирует с водой лишь при кипячении вследствие того, что при нагревании в воде растворяется защитная оксидная пленка MgO. В случае бериллия защитная оксидная пленка очень стойкая: с ним вода не реагирует ни при кипячении, ни даже при температуре красного каления:
c кислотами-неокислителями
Все металлы главной подгруппы II группы реагируют с кислотами-неокислителями, поскольку находятся в ряду активности левее водорода. При этом образуются соль соответствующей кислоты и водород. Примеры реакций:
c кислотами-окислителями
− разбавленной азотной кислотой
С разбавленной азотной кислотой реагируют все металлы IIA группы. При этом продуктами восстановления вместо водорода (как в случае кислот-неокислителей) являются оксиды азота, преимущественно оксид азота (I) (N2O), а в случае сильно разбавленной азотной кислоты – нитрат аммония (NH4NO3):
− концентрированной азотной кислотой
Концентрированная азотная кислота при обычной (или низкой) температуре пассивирует бериллий, т.е. в реакцию с ним не вступает. При кипячении реакция возможна и протекает преимущественно в соответствии с уравнением:
Магний и щелочноземельные металлы реагируют с концентрированной азотной кислотой с образованием большого спектра различных продуктов восстановления азота.
− концентрированной серной кислотой
Бериллий пассивируется концентрированной серной кислотой, т.е. не реагирует с ней в обычных условиях, однако реакция протекает при кипячении и приводит к образованию сульфата бериллия, диоксида серы и воды:
Барий также пассивируется концентрированной серной кислотой вследствие образования нерастворимого сульфата бария, но реагирует с ней при нагревании, сульфат бария растворяется при нагревании в концентрированной серной кислоте благодаря его превращению в гидросульфат бария.
Остальные металлы главной IIA группы реагируют с концентрированной серной кислотой при любых условиях, в том числе на холоду. Восстановление серы происходит преимущественно до сероводорода:
с щелочами
Магний и щелочноземельные металлы со щелочами не взаимодействуют, а бериллий легко реагирует как растворами щелочей, так и с безводными щелочами при сплавлении. При этом при осуществлении реакции в водном растворе в реакции участвует также и вода, а продуктами являются тетрагидроксобериллаты щелочных или щелочноземельных металлов и газообразный водород:
При осуществлении реакции с твердой щелочью при сплавлении образуются бериллаты щелочных или щелочноземельных металлов и водород
с оксидами
Щелочноземельные металлы, а также магний могут восстанавливать менее активные металлы и некоторые неметаллы из их оксидов при нагревании, например:
Метод восстановления металлов из их оксидов магнием называют магниетермией.
Уравнение химических реакций горения ca
При химических реакциях одни вещества превращаются в другие. Вспомним известную нам реакцию серы с кислородом. И в ней из одних веществ (исходных веществ или реагентов) образуются другие (конечные вещества или продукты реакции).
Для записи и передачи информации о химических реакциях используются схемы и уравнения реакций.
Схема химической реакции – условная запись,дающая качественнуюинформацию о химической реакции.
Схема реакции показывает, какие вещества вступают в реакцию и какие образуются в результате реакции. И в схемах, и в уравнениях реакций вещества обозначаются их формулами.
Схема горения серы записывается так: S8 + O2 SO2.
Это означает, что при взаимодействии серы с кислородом протекает химическая реакция, в результате которой образуется диоксид серы (сернистый газ). Все вещества здесь молекулярные, поэтому при записи схемы использованы молекулярные формулы этих веществ. То же относится и к схеме другой реакции – реакции горения белого фосфора:
P4 + O2 P4O10.
При нагревании до 900 o С карбоната кальция (мела, известняка) протекает химическая реакция: карбонат кальция превращается в оксид кальция (негашеную известь) и диоксид углерода (углекислый газ) по схеме:
CaCO3 CaO + CO2.
Для указания на то, что процесс происходит при нагревании, схему (и уравнение) обычно дополняют знаком » t« , а то, что углекислый газ при этом улетучивается, обозначают стрелкой, направленной вверх:
CaCO3 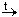
Карбонат кальция и оксид кальция – вещества немолекулярные, поэтому в схеме использованы их простейшие формулы, отражающие состав их формульных единиц. Для молекулярного вещества – углекислого газа – использована молекулярная формула.
Рассмотрим схему реакции, протекающей при взаимодействия пентахлорида фосфора с водой: PCl5 +H2O H3PO4 + HCl.
Из схемы видно, что при этом образуется фосфорная кислота и хлороводород.
Иногда для передачи информации о химической реакции бывает достаточно и краткой схемы этой реакции, например:
S8 SO2; P4 P4O10; CaCO3 CaO.
Естественно, что краткой схеме может соответствовать и несколько разных реакций.
Уравнение химической реакции – условная запись, дающая качественную и количественную информацию о химической реакции.
Для любой химической реакции справедлив один из важнейших законов химии:
При протекании химических реакций атомы не появляются, не исчезают и не превращаются друг в друга.
При записи уравнений химических реакций, кроме формул веществ, используются коэффициенты. Как и в алгебре, коэффициент «1» в уравнении химической реакции не ставится, но подразумевается. Рассмотренные нами реакции описываются следующими уравнениями:
Знак равенства между правой и левой частью уравнения означает, что число атомов каждого элемента, входящих в состав исходных веществ, равно числу атомов этого элемента, входящих в продукты реакциии.
Коэффициенты в уравнении химической реакции показывают отношение между числом реагирующих и числом образующихся молекул (для немолекулярных веществ – числом формульных единиц) соответствующих веществ. Так, для реакции, протекающей при взаимодействии пентахлорида фосфора с водой
и так далее (всего 6 пропорций).Обычно отдельный коэффициент в уравнении реакции не имеет никакого смысла, но в некоторых случаях может означать число молекул или формульных единиц данного вещества.Примеры информации, даваемой схемами и уравнениями реакций.
1-й пример. Реакция горения метана в кислороде (или на воздухе):
СН4 + O2 CO2 + H2O (схема),
СН4+ 2O2 = CO2 + 2Н2О (уравнение).
Схема химической реакции показывает, что (1) в реакции, протекающей между метаном и кислородом, образуются углекислый газ и вода.
Уравнение реакции добавляет, что (2) число молекул метана, вступившего в реакцию, относится к числу молекул вступившего в реакцию кислорода, как 1 к 2, и так далее, то есть:
Кроме того, уравнение показывает, что одна молекула метана реагирует с двумя молекулами кислорода, при этом образуется одна молекула углекислого газа и две молекулы воды.
2-й пример. Восстановление железа водородом из его оксида:
Fe2O3 + H2 Fe + H2O (схема),
Fe2O3 + 3H2 = 2Fe + 3H2О (уравнение).
Схема химической реакции показывает, что (1) при взаимодействии оксида железа(Fe2O3) с водородом (которое происходит при нагревании) образуются железо и вода.
Уравнение добавляет к этому, что (2) число формульных единиц оксида железа, вступившего в реакцию, относится к числу вступивших в реакцию молекул водорода, как 1 к 3, и так далее. То есть:
Кроме того уравнение показывает, что одна формульная единица оксида железа реагирует с тремя молекулами водорода, при этом образуется два атома железа и три молекулы воды.
Как вы узнаете в дальнейшем, уравнения реакций дают нам и другую количественную информацию.
| Карбонат кальция – CaCO3. Бесцветное немолекулярное вещество, нерастворимое в воде. Такие широко известные горные породы, как мрамор и известняк, состоят в основном из карбоната кальция. Мел, которым вы пишете на доске, – тоже карбонат кальция: многие морские организмы (радиолярии и др.) строят свои панцири из этого вещества; за длительное время на дне океана формируются залежи мела, представляющего собой огромные слои спрессованных панцирей этих организмов. Карбонат кальция не обладает способностью плавиться – при нагревании он разлагается. Горные породы, образуемые карбонатом кальция, используются в строительстве в качестве отделочных материалов, строительного камня, а также для производства негашеной извести (CaO). В металлургии карбонат кальция в виде известняка добавляют в руду для лучшего образования шлаков. |


1.Запишите уравнения, соответствующие следующим схемам реакций:
а) Na+ Cl2 NaCl; б) CuO + Al Al2O3 + Сu;
в) N2O N2 + O2; г)NaOH + H2SO4 Na2SO4 + H2O.
2.Какую информацию передают составленными вами уравнениями реакций (среди приведенных веществ молекулярными являются Cl2, N2О, N2, O2, H2SO4 и H2O; остальные – немолекулярные).
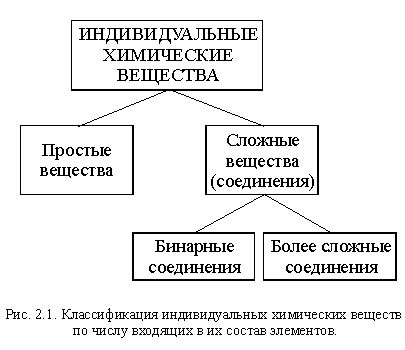
Вы уже познакомились в той или иной степени примерно с пятьюдесятью индивидуальными (чистыми) химическими веществами. Всего же науке известно несколько миллионов таких веществ. Чтобы не утонуть в этом » море» веществ, их необходимо систематизировать и прежде всего классифицировать – классифицировать более подробно, чем мы делали это в параграфе 1.4 (рис. 1.3).
Вещества отличаются друг от друга своими свойствами, а свойства веществ определяются составом и строением. Поэтому важнейшие признаки, по которым классифицируют вещества – состав, строение и свойства.
По составу, а точнее, по числу входящих в их состав элементов, вещества делятся на простые и сложные (это вы уже знаете). Сложных веществ в сотни тысяч раз больше, чем простых, поэтому среди них выделяют бинарные вещества (бинарные соединения).
Бинарные вещества (бинарные соединения) – сложные вещества,в состав которых входят атомы двух элементов.
Схема этой классификации приведена на рисунке 2.1.
Признаком, по которому проводят дальнейшую классификацию веществ, являются их свойства.
Начнем с простых веществ.
По физическим свойствам простые вещества делятся на металлы и неметаллы.
Характерные физические свойства металлов:
1) высокая электропроводность (способность хорошо проводить электрический ток),
2) высокая теплопроводность (способность хорошо проводить теплоту),
3) высокая пластичность (ковкость, изгибаемость, вытягиваемость).
Кроме того все металлы обладают » металлическим» блеском. Но следует помнить, что таким блеском обладают не только металлы, но и часть неметаллов, и даже некоторые сложные вещества. Блестит кристаллический кремний, одна из полиморфных модификаций мышьяка, теллур, а это всё – неметаллы. Из сложных веществ – пирит FeS2, халькопирит CuFeS2 и некоторые другие.
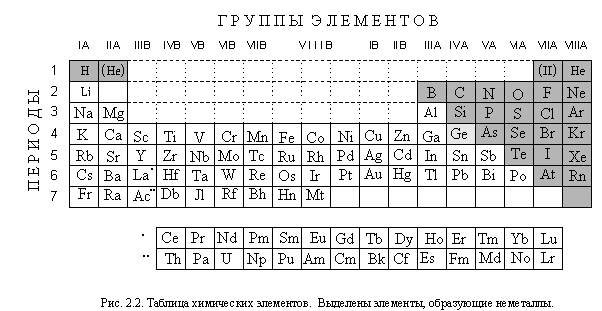
Основой систематизации химических элементов, простых веществ и соединений служит ЕСТЕСТВЕННАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ, открытая в 1869 году выдающимся русским химиком Дмитрием Ивановичем Менделеевым (1834 –1907) и названная им » периодической системой» . Усовершенствованная многими поколениями ученых, эта система продолжает называться » периодической» , хотя это и не совсем правильно. Графически система химических элементов выражается в виде таблицы элементов (рис. 2.2); со строением этой таблицы вы подробно познакомитесь, изучая главу 6. Пока же посмотрим, где в таблице элементов расположены элементы, образующие неметаллы, а где – элементы, образующие металлы. Оказывается, элементы, образующие неметаллы, группируются в правом верхнем углу таблицы элементов. Все остальные элементы – элементы , образующие металлы. Причину этого вы узнаете, изучив строение атомов и химические связи.
При комнатной температуре металлы – твердые вещества (исключение – ртуть, ее температура плавления – 39 o С).
В отличие от металлов, неметаллы не обладают каким-либо определенным набором характерных физических характеристик. Даже агрегатное состояние у них может быть разным. При комнатной температуре газообразныдвенадцать простых веществ (Н2, Не, N2, O2, O3, F2, Nе, Cl2, Аr, Кr, Хе, Rn), жидкость одна (Br2), а твердых веществ – более десяти (В, С(алмаз), С(графит), Si, P4, S8, As, Se, Те, I2 и др.). По своим химическим свойствам большинство металлов сильно отличается от большинства неметаллов, но резкой границы между ними нет.
Многие простые вещества при определенных условиях могут вступать в реакции друг с другом, например:
В результате таких реакций образуются бинарные соединения.
В принципе, в состав бинарного соединения могут входить любые элементы (кроме гелия и неона). Но часто один из этих элементов – кислород, водород или один из галогенов (фтор, хлор, бром или йод). Такие вещества называются кислородными соединениями, водородными соединениями или галогенидами. Примеры бинарных соединений: CaO, Al2O3, КН, HCl, АlI3, СаС2.
| Кислородное соединение – бинарное соединение, один из элементов в котором кислород. |
Примеры кислородных соединений: H2O (вода), H2O2 (пероксид водорода), Na2O (оксид натрия), Na2O2 (пероксид натрия), СО2 (диоксид углерода), OF2 (фторид кислорода). Большинство кислородных соединений является оксидами. Чем оксиды отличаются от остальных кислородных соединений, вы узнаете позже.
Примеры оксидов:
Li2O – оксид лития, CO2 – диоксид углерода, CaO – оксид кальция, SiO2 – диоксид кремния, Al2O3 – оксид алюминия, Н2О – вода,
MnO2 – диоксид марганца, SO3 –триоксид серы.
| Водородное соединение – бинарное соединение, один из элементов в котором водород. |
Примеры водородных соединений: NаН – гидрид натрия, H2O – вода, КН – гидрид калия, НСl – хлороводород, СаH2 – гидрид кальция,
NH3 – аммиак, BaH2 – гидрид бария, CH4 – метан.
Галогенид (фторид, хлорид, бромид или – бинарное соединение,один из элементов в котором – галоген.
Примеры галогенидов: CaF2 – фторид кальция, BF3 – трифторид бора, NaCl – хлорид натрия,PCl5 – пентахлорид фосфора, КВr – бромид калия, НВr – бромоводород, AlI3 – йодид алюминия, HI – йодоводород.
Примеры названий бинарных соединений приведены в таблице 6.
http://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/himicheskie-svojstva-metallov-iia-gruppy
http://www.chem.msu.su/rus/school/zhukov1/02a.html