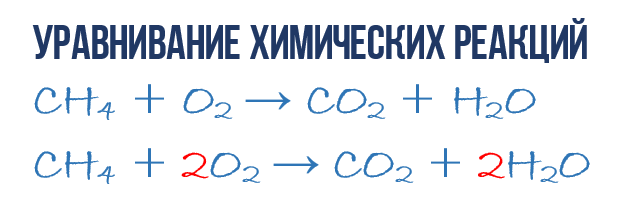Урок 8 Бесплатно Химическая реакция- уравнение и типы
Начало
Продолжим изучение химической реакции как одной из основ химической науки.
Ведь полноценное понимание этой темы нужно для дальнейшего изучения химии, и в то же время это сделает вас образованнее не только в научном плане, но и в бытовом!
Уравнение химической реакции
Вся информация о протекающей химической реакции (исходные вещества, продукты реакции, условия протекания, тепловой эффект) на письме фиксируется в виде уравнения реакции.
Уравнение можно записать для любой реакции. Для этого нужно знать состав молекул исходных веществ и продуктов.
Всё это записывается в виде химических формул.
Всё происходит как в математике: в левой части записываются формулы исходных веществ, а в правой – формулы продуктов.
Только вместо знака «равно» чаще всего ставят стрелку: она показывает, что реакция идёт именно в этом направлении.
У меня есть дополнительная информация к этой части урока!
В некоторых случаях возможно протекание реакции при одних и тех же условиях в обоих направлениях. В таком случае обычно ставят две стрелки в обе стороны, но также и допустимо ставить знак «равно».
В некоторых случаях (когда это требуется) указывают условия протекания реакции и тепловой эффект реакции.
Условия протекания записывают над стрелкой, а тепловой эффект – в виде количества теплоты в левой части, если реакция эндотермическая, и в правой части, если экзотермическая.
Для примера запишем уравнение реакции водорода с кислородом:
Зигзаг обозначает искру – условие для начала реакции, а «+ Q» – то, что в результате реакции выделяется энергия.
В зависимости от конкретных задач условия протекания и тепловой эффект могут вообще не отмечать или отмечать конкретное числовое значение теплового эффекта.
Если среди продуктов реакции есть газ, около его формулы пишут стрелку вверх.
Например, когда мы капаем на рану перекись водорода, под действием ферментов крови она разлагается с выделением кислорода:
У меня есть дополнительная информация к этой части урока!
Кислород обладает обеззараживающим действием и способствует более быстрой свёртываемости крови!
Перекись водорода может разлагаться не только под воздействием ферментов крови, но и многих других веществ.
Разложение перекиси водорода в присутствии оксида марганца (IV) (Оксид марганца (IV) в химической реакции не участвует).
Если реакция идет в растворе и в результате выпадает осадок, то пишут стрелку вниз.
Садовые деревья весной обрабатывают от паразитов «бордосской жидкостью». Чтобы её приготовить, смешивают растворы извести и медного купороса.
При этом наблюдается выпадение хлопьев, которые состоят сразу из двух нерастворимых веществ: гидроксида меди и сульфата кальция.
Получившийся сульфат кальция, гипс, образует корку, которая будет дольше держаться на стволе дерева, и поэтому такая смесь дольше защищает его от вредителей.
Запишем уравнение этой реакции
Как правильно читать уравнение химической реакции?
В химии принято делать это примерно так: «один моль сульфата меди реагирует с одним молем гидроксида кальция с образованием одного моля гидроксида меди и одного моля сульфата кальция».
То есть коэффициент перед формулой вещества считают количеством вещества в молях, а не количеством молекул.
Ведь в реальной жизни мы наблюдаем реакцию не единичных молекул, а большого объема веществ.
При составлении уравнений химики опираются на два основных закона природы: закона сохранения массы и закона постоянства состава веществ.
Пройти тест и получить оценку можно после входа или регистрации
Уравнение химической реакции это химия
§ 5.1 Химические реакции. Уравнения химических реакций
Химическая реакция — это превращение одних веществ в другие. Впрочем, такое определение нуждается в одном существенном дополнении. В ядерном реакторе или в ускорителе тоже одни вещества превращаются в другие, но такие превращения химическими не называют. В чем же здесь дело? В ядерном реакторе происходят ядерные реакции. Они заключаются в том, что ядра элементов при столкновении с частицами высокой энергии (ими могут быть нейтроны, протоны и ядра иных элементов) — разбиваются на осколки, представляющие собой ядра других элементов. Возможно и слияние ядер между собой. Эти новые ядра затем получают электроны из окружающей среды и, таким образом, завершается образование двух или нескольких новых веществ. Все эти вещества являются какими-либо элементами Периодической системы. Примеры ядерных реакций, используемых для открытия новых элементов, приведены в §4.4.
В отличие от ядерных реакций, в химических реакциях не затрагиваются ядра атомов. Все изменения происходят только во внешних электронных оболочках. Разрываются одни химические связи и образуются другие.
Химическими реакциями называются явления, при которых одни вещества, обладающие определенным составом и свойствами, превращаются в другие вещества — с другим составом и другими свойствами. При этом в составе атомных ядер изменений не происходит.
Рассмотрим типичную химическую реакцию: сгорание природного газа (метана) в кислороде воздуха. Те из вас, у кого дома есть газовая плита, могут ежедневно наблюдать эту реакцию у себя на кухне. Запишем реакцию так, как показано на рис. 5-1.
Рис. 5-1. Метан СН 4 и кислород О 2 реагируют между собой с образованием диоксида углерода СО 2 и воды Н 2 О. При этом в молекуле метана разрываются связи между С и Н и на их месте возникают связи углерода с кислородом. Атомы водорода, ранее принадлежавшие метану, образуют связи с кислородом. На рисунке хорошо видно, что для успешного осуществления реакции на одну молекулу метана надо взять две молекулы кислорода.
Записывать химическую реакцию с помощью рисунков молекул не слишком удобно. Поэтому для записи химических реакций используют сокращенные формулы веществ — как это показано в нижней части рис. 5-1. Такая запись называется уравнением химической реакции .
Количество атомов разных элементов в левой и правой частях уравнения одинаково. В левой части один атом углерода в составе молекулы метана (СН 4 ), и в правой — тот же атом углерода мы находим в составе молекулы СО 2 . Все четыре водородных атома из левой части уравнения мы обязательно найдем и в правой — в составе молекул воды.
В уравнении химической реакции для выравнивания количества одинаковых атомов в разных частях уравнения используются коэффициенты , которые записываются перед формулами веществ. Коэффициенты не надо путать с индексами в химических формулах.
Рассмотрим другую реакцию — превращение оксида кальция СаО (негашеной извести) в гидроксид кальция Са(ОН) 2 (гашеную известь) под действием воды.
Рис. 5-2. Оксид кальция СаО присоединяет молекулу воды Н 2 О с образованием
гидроксида кальция Са(ОН) 2 .
В отличие от математических уравнений, в уравнениях химических реакций нельзя переставлять левую и правую части. Вещества в левой части уравнения химической реакции называются реагентами , а в правой — продуктами реакции . Если сделать перестановку левой и правой части в уравнении из рис. 5-2, то мы получим уравнение совсем другой химической реакции:
Если реакция между СаО и Н 2 О (рис. 5-2) начинается самопроизвольно и идет с выделением большого количества теплоты, то для проведения последней реакции, где реагентом служит Са(ОН) 2 , требуется сильное нагревание.
Обратите внимание: вместо знака равенства в уравнении химической реакции можно использовать стрелку. Стрелка удобна тем, что показывает направление течения реакции.
Добавим также, что реагентами и продуктами могут быть не обязательно молекулы, но и атомы — если в реакции участвует какой-нибудь элемент или элементы в чистом виде. Например:
H 2 + CuO = Cu + H 2 O
Существует несколько способов классификации химических реакций, из которых мы рассмотрим два.
По первому из них все химические реакции различают по признаку изменения числа исходных и конечных веществ . Здесь можно найти 4 типа химических реакций:
Приведем конкретные примеры таких реакций. Для этого вернемся к уравнениям получения гашеной извести и уравнению получения негашеной извести:
СаО + Н 2 О = Са(ОН) 2
Са(ОН) 2 = СаО + Н 2 О
Эти реакции относятся к разным типам химических реакций. Первая реакция является типичной реакцией соединения , поскольку при ее протекании два вещества СаО и Н 2 О соединяются в одно: Са(ОН) 2 .
Вторая реакция Са(ОН) 2 = СаО + Н 2 О является типичной реакцией разложения : здесь одно вещество Ca(OH) 2 разлагается с образованием двух других.
В реакциях обмена количество реагентов и продуктов обычно одинаково. В таких реакциях исходные вещества обмениваются между собой атомами и даже целыми составными частями своих молекул. Например, при сливании раствора CaBr 2 с раствором HF выпадает осадок. В растворе ионы кальция и водорода обмениваются между собой ионами брома и фтора. Реакция происходит только в одном направлении потому, что ионы кальция и фтора связываются в нерастворимое соединение CaF 2 и после этого «обратный обмен» ионами уже невозможен:
CaBr 2 + 2HF = CaF 2 ¯ + 2HBr
При сливании растворов CaCl 2 и Na 2 CO 3 тоже выпадает осадок, потому что ионы кальция и натрия обмениваются между собой частицами CO 3 2– и Cl – с образованием нерастворимого соединения — карбоната кальция CaCO 3 .
CaCl 2 + Na 2 CO 3 = CaCO 3 ¯ + 2NaCl
Стрелка рядом с продуктом реакции показывает, что это соединение нерастворимо и выпадает в осадок. Таким образом, стрелку можно использовать и для обозначения удаления какого-нибудь продукта из химической реакции в виде осадка ( ¯ ) или газа (↑). Например:
Zn + 2HCl = H 2 ↑ + ZnCl 2
Последняя реакция относится к еще одному типу химических реакций — реакциям замещения . Цинк заместил водород в его соединении с хлором (HCl). Водород при этом выделяется в виде газа.
Реакции замещения внешне могут быть похожи на реакции обмена. Отличие заключается в том, что в реакциях замещения обязательно участвуют атомы какого-нибудь простого вещества, которые замещают атомы одного из элементов в сложном веществе. Например:
2NaBr + Cl 2 = 2NaCl + Br 2 — реакция замещения ;
в левой части уравнения есть простое вещество – молекула хлора Cl 2 , и в правой части есть простое вещество – молекула брома Br 2 .
В реакциях обмена и реагенты и продукты являются сложными веществами. Например:
CaCl 2 + Na 2 CO 3 = CaCO 3 ¯ + 2NaCl — реакция обмена ;
в этом уравнении реагенты и продукты — сложные вещества.
Деление всех химических реакций на реакции соединения, разложения, замещения и обмена — не единственное. Есть другой способ классификации: по признаку изменения (или отсутствия изменения) степеней окисления у реагентов и продуктов. По этому признаку все реакции делятся на окислительно-восстановительные реакции и все прочие (не окислительно-восстановительные).
Реакция между Zn и HCl является не только реакцией замещения, но и окислительно-восстановительной реакцией , потому что в ней изменяются степени окисления реагирующих веществ:
Zn 0 + 2H +1 Cl = H 2 0 + Zn +2 Cl 2 — реакция замещения и одновременно окислительно-восстановительная реакция.
Окислительно-восстановительными являются также реакции метана с кислородом (рис. 5-1), реакция оксида меди с водородом, реакция бромида натрия с хлором.
меняют степень окисления углерод и кислород,
меняют степень окисления водород и медь,
меняют степень окисления бром и хлор.
А вот все остальные реакции, рассмотренные в этом параграфе, окислительно-восстановительными не являются, потому что в них не изменяются степени окисления атомов ни в реагентах, ни в продуктах.
5.1. На месте знаков “?” правильно заполните пропуски в уравнениях химических реакций:
Ca + 2HCl = Ca”?” + H 2 ↑
2H 2 ”?” + 3O 2 = 2H 2 O + 2SO 2
Fe 2 O 3 + 3H 2 = 2Fe + 3”?”O
CaCl 2 + 2NaOH = Ca(OH) 2 + 2Na”?”
5.2. Приведены 8 разных химических реакций. а) Найдите среди них реакции соединения, разложения, замещения и обмена. Запишите их уравнения в 4 столбика (по две реакции каждого типа в столбике); б) Уравняйте реакции; в) Подчеркните те реакции, которые являются окислительно-восстановительными. Укажите в них степени окисления атомов в реагентах и продуктах:
H 2 + O 2 = H 2 O (реакция идет со взрывом)
Zn + CuCl 2 = Cu + ZnCl 2 (реакция происходит в растворе)
NH 3 = N 2 + H 2 (реакция идет при нагревании в газовой фазе)
Cu + S = CuS (реакция идет при нагревании порошков Cu и S)
AgF + NaCl = AgCl ¯ + NaF (реакция происходит в растворе)
CaCO 3 = CaO + CO 2 ↑ (реакция происходит при нагревании)
CuBr 2 + NaOH = Cu(OH) 2 ¯ + NaBr (реакция происходит в растворе)
Fe + H 2 O = H 2 ↑ + Fe 2 O 3 (реакция происходит при нагревании)
Урок 13. Составление химических уравнений
В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
Химическое уравнение
В результате реакции горения метана CH4 в кислороде O2 образуются диоксид углерода CO2 и вода H2O. Эта реакция может быть описана химическим уравнением:
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и H 2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Начнем с углерода. В левой части один атом С входит в состав молекулы CH4, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H4 = 4H) в составе молекулы CH4, а в правой – всего 2 атома H в составе молекулы H2O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H2O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H2O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя H2O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C7H5N3O6 + O2 → CO2 + H2O + N2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты, а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро NA=6,022·10 23 , мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей H2O и 6 молей N2.
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O 2 = 31,999 г/моль
- CO 2 = 44,010 г/моль
- H 2 O = 18,015 г/моль
- N 2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г H2O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO 2 | |
| 671,98 г CO 2 | 180,15 г H 2 O | |
| 168,08 г N 2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO 3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 :
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и H2O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H + и Cl — . Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO3 реагирует с двумя гидратированными ионами H + , образуя при этом положительный ион Ca 2+ , CO2 и H2O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
http://hemi.nsu.ru/text151.htm
http://himi4ka.ru/arhiv-urokov/urok-13-sostavlenie-himicheskih-uravnenij.html