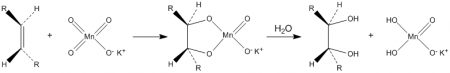
Уравнение химической реакции kmno4 назовите продукты
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
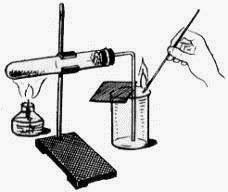
Практическая работа по теме: «Получение и свойства кислорода»
Цель работы
- Получить кислород (методом вытеснения воздуха) и изучить его свойства.
Необходимое оборудование и реактивы
- штатив лабораторный с лапкой или пробиркодержатель;
- спиртовка;
- два химических стакана;
- стеклянная пластинка;
- пробирка;
- пробка с газоотводной трубкой;
- ложка для сжигания веществ;
- спички;
- лучинка;
- вата.
- перманганат калия (твердый) KMnO4;
- уголь С;
- известковая вода — Са(ОН)2.
Работа со спиртовкой:
- Не переносите горящую спиртовку с места на место.
- Гасите спиртовку только с помощью колпачка.
- При нагревании не забудьте прогреть пробирку. Для этого пробирку, закрепленную в лапке штатива, медленно проведите сквозь пламя от донышка до отверстия и обратно. Эту операцию повторите несколько раз: чтобы стекло равномерно прогрелось. Признаком прогрева стекла можно считать исчезновение запотевания на стенках пробирки.
- Дно пробирки должно находиться в верхней части пламени.
- Дно пробирки не должно касаться фитиля.
Работа со стеклом:
- Помните, что горячее стекло по внешнему виду не отличается от холодного. Не прикасайтесь к горячей пробирке.Закрепляя пробирку в лапке штатива, не закручивайте сильно винт. При нагревании стекло расширяется и пробирка может треснуть.
Проверка прибора на герметичность:
- Закройте пробирку пробкой с газоотводной трубкой, опустите конец трубки в стакан с водой. Плотно обхватите ладонью пробирку и внимательно следите за появлением пузырьков воздуха.
ВЫПОЛНЕНИЕ РАБОТЫ
Загрузите по очереди три следующих видео — опыта и внимательно наблюдайте за экспериментом:
1. Получение кислорода (нажмите «Посмотреть опыт»)
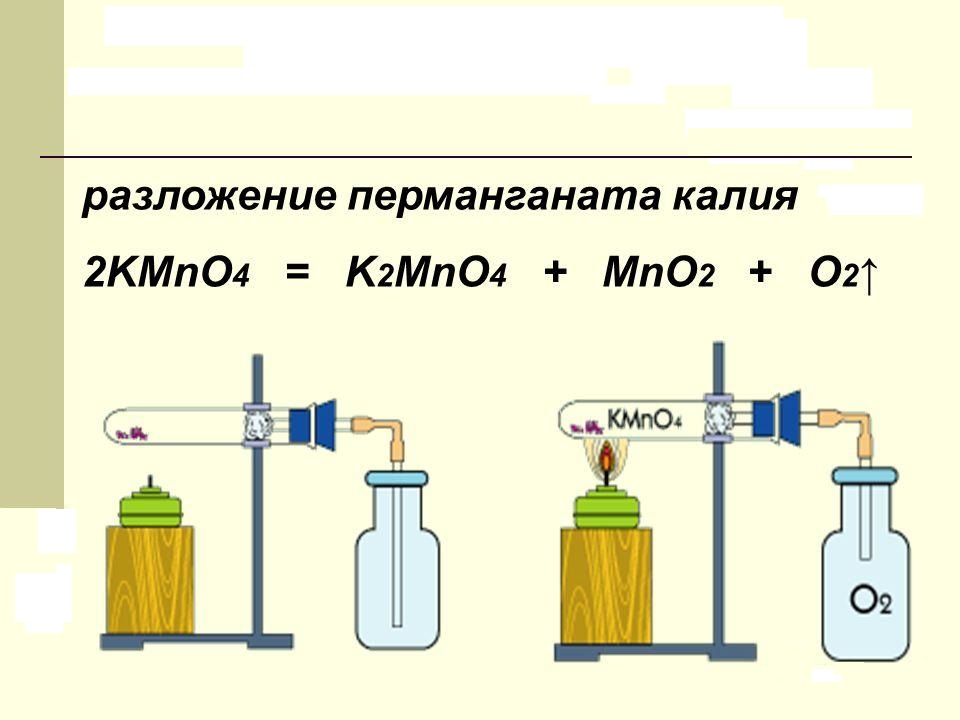
Кислород( O 2 ) в лаборатории получают разложением перманганата калия KMnO 4(марганцовки). Для опыта понадобится пробирка с газоотводной трубкой. В пробирку насыпаем кристаллический перманганат калия. Для сбора кислорода приготовим колбу. При нагревании перманганат калия начинает разлагаться, выделяющийся кислород поступает по газоотводной трубке в колбу. Кислород тяжелее воздуха, поэтому не покидает колбу и постепенно заполняет ее. Тлеющая лучинка вспыхивает в колбе: значит нам удалось собрать кислород.
Чистый кислород впервые получили независимо друг отдруга шведский химик Шееле (при прокаливании селитры) и английский ученый Пристли (при разложении оксидов ртути и свинца). До их открытия ученые считали, что воздух ‑ однородная субстанция. После открытия Шееле и Пристли Лавуазье создал теорию горения и назвал новый элемент Oxygenium (лат.) – рождающий кислоту, кислород. Кислород — необходим для поддержания жизни. Человек может выдержать без кислорода всего несколько минут.
2. Обнаружение кислорода
Кислород поддерживает горение — это свойство кислорода используется для его обнаружения
Кислород активно взаимодействует со многими веществами. Посмотрим, как реагирует кислород с углем. Для этого раскалим кусочек угля на пламени спиртовки. На воздухе уголь едва тлеет, потому что кислорода в атмосфере около двадцати процентов по объему. В колбе с кислородом уголь раскаляется. Горение углерода становится интенсивным. При сгорании углерода образуется углекислый газ: С+О2= СО2
Добавим в колбу с газом известковую воду – она мутнеет. Известковая вода обнаруживает углекислый газ. Вспомните, как разжигают гаснущий костер. Дуют на угли или интенсивно обмахивают их для того, чтобы увеличить подачу кислорода в зону горения.
Оформите и сдайте отчёт о проделанной работе
Практическая работа №3
Получение и свойства кислорода
Цель работы :
Получить кислород (методом вытеснения воздуха) и изучить его свойства.
Приборы и оборудование : KMnO4 – перманганат калия (марганцовка), С – древесный уголь , известковая вода, пробка с газоотводной трубкой, лучинка, спиртовка, спички, колба, вата, пробирка.
Ход работы :
Название опыта, рисунок
Наблюдения, выводы
Уравнение химической реакции
1. Получение и собирание кислорода
2. Обнаружение кислорода тлеющей лучиной
3. Сжигание древесного угля в кислороде
C + O2 t = . (назовите продукты)
Вывод: __________________________________________
Разложение перманганата калия. Свойства солей марганцевой кислоты
Окислительно-восстановительные процессы лежат в основе важнейших явлений живой и неживой природы: горения, разложения сложных веществ, синтеза органических соединений. Перманганат калия, свойства которого мы изучим в нашей статье, относится к наиболее сильным окислителям, применяемым в лабораторных и промышленных условиях. Его окислительные способности зависят от степени окисления атома, которая меняется в ходе реакции. Рассмотрим это на конкретных примерах химических процессов, происходящих с участием молекул KMnO4.
Характеристика вещества
Рассматриваемое нами соединение (перманганат калия) является одним из наиболее применяемых в промышленности веществ – соединений марганца. Соль представлена кристаллами в виде правильных призм темно-фиолетового цвета. Она хорошо растворяется в воде и образует раствор малинового цвета, обладающий прекрасными бактерицидными характеристиками. Поэтому вещество нашло широкое применение как в медицине, так и в быту в качестве бактерицидного средства. Как и другие соединения семивалентного марганца, соль способна окислять многие соединения органической и неорганической природы. К разложению перманганата калия прибегают в химических лабораториях для получения небольших объемов чистого кислорода. Соединение окисляет сульфитную кислоту в сульфатную. В промышленности KMnO4 применяется для выделения газообразного хлора из соляной кислоты. Оно также окисляет большинство органических веществ, способно переводить соли двухвалентного железа в форму его трехвалентных соединений.
Опыты с марганцовкой
Вещество, в быту называемое марганцовкой, при нагревании разлагается. В продуктах реакции обнаруживается свободный кислород, двуокись марганца и новая соль – K2MnO4. В лаборатории этот процесс проводят для получения чистого кислорода. Химическое уравнение разложения перманганата калия можно представить так:
Сухое вещество, представляющее собой фиолетовые кристаллы в виде правильных призм, нагревают до температуры +200 °C. Катион марганца, находящийся в составе соли, имеет степень окисления, равную +7. Она снижается в продуктах реакции до величин +6 и +4 соответственно.
Окисление этилена
Газообразные углеводороды, относящиеся к различным классам органических соединений, имеют как одинарные, так и кратные связи между атомами углерода в составе своих молекул. Как определить присутствие пи-связей, лежащих в основе непредельного характера органического соединения? Для этого проводят химические опыты, пропуская исследуемое вещество (например, этен или ацетилен) через фиолетовый раствор перманганата калия. Наблюдается его обесцвечивание, так как непредельная связь разрушается. Молекула этилена окисляется и из непредельного углеводорода превращается в двухатомный предельный спирт – этиленгликоль. Данная реакция является качественной на наличие двойных или тройных связей.
Особенности химических проявлений KMnO4
Если степени окисления реагентов и продуктов реакции изменяются, значит происходит реакция окисления-восстановления. В ее основе лежит явление перемещения электронов от одних атомов к другим. Как и в случае с разложением перманганата калия, так и в других реакциях, вещество проявляет ярко выраженные свойства окислителя. Например, в подкисленном растворе сернистокислого натрия и перманганата калия образуется сульфаты натрия, калия и марганца, а также вода:
В этом случае ион серы является восстановителем, а марганец, входящий в сложный анион MnO4 — , проявляет свойства окислителя. Он принимает пять электронов, поэтому степень его окисления снижается с +7 до +2.
Влияние среды на протекание химической реакции
В зависимости от концентрации ионов водорода или гидроксильных групп различают кислый, щелочной или нейтральный характер раствора, в котором происходит окислительно-восстановительная реакция. Например, при избыточном содержании катионов водорода, ион марганца со степенью окисления +7 в перманганате калия понижает ее до +2. В щелочной среде, при высокой концентрации гидроксильных групп, сульфит натрия, взаимодействуя с перманганатом калия, окисляется до сульфата. Ион марганца со степенью окисления +7 переходит в катион с зарядом +6, находящийся в составе K2MnO4, раствор которого имеет зеленую окраску. В нейтральной среде сульфит натрия и перманганат калия реагируют между собой, при этом осаждается двуокись марганца. Степень окисления катиона марганца уменьшается с +7 до +4. В продуктах реакции также обнаруживаются сульфат натрия и щелочь – гидроксид натрия.
Применение солей марганцевой кислоты
Реакция разложения перманганата калия при нагревании и другие окислительно-восстановительные процессы, проходящие с участием солей марганцевой кислоты, часто используются в промышленности. Например, окисление многих органических соединений, выделение газообразного хлора из соляной кислоты, превращение солей двухвалентного железа в трехвалентное. В сельском хозяйстве раствор KMnO4 применяют для предпосевной обработки семян и почвы, в медицине им обрабатывают поверхность ран, дезинфицируют воспаленные слизистые оболочки носовой полости, используют для обеззараживания предметов личной гигиены.
В нашей статье мы не только подробно изучили процесс разложения перманганата калия, но также рассмотрели его окислительные свойства и применение в быту и промышленности.
Перманганат калия ГОСТ 20490-75
| Перманганат калия | |
|---|---|
 | |
 | |
| Систематическое наименование | Перманганат калия |
| Традиционные названия | Марганцовокислый калий, марганцовка |
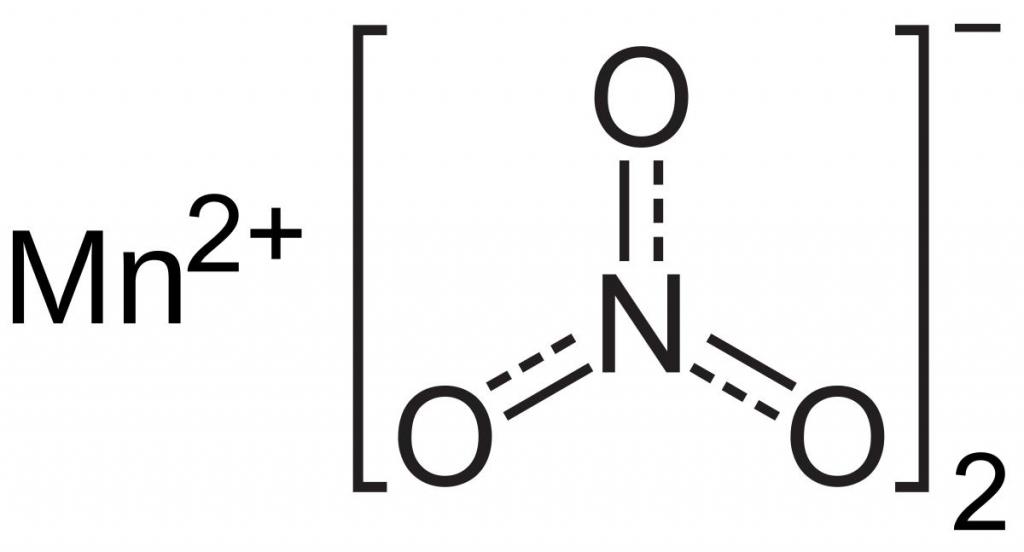
| Хим. формула | KMnO4 |
| Состояние | твердое (хрупкие кристаллы) |
| Молярная масса | 158,034 г/моль |
| Плотность | 2,703 г/см³ |
| Т. разл. | 240 °C |
| Мол. теплоёмк. | 119,2 Дж/(моль·К) |
| Энтальпия образования | -813,4 кДж/моль |
| Растворимость в воде | 6,38 (20 °C) |
| Рег. номер CAS | ГОСТ 5777-84 ГОСТ 20490-75 |
| Рег. номер CAS | 7722-64-7 |
| PubChem | 516875 |
| Рег. номер EINECS | 231-760-3 |
| SMILES | |
| Рег. номер EC | 231-760-3 |
| RTECS | SD6475000 |
| Номер ООН | 1490 |
| ChemSpider | 22810 |
| Токсичность | низкая |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Перманганат калия (лат. Kalii permanganas , распространённое название в быту — марганцовка) — марганцовокислый калий, калиевая соль марганцовой кислоты. Химическая формула — KMnO4. Представляет собой тёмно-фиолетовые, почти чёрные кристаллы, при растворении в воде образующие ярко окрашенный раствор цвета фуксии.
Содержание
- 1 Физические свойства
- 1.1 Термодинамические свойства
- 2 Химические свойства
- 3 Применение
- 3.1 Медицинское применение
- 3.1.1 Фармакологическое действие
- 3.1.2 Показания
- 3.1.3 Противопоказания
- 3.1.4 Способ применения и дозы
- 3.2 Предосторожности
- 3.3 Другие сферы применения
- 3.1 Медицинское применение
- 4 Получение
- 5 Ограничение на покупку
Физические свойства
Внешний вид: тёмно-фиолетовые кристаллы с металлическим блеском. Показатель преломления составляет 1,59 (при 20 °C).
Растворяется в воде (см. таблицу), жидком аммиаке, ацетоне (2:100), метаноле, пиридине.
| Стандартная энтальпия образования ΔH | −813,4 кДж/моль (т) (при 298 К) |
|---|---|
| Стандартная энергия Гиббса образования G | −713,8 кДж/моль (т) (при 298 К) |
| Стандартная энтропия S | 171,71 Дж/(моль·K) (т) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 119,2 Дж/(моль·K) (т) (при 298 К) |
Химические свойства
| Окисленная форма | Восстановленная форма | Среда | E 0 , В |
|---|---|---|---|
| MnO4 − | MnO4 2− | OH − | +0,56 |
| MnO4 − | H2MnO4 | H + | +1,22 |
| MnO4 − | MnO2 | H + | +1,69 |
| MnO4 − | MnO2 | OH − | +0,60 |
| MnO4 − | Mn 2+ | H + | +1,51 |
Является сильным окислителем. В зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца(II), в нейтральной — до соединений марганца(IV), в сильно щелочной — до соединений марганца(VI). Примеры реакций приведены ниже (на примере взаимодействия с сульфитом калия):
- в кислой среде:
2KMnO4 + 5K2SO3 + 3H2SO4 → 6K2SO4 + 2MnSO4 + 3H2O
- в нейтральной среде:
2KMnO4 + 3K2SO3 + H2O → 3K2SO4 + 2MnO2 + 2KOH
- в щелочной среде:
2KMnO4 + K2SO3 + 2KOH → K2SO4 + 2K2MnO4 + H2O
Однако надо отметить, что последняя реакция (в щелочной среде) идёт по указанной схеме только при недостатке восстановителя и высокой концентрации щёлочи, которая обеспечивает замедление гидролиза манганата калия.
При соприкосновении с концентрированной серной кислотой перманганат калия взрывается, однако при аккуратном соединении с холодной кислотой реагирует с образованием неустойчивого оксида марганца(VII):
при этом в качестве промежуточного продукта может образовываться интересное соединение — оксосульфат марганца MnO3HSO4. По реакции с фторидом иода(V) можно получить аналогичный оксофторид:
При нагревании разлагается с выделением кислорода (этим способом пользуются в лаборатории для получения чистого кислорода). Схему реакции упрощённо можно представить уравнением:
На самом деле реакция идёт намного сложнее, например, при не очень сильном нагревании её можно примерно описать уравнением:
Реагирует с солями двухвалентного марганца, например:
Эта реакция в принципе обратна дисмутации (диспропорционирование) K2MnO4 на MnO2 и KMnO4.
Окисляет органические вещества. В частности, разбавленные растворы перманганата калия в щелочной и нейтральной среде окисляют алкены до диолов (реакция Вагнера):
Водные растворы перманганата калия термодинамически нестабильны, но кинетически довольно устойчивы. Их сохранность резко повышается при хранении в темноте.
При смеси с пероксидом водорода протекает следующая реакция:
Применение
Применение этой соли чаще всего основано на высокой окисляющей способности перманганат-иона, обеспечивающей антисептическое действие.
Медицинское применение
| Другие названия | |
|---|---|
| Лекарственные формы | |
| Классификация | |
| Химическое соединение | |
| Перманганат калия | |
| Kalii permanganas | |
| ИЮПАК | Перманганат калия |
| Брутто-формула | KMnO₄ |
| CAS | 7722-64-7 |
| PubChem | 516875 |
| DrugBank | 13831 |
| Фармакол. группа | Антисептики и дезинфицирующие средства |
| АТХ | D08AX06 |
| порошок для приготовления раствора | |
| KMnO4, Калия перманганат, Марганцовка, Хамелеон минеральный, Марганцевокислый калий, Марганцовокислый калий, Калий марганцевокислый | |
| Перманганат калия | |
Разбавленные растворы (около 0,1 %) перманганата калия нашли широчайшее применение в медицине как антисептическое средство, для полоскания горла, промывания ран, обработки ожогов. В качестве рвотного средства для приёма внутрь при отравлениях морфином, аконитином и некоторыми другими алкалоидами используют разбавленный (0,02—0,1 %) раствор перманганата калия.
Фармакологическое действие
Антисептическое средство. При соприкосновении с органическими веществами выделяет атомарный кислород. Образующийся при восстановлении препарата оксид образует с белками комплексные соединения — альбуминаты (за счёт этого калия перманганат в малых концентрациях оказывает вяжущее, а в концентрированных растворах — раздражающее, прижигающее и дубящее действие). Обладает также дезодорирующим эффектом. Эффективен при лечении ожогов и язв. Способность калия перманганата обезвреживать некоторые яды лежит в основе использования его растворов для промывания желудка при отравлениях неизвестным ядом и пищевых токсикоинфекциях. При попадании внутрь всасывается, оказывая действие (приводит к развитию метгемоглобинемии).
Показания
Смазывание язвенных и ожоговых поверхностей — инфицированные раны, язвы и ожоги кожи. Полоскание полости рта и ротоглотки — при инфекционно-воспалительных заболеваниях слизистой оболочки полости рта и ротоглотки (в том числе при ангинах). Для промывания и спринцеваний при гинекологических и урологических заболеваниях — кольпиты и уретриты. Для промываний — желудка при отравлениях, вызванных приёмом внутрь алкалоидов (морфин, аконитин, никотин), синильной кислотой, фосфором, хинином; кожи — при попадании на неё анилина; глаз — при поражении их ядовитыми насекомыми.
Противопоказания
При передозировке: резкая боль в полости рта, по ходу пищевода, в животе, рвота, диарея; слизистая оболочка полости рта и глотки — отёчная, тёмно-коричневого, фиолетового цвета, возможен отёк гортани, развитие механической асфиксии, ожогового шока, двигательного возбуждения, судорог, явлений паркинсонизма, геморрагического колита, нефропатии, гепатопатии. При пониженной кислотности желудочного сока возможно развитие метгемоглобинемии с выраженным цианозом и одышкой. Смертельная доза для детей — около 3 г , для взрослых — 0,3—0,5 г/кг .
Лечение: метиленовый синий ( 50 мл 1 % раствора), аскорбиновая кислота (внутривенно — 30 мл 5 % раствора), цианокобаламин — до 1 мг , пиридоксин (внутримышечно — 3 мл 5 % раствора).
Способ применения и дозы
Наружно, в водных растворах для промывания ран ( 0,1—0,5 % ), для полоскания рта и горла ( 0,01—0,1 % ), для смазывания язвенных и ожоговых поверхностей ( 2—5 % ), для спринцевания ( 0,02—0,1 % ) в гинекологической и урологической практике, а также промывания желудка при отравлениях.
Предосторожности
Активно взаимодействует при нагреве и даже при комнатной температуре с большинством восстановителей, например, органическими веществами (сахарозой, танинами, глицерином и многими другими), легкоокисляющимися веществами, поэтому при смешивании происходит саморазогревание, что иногда вызывает самовоспламенение смеси (с концентрированным раствором глицерина, или безводным — всегда) и может привести к взрыву.
Очень опасно растирание сухого перманганата калия с органическими веществами и порошками активных металлов и неметаллов (кальцием, алюминием, магнием, фосфором, серой и др.) — весьма вероятен взрыв.
Другие сферы применения
- Применяется для определения перманганатной окисляемости при оценке качества воды согласно ГОСТ 2761-84 по методу Кубеля.
- Щелочной раствор перманганата калия хорошо отмывает лабораторную посуду от жиров и других органических веществ.
- Растворы (концентрации примерно 3 г/л) широко применяются при тонировании фотографий.
- В пиротехнике применяют в качестве сильного окислителя.
- Применяют в качестве катализатора разложения перекиси водорода в космических жидкостно-ракетных двигателях.
- Водный раствор перманганата калия используется для травления дерева, в качестве морилки.
- Водный раствор применяется также для выведения татуировок. Результат достигается посредством химического ожога, при котором отмирают ткани, в которых содержится красящее вещество. Данный метод немногим отличается от простого срезания кожи, обычно он менее эффективен и более неприятен, так как ожоги заживают намного дольше. Татуировка не удаляется полностью, на её месте остаются шрамы.
- Перманганат калия или бихромат натрия используются в качестве окислителя при получении мета- и парафталевых кислот из мета- и параксилолов соответственно (см. Терефталевая кислота).
Получение
Химическое или электрохимическое окисление соединений марганца, диспропорционирование манганата калия. Например:
Последняя реакция происходит при электролизе концентрированного раствора манганата калия и эндотермична, она является основным промышленным способом получения перманганата калия.
Ограничение на покупку
Входит в IV список прекурсоров ПККН в России (допускается исключение некоторых мер контроля).
14 июня 2013 года на Украине был признан прекурсором и внесён в список наркотических веществ.
http://fb.ru/article/375419/razlojenie-permanganata-kaliya-svoystva-soley-margantsevoy-kislotyi
http://chem.ru/permanganat-kalija.html