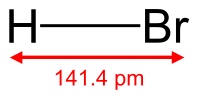
Бромоводород
| Бромоводород | |||
|---|---|---|---|
| |||
| Систематическое наименование | бромоводород | ||
| Традиционные названия | Бромистый водород | ||
| Хим. формула | HBr | ||
| Рац. формула | HBr | ||
| Состояние | бесцветный газ | ||
| Молярная масса | 80,91 г/моль | ||
| Плотность | газ (25 °C), 3,307 г/л, жидкий (−68 °C) 2,17 г/см³ | ||
| Энергия ионизации | 11,62 ± 0,01 эВ | ||
| Температура | |||
| • плавления | –86.80 °C | ||
| • кипения | –66.38 °C | ||
| Критическая точка | 90,0 °C, 8,54 МПа | ||
| Энтальпия | |||
| • образования | -34,1 кДж/моль | ||
| Давление пара | 20 ± 1 атм , 20,003 бар , 26,5 бар и 40,7 бар | ||
| Константа диссоциации кислоты pKa | ≈ –9 | ||
| Растворимость | |||
| • в воде | 193 (20 °C) | ||
| Дипольный момент | 0,24 Д | ||
| Рег. номер CAS | 10035-10-6 | ||
| PubChem | 260 | ||
| Рег. номер EINECS | 233-113-0 | ||
| SMILES | |||
| RTECS | MW3850000 | ||
| ChEBI | 47266 | ||
| Номер ООН | 1048 | ||
| ChemSpider | 255 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Бромоводород (HBr) — соединение брома с водородом. Бесцветный тяжёлый токсичный газ, образует туман в сыром воздухе.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
- 5 Транспортировка
- 6 Токсичность
Получение
В промышленности бромоводород получают непосредственным взаимодействием простых веществ:
Также бромистый водород получается как побочный продукт при синтезе бромпроизводных органических соединений
В лаборатории получают гидролизом трибромида или пентабромида фосфора:
Восстановление брома несколькими способами:
Вытеснение из бромидов щелочных металлов разбавленной кислотой:
Физические свойства
Бромистый водород — это бесцветный ядовитый газ с резким запахом, сильно дымящий на воздухе. Термически очень устойчив.
Хорошо растворим в воде: 221 г/100 г воды при 0 °C (193 при 25°, 130 при 100 °C). Водный раствор образует азеотропную смесь с 47,63 % HBr, которая кипит при 124,3 °C.
Растворяется в этаноле, образуя слабый электролит.
При охлаждении водных растворов HBr можно получить кристаллогидраты:
- HBr·H2O — устойчив при −15,5÷-3,3 °C
- HBr·2H2O — плавится при −11,2 °C
- HBr·4H2O — плавится при −55,8 °C
Чистый HBr образует кристаллы орторомбической сингонии, пространственная группа F mmm, параметры при −173 °C a = 0,5640 нм, b = 0,6063 нм, c = 0,5555 нм, Z = 4.
Химические свойства
Водный раствор бромистого водорода образует сильную одноосновную кислоту:
Термически HBr очень устойчив, при температуре 1000 °C разлагаются около 0,5 % молекул:
Как кислота реагирует с металлами, их оксидами, основаниями:
Является восстановителем, медленно окисляется на воздухе, из-за чего водные растворы со временем окрашиваются в бурый цвет:
Применение
Применяют для приготовления бромидов, синтеза различных органических бромпроизводных и для реактивного ионного травления.
Транспортировка
Безводный HBr транспортируют в баллонах ёмкостью 6,8 и 68 кг под давлением 24 атм.
Токсичность
Бромистый водород — едкое, весьма токсичное вещество, обладающее удушающим действием. Предельно допустимая концентрация = 10 мг/м³, поражающая токсодоза = 2,4 мг/л·мин.
Бромистый водород.
Бромистый водород (бромоводородная кислота) – HBr относится к классу кислот восстановительного типа. Она хорошо растворяется в воде (диссоциирует на ионы), связь носит более ионных характер, чем у HF или HCl, что говорит о большой силе кислоты.
Получение бромистого водорода.
Гидролиз галогенидов фосфора:
Свойства бромистого водорода.
Бромистый водород реагирует с металлами, взаимодействие с серебром и свинцом дает качественную реакцию на бромид:
Выпавший осадок после реакции имеет желтовато-белый цвет.
Химические свойства брома, уравнения реакций
Бром – это химически активный неметалл, относящийся к группе галогенов, которые являются энергичными окислителями. Он активно применяется в различных сферах, включая медицину, промышленность, производство оружия. Химические свойства брома многочисленны, и сейчас о них стоит вкратце рассказать.
Общая характеристика
Данное вещество при нормальных условиях представляет собой красно-бурую жидкость. Она едкая, тяжелая, имеет неприятный запах, который немного напоминает йодный. Жидкость ядовитая, но про токсичные свойства химического элемента брома будет рассказано чуть позже. Общие характеристики можно выделить в следующий перечень:
- Атомная масса составляет 79,901 … 79,907 г/моль.
- Электроотрицательность равна 2.96 по шкале Полинга.
- Электродный потенциал нулевой.
- Всего шесть степеней окислений – 0, -1, +1, +3, +5 и +7.
- Энергия ионизации составляет 1142,0 (11,84) кДж/моль.
- Плотность равна 3,102 (25 °C) г/см³ при нормальных условиях.
- Температура кипения и плавления составляет 58,6 °C и −7,25 °C соответственно.
- Удельная теплота испарения и плавления равна 29,56 и 10,57 кДж/моль.
- Показатели молярной теплоемкости и объема равны 75,69 Дж/(K•моль) и 23,5 см³/моль соответственно.
Интересно, что название этого элемента с древнегреческого переводится как «зловоние». И кто знает, как пахнут бромовые растворы, понимает, о чем речь. Запах у него действительно не из приятных.
Основные химические свойства
Данное вещество существует в виде 2-атомных молекул Br2. Если увеличить температуру до 800 °C, то станет заметна их диссоциация на атомы. Чем выше будут градусы, тем интенсивнее будет осуществляться данный процесс.
К основным химическим свойствам брома стоит отнести его способность растворяться в воде. Это, конечно, характерно для всех галогенов, но он лучше остальных взаимодействует с Н2О. Растворимость составляет 3,58 грамм на 100 миллилитров воды при температуре в 20 °C.
Получающийся в итоге этой реакции раствор именуют бромной водой. У нее есть целый ряд специфических особенностей.
Бромная вода
На свету она постепенно выделяет кислород. Это возникает из-за того, что бромноватистая кислота, входящая в состав данного раствора, начинает разлагаться. Жидкость, кстати, имеет характерный желто-оранжевый цвет.
Бромную воду используют для проведения реакции, которая в виде формулы выглядит так: Br2 + Н2О → HBr + HBrO. Как можно видеть, в результате образуются такие вещества, как бромоводородная и неустойчивая бромноватистая кислоты.
Раствор является очень мощным окислителем. Бромная вода способна воздействовать на такие металлы, как никель, кобальт, железо, марганец и хром. Еще ее применяют в химическом синтезе определенных препаратов органического происхождения и при анализах. Также бромная вода задействуется при идентификации алкенов. Когда она вступает с ними в реакцию, то обесцвечивается. Кстати, особенность бромной воды в том, что она не замерзает даже при -20 °С.
А готовят ее обычно так: в 250 миллилитров дистиллированной воды добавляют бром в количестве 1 мл, интенсивно при этом перемешивая компоненты. Процесс осуществляется в вытяжном шкафу. Хранят раствор в емкости, выполненной из стекла темного цвета.
Другие реакции брома
Важно оговориться, что этот активный неметалл во всех отношениях смешивается с большинством органических растворителей. Чаще всего вследствие данного процесса их молекулы бромируются.
По своей химической активности данный элемент находится между хлором и иодом. С этими веществами он тоже взаимодействует. Вот, например, реакция с раствором иодида, вследствие которой образуется свободный иод: Br2 + 2Kl → I2 + 2KBr. А при воздействии на бромиды хлора появляется свободный бром: Cl2 + 2KBr → Br2 + 2KCl.
Со многими другими веществами рассматриваемый элемент тоже взаимодействует за счет своих химических свойств. Реакция брома с серой дает S2Br2. При взаимодействии с фосфором появляются PBr3 и PBr5. Это все бинарные неорганические соединения. Кроме перечисленных элементов, неметалл также взаимодействует с селеном и теллуром.
Но вот с чем бром не реагирует непосредственно, так это с азотом и кислородом. Зато с галогенами взаимодействует. А его реакции с металлами дают бромиды — MgBr2, CuBr2, AlBr3 и т.д.
И, конечно, рассказывая про физические и химические свойства брома, нельзя не упомянуть, что существуют также вещества, являющиеся устойчивыми к его действию. Это платина и тантал, а еще в какой-то мере свинец, титан и серебро.
Двойные и тройные связи
С веществами, которым они свойственны, также способен взаимодействовать обсуждаемый элемент. И, рассказывая про химические свойства брома, уравнения реакций данного типа тоже стоит рассмотреть. Вот одно из таковых: С2Н4 + Br2 → C2H4BR2. Это взаимодействие с этиленом. Ему как раз и свойственна двойная связь.
Интересно, что когда бром смешивается с растворами щелочей, карбоната калия или натрия, то результатом становится образование соответствующих броматов и бромидов (солей). Вот уравнение, демонстрирующее это: 3Br2 + 3Na2CO3 → 5NaBr + NaBrO3 + 3СО2.
И да, перечисляя важнейшие химические свойства брома, нельзя не упомянуть, что в жидком состоянии он легко взаимодействует с золотом. Результатом становится образование трибромида (AuBr3). А реакция выглядит следующим образом: 2Au + 3Br2 → 2AuBr3.
Токсичность
Химические свойства брома обусловливают его опасность для человеческого организма. Даже если его концентрация в воздухе превышает отметку в 0,001 % по объему, то возникают головокружение, раздражение слизистых оболочек, кровотечение из носа, а иногда даже удушье и спазмы дыхательных путей.
Смертельная доза для человека составляет всего 14 мг/кг перорально. Если возникло отравление бромом, то нужно:
- Вызвать «Скорую».
- Вывести потерпевшего на свежий воздух.
- Расстегнуть сдавливающую одежду.
- Постараться успокоить его.
- Промыть кожу водой, если вещество попало на покровы. Протереть после этого спиртом.
- Дать пострадавшему молоко с добавлением небольшого количества соды. Она нейтрализует действие брома.
- Промыть желудок, если вещество попало в организм через рот. Давать пить воду, но маленькими порциями, рекомендуется предложить сорбенты для уменьшения степени всасываемости.
Бром действительно опасное вещество. Его даже используют в производстве боевых отравляющих припасов.
Работа с бромом
Поскольку химические свойства брома обусловливают его токсичность, то люди, которые вынуждены с ним контактировать, используют специальные перчатки, противогазы и спецодежду.
Хранят вещество в толстостенной таре из стекла. Ее, в свою очередь, хранят в емкостях с песком. Он помогает защитить тару от разрушения, которое может возникнуть из-за встряхивания.
Кстати, из-за очень высокой плотности вещества бутылки с ним нельзя брать за горло. Оно легко может оторваться. А последствия от разлитого токсичного брома, да еще в таком количестве, катастрофичны.
Применение
Напоследок пару слов о том, как и где используют бром. Можно выделить следующие сферы и области применения:
- Химия. Бром задействован в органическом синтезе, а его раствором определяют качество непредельных соединений.
- Промышленность. С добавлением брома делают антипирены, которые придают пожароустойчивость таким материалам, как текстиль, древесина и пластик. А еще из него раньше активно изготавливали 1.2-дибромэтан, который был главной составляющей этиловой жидкости.
- Фотография. Бромид серебра используется как светочувствительное вещество.
- Ракетное топливо. Пентафторид брома – его мощный окислитель.
- Нефтедобыча. В этой сфере используются бромидные растворы.
- Медицина. Бромиды калия и натрия используют в качестве успокаивающих средств.
Так что каким бы токсичным ни было это вещество для человеческого организма, в некоторых сферах оно незаменимо.
http://www.calc.ru/Bromistiy-Vodorod.html
http://www.syl.ru/article/371584/himicheskie-svoystva-broma-uravneniya-reaktsiy