Осадок, полученный при взаимодействии растворов хлорида железа (III) и нитрата серебра, отфильтровали. Фильтрат обработали раствором едкого кали
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,296
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,211
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Комментарии к решениям заданий ЕГЭ по химии
Задание №1
Осадок, полученный при взаимодействии растворов хлорида железа (III) и нитрата серебра, отфильтровали. Фильтрат обработали раствором едкого кали. Выпавший осадок бурого цвета отделили и прокалили. Полученное вещество при нагревании реагирует с алюминием с выделением тепла и света. Составьте уравнения четырех описанных реакций.
Решение:
при взаимодействии как солей соляной кислоты, так и самой кислоты с нитратом серебра образуется АgCl – нерастворимое в воде и кислотах творожистое вещество белого цвета (уравнение 1); эта реакция является качественной на хлорид-ион.
Фильтрат-раствор, прошедший через фильтр, который задерживает нерастворимые вещества. Взаимодействие растворимых солей с растворами щелочей-способ получения нерастворимых оснований (уравнение 2)
Fe(OH)3 – нерастворимое вещество бурого цвета, амфотерный гидроксид, разлагается при нагревании на оксид металла и воду (уравнение 3).
3) Fe(OH)3 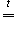
Восстановление металлов из их оксидов с помощью алюминияпромышленный способ получения многих металлов (алюмотермия); реакция экзотермическая, сопровождается выделением тепла, света и плавлением реакционной массы (уравнение 4)
Задание №2
Продукты разложения хлорида аммония последовательно пропустили через нагретую трубку, содержащую оксид меди(II), а затем через склянку с оксидом фосфора(V). Составьте уравнения четырёх описанных реакций.
Решение:
Соли аммония и кислот, для которых нехарактерны окислительные свойства (NH4Cl, (NH4)2CO3), при нагревании разлагаются на аммиак NH3 и кислоту (уравнение 1)
1) NH4Cl 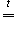
Оксид меди (II) – основный оксид, кислоты реагируют с основными оксидами с образованием солей (уравнение2)
Аммиак, в котором азот находится в низшей степени окисления N –3 , проявляет восстановительные свойства и восстанавливает среднеактивные и малоактивные металлы из их оксидов (уравнение 3)
При взаимодействии P2O5 с водой, в зависимости от соотношения реагентов и температуры, могут образовываться фосфорные кислоты (H4P2O7, HPO3, H3PO4) (уравнение 4); азот с P2O5 не реагирует
Задание №3
Газ, выделившийся при взаимодействии хлороводородной кислоты с перманганатом калия, реагирует с железом. Продукт реакции растворили в воде и добавили к нему сульфид натрия. Более легкое из образовавшихся нерастворимых веществ отделили и ввели в реакцию с горячей концентрированной азотной кислотой.
Составьте уравнения четырёх описанных реакций.
Решение:
Взаимодействие соляной кислоты с перманганатом калия является способом получения хлора (уравнение 1)
Железо взаимодействует с сильными окислителями с образованием соединений железа в степени окисления +3 (уравнение 2)
Железо в степени окисления +3 проявляет свойства окислителя, поэтому может взаимодействовать с восстановителем (сульфид натрия восстановитель, так как содержит серу в степени окисления S –2 ), образуя соединения двухвалентного железа (уравнение 3)
Горячая азотная кислота окисляет серу до высшей степени окисления +6 (до H2SO4), азот при этом восстанавливается до N +4 (до NO2) (уравнение 4)
Задание №4
При сжигании на воздухе простого вещества жёлтого цвета образуется газ с резким запахом. Этот газ выделяется также при обжиге некоторого минерала, содержащего железо, на воздухе. При действии разбавленной серной кислоты на вещество, состоящее из этих же элементов, что и минерал, но в другом соотношении, выделяется газ с запахом тухлых яиц. При взаимодействии выделившихся газов друг с другом образуется исходное простое вещество. Составьте уравнения четырёх описанных реакций.
Решение.
Простое вещество желтого цвета, горящее на воздухе с выделением газа с резким запахом, – сера (уравнение 1)
Вещества, содержащие железо и серу: минерал пирит FeS2 и сульфид железа (II) (уравнения 2 и 3)
При взаимодействии оксида серы (IV) и сероводорода первый проявляет свойства окислителя, второй-восстановителя) и образуется простое вещество-сера (уравнение4)
Задание №5
После кратковременного нагревания неизвестного порошкообразного вещества оранжевого цвета начинается самопроизвольная реакция, которая сопровождается изменением цвета на зелёный, выделением газа и искр. Твердый остаток смешали с едким калии нагрели, полученное вещество внесли в разбавленный раствор соляной кислоты, при этом образовался осадок зелёного цвета, который растворяется в избытке кислоты. Составьте уравнения четырёх описанных реакций.
Решение:
Вещество оранжевого цвета, которое разлагается с изменением цвета на зелёный, – бихромат аммония (NH4)2Cr2O7 (уравнение 1)
Cr2O3 – вещество зелёного цвета, – амфотерный оксид и будет реагировать с безводной щелочью с образованием соли (уравнение 2)
В воде, в присутствии небольшого количества кислоты, KCrO2 будет гидролизоваться с образованием нерастворимого амфотерного гидроксида хрома(III) (уравнеие 3)
Амфотерный гидроксид хрома (III) растворяется в избытке кислоты с образованием Cr +3 , имеющий зелёный цвет (уравнение 4).
http://rosuchebnik.ru/material/kommentarii-k-resheniyam-zadaniy-ege-po-khimii/