Нейронное напряжение
Как дифференциальные уравнения помогают понять работу клеток головного мозга
Чтобы понять, как работает человеческий мозг, недостаточно усилий одних только биологов. Нейроны работают с помощью, в том числе, электрических сигналов, а значит, можно построить электрическую схему отдельно взятого нейрона и описать ее математически. И здесь нам снова понадобятся дифференциальные уравнения — системы уравнений Фитцхью-Нагумо. О том, как именно математики исследуют нервную систему и мозг, читайте в нашем четвертом материале о самых интересных дифференциальных уравнениях (предыдущие можно прочитать здесь, здесь и здесь).
Термин «вычислительная нейробиология» (computational neuroscience) появился совсем недавно — в 1985 году его предложил профессор Бостонского университета Эрик Шварц (Eric Schwartz), и это как раз та ситуация, когда наука появилась намного раньше — в середине XX века, — чем ее название.
К тому моменту ученым уже давно было известно, что мозг и нервная система построены из электрически возбудимых клеток — нейронов, предназначенных для приема извне, обработки, хранения, передачи и вывода вовне информации с помощью электрических и химических сигналов. Нейроны могут соединяться один с другим, формируя сети; в головном мозге человека насчитывается около 90–95 миллиардов нейронов.
Описать работу нейронов проще всего через математические системы с заданными параметрами. Этим и занимаются ученые, работающие в области вычислительной нейробиологии, с помощью моделей, предложенных математиками почти семьдесят лет назад.
Модель Ходжкина-Хаксли
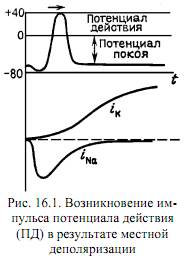
В 1952 году Алан Ллойд Ходжкин (Alan Hodgkin) и Эндрю Хаксли (Andrew Huxley) создали математическую модель для описания электрических механизмов, обуславливающих генерацию и передачу нервного сигнала в гигантском аксоне кальмара. Физиологической основой нервного импульса выступают потенциалы действия (их также называют спайками). Они генерируются благодаря разнице в концентрации ионов внутри и вне клетки.
На мембране клетки находятся ионные каналы — белковые молекулы, образующие в мембране поры, через них ионы могут проходить с внутренней стороны мембраны на наружную и наоборот. Мембрана клетки деполяризуется, реполяризуется, возвращается к исходному уровню поляризации и так далее. Нейрон реагирует на сигналы.
Вот электрическая схема, соответствующая этой модели:
В этой схеме каждый компонент возбуждаемой клетки имеет свой биофизический аналог. Внутреннему липидному слою клеточной мембраны соответствует электроемкость (Cm). Потенциал-зависимые ионные каналы отвечают за нелинейную электрическую проводимость (Gn, где n — отдельный вид ионных каналов).
Эта составляющая системы реализуется благодаря белковым молекулам, образующим потенциал-зависимые ионные каналы, каждый из которых отмечен некоторой вероятностью открытия, чья величина зависит от электрического потенциала, то есть напряжения мембраны клетки. Каналы мембранных пор отвечают за пассивную проводимость (GL, где L означает leak — «течь, утечка»).
Электрохимический градиент побуждает ионы к движению через мембранные каналы, он показан с помощью источников напряжения с соответствующей электродвижущей силой (En/EL), величина которой определяется реверсивным потенциалом для соответствующего вида иона. Ионные транспортеры соответствуют источникам тока (Ip).
Через некоторое время после публикации работы Ходжкина и Хаксли ученый из биофизической лаборатории в Мэриленда Ричард Фитцхью (Richard FitzHugh) занялся анализом математических свойств их модели.
В то время электронные компьютеры не были в свободном доступе, поэтому ему пришлось пользоваться аналоговым. Для решения уравнений использовалась огромное количество оборудования.
Ричард Фитцхью в своей лаборатории
В итоге в 1961 году ученый создал упрощенную двухмерную версию модели Ходжкина-Хаксли (оригинальная модель более точно описывала генерацию потенциалов действия, но ее фазовые кривые были в четырехмерном пространстве, что заставляло постоянно использовать проекции).
Решения модели Фитцхью гораздо проще рассматривать, а также с их помощью проще находить геометрические объяснения важных биологических феноменов. В следующем году подобная система была предложена Дзин-ити Нагумо (Jin-Ichi Nagumo) с соавторами.
Биологический и математический смысл
Рассмотрим запись системы и входные данные:
где v — потенциал мембраны, w — переменная восстановления, Iext — величина стимулирующего тока (эта переменная изображает экспериментальное подключение тока к мембране).
Мы пытаемся смоделировать генерацию спайка в гигантском аксоне кальмара. Из экспериментов мы знаем, что следующие утверждения верны:
1) изначально нейрон находится в невозбужденном состоянии;
2) если мы экспериментально изменим потенциал на небольшую величину, нейрон вернется в невозбужденное состояние;
3) если возбуждение будет сильнее, чем некая граничная величина, потенциал увеличится до очень большого значения, то есть сгенерируется спайк;
4) после спайка нейрон возвратится в состояние покоя.
В нашей модели состояние покоя нейрона равно положениям равновесия для переменной v. Так как система должна возбуждаться и возвращаться в невозбужденное состояние, нам необходима вторая переменная восстановления w, которая движется медленнее (для этого есть параметр τ, отвечающий за «масштаб времени») и возвращает систему в состояние покоя (для этого минус w).
Добавление константы a ко второму уравнению позволило Фитцхью сдвигать положение покоя по кубической кривой. С помощью нее можно влиять на устойчивость состояния покоя. Во втором уравнении также присутствует константа b, из-за которой положение равновесия при I = 0 лежит на правой возрастающей ветке и является устойчивым.
Электрофизиологические исследования также показывают, что действие умеренного тока на мембрану приводит к периодическим спайкам. Если внешний ток слишком велик, спайки блокируются. Чтобы смоделировать подобное поведение, необходимо уравнение третьей степени для потенциала мембраны.
Построим график, показывающий, как траектории v и w меняются в зависимости от значений значениях I, растущих от 0 до 1,5. Синяя линия отвечает за переменную w, красная — за переменную v.
При этом используются следующие параметры: a = −0,7; b = 0,8; τ = 12,5. При таких параметрах и I = 1 траектории наиболее напоминают пульсацию.
Модель Ходжкина — Хаксли
Модель Ходжкина — Хаксли — математическая модель, которая описывает генерацию и распространение потенциалов действия в нейронах и других электрически возбуждаемых клетках — таких, например, как сердечные миоциты. Модель представляет собой комплекс ординарных дифференциальных уравнений, которая описывает характеристики электрического сигнала.
Модель была разработана Аланом Ллойдом Ходжкина и Эндрю Хаксли в 1952 году для описания электрических устройств, обусловливающие генерацию и передачу нервного сигнала в гигантском аксоне кальмара. За это авторы модели получили Нобелевскую премию в области физиологии и медицины за 1963 год.
Основные компоненты
Компоненты электрической схемы, соответствующей модели Ходжкина — Хаксли, изображенные на картинке. В данной схеме каждый компонент возбуждаемой клетки имеет свой биофизический аналог. Подвийнному липидном слоя клеточной мембраны отвечает электроемкость (С m). Потенциал-зависимые ионные каналы отвечают нелинейной электрической проводимости (g n, где n — отдельный вид ионных каналов) это означает, что проводимость является потенциал- и время-зависимой величиной. Эта составляющая системы, как было показано исследователями позже, реализуется благодаря белковым молекулам, которые образуют потенциал-зависимые ионные каналы, каждому из которых присуща некоторая вероятность открытия, величина которой зависит от электрического потенциала (или электрического напряжения) клеток мембраны. Каналы мембранных пор отвечают пассивной проводимости (g L, где индекс L означает английское слово «Leak»). Электрохимический градиент, побуждает ионы к движению сквозь мембранные каналы, показан за помощью аккумуляторов с соответствующим электродвижущей силой (E n и E L), величина которой определяется уравнением Нернста для соответствующего вида иона. Ионные транспортеры соответствуют источникам тока (I p).
Производная по времени от мембранного потенциала клеточной мембраны () при описанных условиях пропорциональна сумме токов в полном электрической цепи. Она описывается следующим уравнением:
где I и означает величину электрического тока, генерируемого отдельным видом ионов.
Характеристики ионного тока
Электрический ток, проходящий через ионные каналы, может быть математически выражен следующим уравнением:
где Е и — равновесный потенциал i-го ионного канала. В случае потенциал-зависимых ионных каналов канальная проводимость g и является функцией времени и потенциала (электрического напряжения) — g n (t, V) на рисунке, в то время как пассивная проводимость является величиной постоянной (g L на рисунке). Ток, генерируемый ионными транспортерами, зависит от вида ионов, его переносит соответствующий транспортер. Ниже приведены подробное описание перечисленных величин:
Потенциал-зависимые ионные каналы
В терминах модели Ходжкина — Хаксли проводимость потенциал-зависимых каналов (gn (t, V)) описывается следующим образом:


Где являются константами скорости реакций закрытия и открытия каналов, соответственно. Они численно равны доле от максимальной возможной проводимости через данный вид каналов, имеется в каждый момент времени при каждой величине мембранного потенциала. является максимальным возможным значением проводимости. и — константы, φ и χ — временные константы процессов активации и деактивации каналов, соответственно. и является стабилизированными значениями и при величине времени, стремится к бесконечности, и конечно рассчитываются из уравнения Больцмана как функция V m.
Для характеристики ионных каналов, последние два уравнения модифицируются для условий, когда на мембране поддерживается постоянная величина электрического потенциала — модификация уравнений Ходжкина — Хаксли, которая была предложена Марквардт. Когда мембранный электрический потенциал поддерживается на постоянном уровне (voltage-clamp), для каждого значения этого потенциала нелинейные уравнения, описывающие пропуск ионов через каналы, редуцируются к линейных дифференциальных уравнений относительно:

Таким образом, для каждого значения мембранного потенциала V m, величина электрического тока описывается следующим уравнением:
Для аппроксимации кривых, которые генерируют данные уравнения, до значений клеточных токов при фиксированном значении мембранного потенциала використовуетться алгоритм Левенберґа — Марквардта, что является модифицированным алгоритмом Гаусса — Ньютона.
Пассивные каналы
Пассивные каналы отвечают за проницаемость мембраны для ионов в спокойном состоянии (не во время проведения потенциала действия), и ток через них описывается теми же уравнениями, что и для потенциал-зависимых каналов, но при условии постоянной величины проводимости g i (g i = const ).
Ионные транспортеры
Мембранный электрический потенциал генерируется за помощью поддержания концентрационных градиентов ионов, присутствующих в физиологических жидкостях оранизму, относительно клеточной мембраны. Важнейшими из белков-транспортеров, поддерживающих мембранный потенциал, есть натриево-кальциевый (транспортирует один ион Са 2+ внутрь клетки в обмен на 3 ионы Na +, транспортируемых наружу), натриево-калиевый (транспоруе один ион Na + наружу в обмен на один ион К + внутрь) и хлорный (транспортирует из клетки наружу ионы Cl -).
Модификации и альтернативные модели
Модель Ходжкина — Хаксли является одним из самых выдающихся достижений в биофизике и нейрофизиологии 20-го века. Со временем она была модифицирована в следующих направлениях:
- Основываясь на экспериментальных данных, в нее были инкорпорированы дополнительные виды ионных каналов и транспортеров.
- Основываясь на данных микроскопии высокого разрешения, в уравнение добавлены элементы, характеризующие сложную морфологию отростков нервных клеток (аксонов и дендритов).
Также на общих принципах модели Ходжкина — Хаксли были разработаны несколько моделей, описывающих взаимную активацию и деактивацию в нейронных сетях, а также молекулярную динамику генерации потенциала действия.
Ионные токи в модели Ходжкина-Хаксли. Воротные токи. Флуктуации напряжения и проводимости в модельных и биологических мембранах
Модель Х-Х – это математическая модель, описывающая электрофизиологические мембранные процессы возбудимых клеток. В частности, — гигантского аксона кальмара, с которым работали ученые. Математический аппарат модели строится на нескольких уравнениях. (более подробно – см. 12.1. тут все же вопрос про токи и проводимость)
1. Уравнение Нернста, описывающее равновесный потенциал в системе с полупроницаемой мембраной по каждому иону. φi=RT/(zF)* ln(Cin/Cout) (тут и далее под φ надо понимать разность потенциалов снаружи минус внутри. Дело в том, что правильнее говорить равновесная разность потенциалов, но поскольку привыкли говорить просто равновесный потенциал, то и вместо Δφ пишут φ, хотя по факу это неправильно). Оно выводится из условия равновесия, согласно которому электрохимические потенциалы в обеих частях системы, разделенной на эти части полупроницаемой мембраной, равны (µin= µ 0 +RTlnCin+zFφin и µout= µ 0 +RTlnCout+zFφout, µin= µout, писать с чертой!).
2. Уравнение Гольдмана-Ходжкина-Хаксли.Описывает потенциал на мембране и показывает, что он зависит от проницаемости мембраны по разным ионам (как оно выводится никогда не пишут в описании модели, вообще оно выводится с помощью электродиффузии, кому охота понтонуться – см. 3.1.) φ=RT/F*ln((PK[Kout]+ PNa[Naout]+ PCl[Clin])/( PK[Kin]+ PNa[Nain]+ PCl[Clout])).
3. 
Полярные группы, определяющие диполыюе окружение иона в канале, влияют на энергию иона и на прохождение его через канал, Если иод влиянием деполяризующего электрического импульса изменяется их ориентация, то это вызовет смещение заряженных групп и изменение проводимости канала. Процесс переориентации диполей может носить кооперативный характер и быть достаточно резким. В этом случае энергия, необходимая для переориентации каждого элементарного диполя, должна зависеть не только от его собственной энергии, но и от доли диполей, уже изменивших свою ориентацию. Иными словами, по мере изменения ориентации части диполей энергия, необходимая для переориентации оставшихся диполей, уменьшается тем значительнее, чем больше число уже переориентированных диполей. Можно представить себе, что в исходном состоянии диполи мешают друг другу изменить ориентацию под действием поля, а переориентированные диполи уже «не путаются иод ногами» у оставшихся. В результате такого рода кооперативного эффекта проводимость канала очень быстро «лавинообразно» нарастает под действием приложенного электрического импульса. Заметим, что и конформацнонные перестройки в канале, сопровождающиеся поворотом диполей, могут также приводить к скачкообразным изменениям проводимости в одиночном канале. Фактически во всех предложенных моделях речь идет о своего рода фазовых переходах в мембранах, лежащих в основе скачкообразных переходов канала между двумя состояниями.
Короче, суть в том, что на самом деле, в основе модели лежат как раз дико сложные диффуры, которых не было у нас в задачах, и которых нет в лекциях, но которые есть в описаниях модели на стороне. И там как раз страшные диффуры про все эти изменения проводимостей и токов, но они реально страшные. Так что, извините, но не вижу смысла них разбираться, то есть тратить ден на то, чего все равно даже самый заядлый извращенец не спросит.
Тем не менее, опишу, какие токи учитываются в модели, кроме обычных калиевых и натриевых. Не знаю, насколько мы это должны знать. Нам про эти токи очень много рассказывали на нейрофизиологии, но на биофизике – едва ли. Кто хочет понтонуться.
Калиевые токи.
1.1.А-ток. У нейронов беспозвоночных деполяризация мембраны активирует новый тип К-канала, который, в отличие от К-канала в аксоне инактивируется со временем при продолжающейся деполяризации мембраны. Включение такого быстро инактивирующегося К-тока в модель генерации ПД позволяет модифицировать скорость (или частоту ритмического возбуждения) генерации ПД. Такой К -ток называют А-ток. Он быстро инактивируется и не активируется до тех пор, пока не произойдет кратковременная гиперполяризация мембраны. Активируется А-ток во время спада «обычного» калиевого тока, когда потенциал мембраны составляет
-75 мВ. А-ток предотвращает деполяризацию и т.о. снижает частоту импульсного разряда. Приложение электрического тока к нервным клеткам симпатических ганглиев лягушки-быка приводит к генерации сложного вида ПД из-за активации большого количества разных каналов. Присутствует по крайней мере 4 различных К+-тока: помимо А-тока могут быть выделены также два тока, которые активируются при поступлении в клетку Са++ во время ПД (IC и IAPH) и один, который активируется при деполяризации (IM) мембраны.
1.2.С-ток. Реполяризация аксолеммы в процессе ПД обеспечивается как инактивацией Nа-тока, так и активацией К-тока. Однако, для многих типов нервных клеток было показано, что удаление внеклеточного Са++ или блокирование Са++-каналов двухвалентными катионами(например Cd++, для которых мембрана непроницаема), приводит к удлинению фазы реполяризации и снижению уровня гиперполяризации мембраны после прохождения ПД. Эти результаты указывают на то, что Са2+ может транспортироваться в клетку в течение ПД и в связи с этим происходит активация К+-тока (IC), обеспечивающая реполяризацию мембраны.
1.3.АНР-ток. Для ряда нейронов выявлен другой тип Са2+-активируемого К+-тока. Например, внутриклеточная деполяризация пирамидальных нейронов неокортекса человека импульсом тока приводит к генерации серии ПД, сопровождающейся следовой гиперполяризацией клеточной мембраны. Такая следовая гиперполяризация — главным образом результат активации медленного К+-тока, IAHP (after hyperpolarisation), который генерируется за счет входа Са2+ при проведении серии ПД. При генерации ПД Са2+ поступает в клетку через Са2+-каналы, активирующиеся при высоких напряжениях стимулирующего клетку импульса. Увеличение количества внутриклеточного Са2+ активирует IAHP, который затем гиперполяризует мембрану клетки и приводит к уменьшению частоты генерации ПД (процесс известен как «частотная адаптация». Активация различных рецепторов, включая ацетилхолиновые (мускариновые) рецепторы, локализованных на мембране пирамидальных клеток коры, уменьшает IAHP и, соответственно, повышает частоту генерации ПД. Данное увеличение возбудимости пирамидальных клеток коры является важным фактором, обеспечивающим поддержание активности коры мозга во время бодрствования; и, наоборот, клетки коры становятся менее возбудимыми в состоянии сна без сновидений.
1.4.М-ток. Генерация разнообразных пачек ПД в нейроне осуществляется за счет взаимодействия различных ионных токов, которые могут меняться при действии нейромедиаторов. Одним из примеров такого типа нейромодуляции был обнаружен в клетках симпатических ганглиев лягушки-быка Д. Брауном и П. Адамсом. Эти исследователи выявили механизмы, с помощью которых высвобождение медиатора из окончаний предганглионарных нейронов спинного мозга (ацетилхолин) модулирует возбудимость ганглионарных клеток за счет активации мускариновых рецепторов. Амплитуда медленного возбуждения (деполяризации) обусловлена активацией мускариновых рецепторов при высвобождении ацетилхолина и зависит от МП клетки. Браун и Адамс продемонстрировали, что потенциалозависимость медленного холинэргического возбуждения обусловлена инактивацией ацетилхолином потенциалозависимого К+-тока (М-ток), который блокирует мускариновые рецепторы. Таким образом, М-ток — это К+-ток, активирующийся при деполяризации клетки за время порядка десятка миллисекунд. Например, если мы с помощью метода фиксации потенциала изменим МП клетки с -65 мВ на -45 мВ, то М-ток постепенно включится. Стимуляция предганглионарного нерва при действии ацетилхолина приводит к значительному подавлению этого медленно активирующегося К+-тока. Активация М-тока при деполяризации мембраны приводит к снижению клеточной возбудимости настолько, что прикладываемый к нерву деполяризующий импульс тока способен генерировать не пачку, а лишь один ПД. Однако, при блокировании М-тока в момент выхода из нейрона ацетилхолина, аналогичный по величине деполяризующий импульс приводит к генерации пачки ПД.
Кальциевые токи.
При исследовании состояния нейронов мозга спящих животных было обнаружено, что многие клетки (даже во время фазы медленного сна) не находятся в состоянии покоя, а генерируют серии ПД, а не отдельные ПД (типично для бодрствующих животных). Действительно, внутриклеточная регистрация МП во время фазы медленного сна для таламических клеток, которые осуществляют передачу сигналов от сетчатки к зрительной коре, выявила наличие медленных ПД, обеспечивающих серии импульсов в спящем мозге. Переход к бодрствованию или быстрому сну был связан с деполяризацией мембраны и более регулярной генерацией ПД в отличие от спайков или серии ПД. Дальнейшие исследования доказали наличие изменений ионных токов нейронов при переходе животного от состояния сна к бодрствованию. С помощью микроэлектродных исследований, выполненных на таламических клетках, были выявлены два основных способа генерации ПД. В случае, когда мембрана гиперполяризована, внутриклеточное введение в клетку деполяризующего импульса тока (до значений
| | | следующая лекция ==> | |
| Многие молекулы биологических веществ являются природными или естественными флуорофорами | | | Технологиялық сүлбесі |
Дата добавления: 2016-04-11 ; просмотров: 2287 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://info-farm.ru/alphabet_index/m/model-khodzhkina-khaksli.html
http://helpiks.org/7-75166.html









