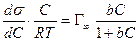Лекция 13. Адсорбция
13.1. Уравнение адсорбции Гиббса
Строгое определение понятия адсорбции по Дж. Гиббсу: адсорбцией данного компонента на границе раздела двух фаз называется разность между фактическим количеством этого компонента в системе и тем его количеством, которое было бы в системе, если бы концентрации в обеих сосуществующих фазах были постоянны вплоть до некоторой геометрической поверхности, разделяющей их.
Эта разность может быть положительной или отрицательной. Она обозначается символом G (гамма) и имеет размерность моль/м 2 . Эту величину называют избыточной адсорбцией по Дж. Гиббсу.
Хотя в приведенном определении адсорбция отнесена к геометрической поверхности, не имеющей толщины (что удобно при выводе уравнений), фактически граница между фазами представляет собой очень тонкий слой (поверхностный слой), в котором все свойства отличаются от свойств объемных фаз и изменяются не скачкообразно, а непрерывно.
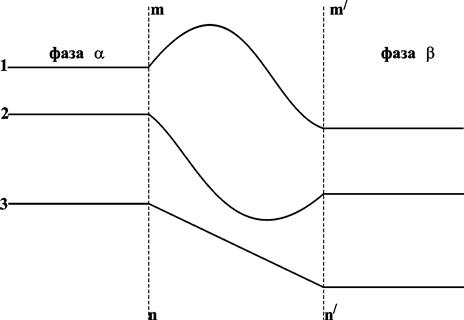
На рис. 13.1 показано возможное изменение концентрации вблизи границы раздела: концентрация компонента может быть как выше концентраций в обеих фазах (1), так и ниже (2) или иметь промежуточное значение. Эта область может рассматриваться как поверхностный слой. Таким образом, изучая границу раздела фаз, нужно рассматривать состояние трех фаз: двух объемных и одной поверхностной.
Рис. 13.1. Изменение концентрации компонентов у границы раздела фаз;
поверхностный слой – mn-m’n’
Уравнение, устанавливающее связь между всеми параметрами процесса адсорбции – величиной поверхностного натяжения s, концентрацией компонента [C] в одной из фаз, его адсорбцией Г, было выведено Дж. Гиббсом в 1876 г. Это уравнение является общим термодинамическим уравнением, справедливым для любых составов и природы поверхности раздела фаз.
Рассмотрим систему, состоящую из двух компонентов 1 и 2 и двух фаз a и b, разделенных поверхностью раздела с площадью S. Общее число молей каждого компонента в системе равно n1 o и n2 o . Если считать, что поверхностный слой не имеет толщины, т.е. представляет собой геометрическую поверхность, то обе объемные фазы будут иметь постоянный состав вплоть до этой геометрической поверхности. Обозначим число молей каждого компонента в каждой из этих фаз соответственно через n1 a ,n1 b ; n2 a ,n2 b . Так как на поверхности имеет место адсорбция, то, очевидно, n1 o ¹ n1 a + n1 b и n2 o ¹ n2 a + n2 b .
По вышеприведенному определению адсорбция каждого компонента Г1 и Г2 , отнесенная к единице площади поверхности, равна
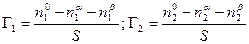
Чтобы найти Г1 и Г2, напишем уравнение энергии Гиббса для двух фаз a и b в отдельности и для всей системы в целом. В последнем случае, очевидно, нужно включить в уравнение член sdS:
dG o = — S o dT + V o dP + sdS + m1dn1 o + m2dn2 o . (13.2)
Укажем на уравнение Гиббса-Дюгема, которое устанавливает связь между химическими потенциалами:
dG = — S dT + VdP + Smidn1 (P, T – постоянные). (13.3)
Тогда для бинарной системы получим
Интегрируя это уравнение при постоянных значениях m1 и m2, получим
Из (13.4) и (13.6) вытекает, что
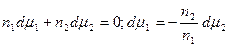
Это уравнение носит название уравнения Гиббса-Дюгема и связывает изменение химических потенциалов компонентов. Тогда с учетом уравнения Гиббса-Дюгема и поверхностных явлений получаем:
Сложение двух первых уравнений и вычитание полученной суммы из третьего дает
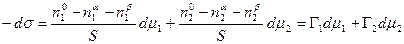
В качестве примера рассмотрим две конкретные системы: двухкомпонентный жидкий раствор, находящийся в равновесии со своим двухкомпонентным насыщенным паром, и твердое тело, находящееся в равновесии с однокомпонентным газом, совершенно не растворимым в этом твердом теле.
Поскольку в первом случае точное положение разделяющей геометрической поверхности несколько условно, то можно выбрать положение ее, при котором
Во втором случае вследствие нерастворимости газа в объеме твердого тела, объемные свойства этого тела, в частности его химический потенциал, не изменяются при адсорбции. Приписывая твердому телу индекс 1, имеем:
В обоих случаях получено одно и то же уравнение. Поэтому можно считать, что адсорбционное уравнение Гиббса имеет вид:
Оно является основным в учении о поверхностных явлениях.
Рассмотрим далее реальный раствор. Для реального раствора
где а – активность, тогда:
Подставив это значение в уравнение (13.12), получим:
ds = — Г Rt d lna,
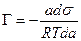
В разбавленных растворах а » С (где С – концентрация)
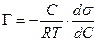
а для идеального или разреженного идеального газа
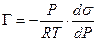
Уравнение (13.14) показывает, что если при адсорбции поверхностное натяжение s уменьшается с ростом концентрации С, т.е. ds/dC 0 и Г – отрицательно. Это соответствует поверхностно-инактивным веществам. Если известна зависимость s от С (т.е. изотерма поверхностного натяжения s = f(C) , то по уравнению Гиббса можно для каждого значения концентрации найти ds/dC и по уравнению Гиббса вычислить значение Г, т.е. построить изотерму адсорбции.
13.2. Обзор сорбционных явлений
Адсорбция на границе раздела твердое тело/газ. В общем случае явления, связанные с перераспределением веществ между различными частями гетерогенной системы, называются сорбцией. Сорбция (от лат. sorbeo – сгущать) – это изменение концентрации (часто увеличение) либо у поверхности раздела фаз (адсорбция), либо в объеме одной из фаз (абсорбция). Например, образование раствора за счет поглощения НСl (газа) и поглощение газа металлом (абсорбция). Поверхностная сорбция – адсорбция.
Твердое тело, у поверхности которого происходит адсорбция, называется адсорбентом, адсорбирующийся газ или адсорбирующийся компонент жидкого раствора – адсорбтивом, а адсорбированое вещество – адсорбат.
В строгом определении адсорбции она рассматривается как избыток вещества вблизи поверхности по сравнению с равным объемом вдали от нее. В ряде случаев удобнее рассматривать не избыток, а все количество адсорбата вблизи поверхности. Это количество обозначают символом а и называют полным содержанием, или просто адсорбцией (без указания гиббсова). Так как для пористых твердых тел бывает затруднительно знать величину поверхности, то часто адсорбцию относят не к единице поверхности, а к единице массы (моль/кг или моль/г).
Адсорбция самопроизвольна и протекает при Р = const со снижением энергии Гиббса, а при V = const – со снижением энергии Гельмгольца. Однако при этом происходит не выравнивание концентраций по всему объему системы, а увеличение разности концентраций между газовой фазой (раствором) и поверхностью. Одновременно уменьшается подвижность сорбирующихся молекул. Оба фактора ведут к уменьшению энтропии (DS o , так как DG o = DH o + TDS o ,
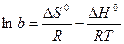
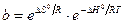
Таким образом, адсорбционный коэффициент b связан со стантартной энтропией DS° и со стандартной теплотой адсорбции q = –DH°.
Очень часто аm называют «емкость монослоя». На рис.13.3 показана кривая, выражающая изотерму адсорбции по Ленгмюру
Рис. 13.3. Изотерма адсорбции по Ленгмюру
При очень малых заполнениях и, следовательно, очень малых давлениях Р в знаменателе, согласно (13.25), bр > 1 и а = аm, т.е. величина адсорбции перестает зависеть от давления, поскольку все центры уже заняты.
Для расчета параметров am и b уравнение Ленгмюра представляют в виде
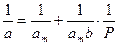
Тангенс угла наклона этой линии равен 1/amb, а отрезок, отсекаемый на оси ординат, равен 1/am.
Уравнение Ленгмюра, полученное на основании модели локализованной адсорбции газов на поверхности твердого тела, часто хорошо описывает адсорбцию растворенных веществ на поверхности жидкости (поверхность раздела раствор/газ), при которой адсорбция не локализована, так как молекулы подвижны и образуют двумерную газо- или жидкообразную пленку.
Обусловлено это тем, что основные положения модели Ленгмюра соблюдаются при адсорбции из растворов: поверхность жидкости идеально однородна, взаимодействие адсорбированных молекул в адсорбционном слое мало отличается от их взаимодействия в растворе. Оно к тому же ослаблено за счет взаимодействия молекул растворенного вещества с молекулами растворителя и практически не влияет на адсорбцию.
Уравнение Ленгмюра связано с уравнением состояния адсорбционной пленки – уравнением Гиббса. Так,
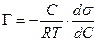
а по уравнению Ленгмюра
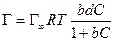
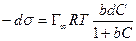
После интегрирования в пределах от sо до s и от 0 до С получим:
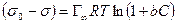
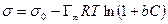
где Г¥ связано с площадью, занимаемой 1 моль адсорбированного вещества в мономолекулярном слое, следующим соотношением: 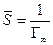
Дата добавления: 2016-02-09 ; просмотров: 2823 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
5.3. Энергия Гиббса и механизм адсорбции из растворов на твердой поверхности
5.3.1. Молекулярная адсорбция
В этом разделе рассмотрим закономерности определения энергии Гиббса адсорбции неионогенных веществ из водных растворов и адсорбции из неводных растворов. Растворы ПАВ с начальной концентрацией выше ККМ содержат мицеллы. В этой связи механизм адсорбции, молекулярный или мицеллярный, можно выявить по соотношению энергий Гиббса процессов мицеллообразования и адсорбции. Энергия Гиббса процесса адсорбции рассчитывается по уравнению
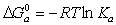
где Kа– постоянная адсорбционного равновесия, учитывающая обменный характер адсорбции из растворов. Эта постоянная определяется по начальному участку изотермы адсорбции при формировании ненасыщенного адсорбционного слоя.
Адсорбционный молекулярный слой, формируемый при адсорбции из растворов, можно рассматривать как двумерную фазу, в которой отношение компонентов определяется различиями в энергии взаимодействия их молекул с активными центрами поверхности адсорбента, а суммарное относительное заполнение поверхности всегда равно единице, т.е. для двухкомпонентного раствора в расчете на единицу массы адсорбента
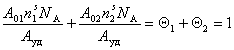
где 
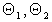
Уравнение (1.5.19) справедливо для непористых и крупнопористых адсорбентов при обратимой адсорбции. Выражая концентрации компонентов в адсорбционном слое в мольных долях, получаем для парциальной постоянной равновесия каждого компонента, например, для ПАВ,
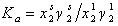
где 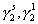
Учитывая соотношение 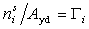
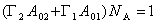
Пренебрегая адсорбцией растворителя, т.е. полагая, что Гm1 = 0, и учитывая выражение 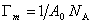
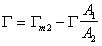
Тогда мольные доли адсорбированных веществ можно выразить как
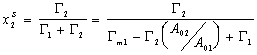
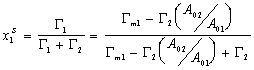
Можно считать, что
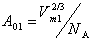
где 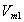
Мольные доли компонентов в растворе рассчитываются обычным путем.
Коэффициенты активности стремятся к единице при бесконечном разбавлении, поэтому для нахождения постоянной адсорбционного равновесия экспериментальные данные экстраполируют к 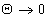
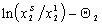
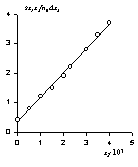
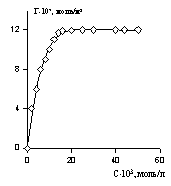
Пример изотермы адсорбции поверхностно-активного вещества — диэтилгексадецилбензолсульфоната натрия на хлопке — из неводного раствора (растворитель — перхлорэтилен) приведен на рис. 1.46. Эта изотерма может быть отнесена к типу L-4. В данном случае формирование как первого, так и последующих слоев происходит при равновесной концентрации, во много раз меньшей, чем ККМ.
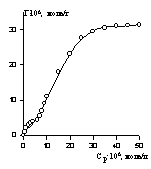
На рис. 1.47 показаны эти же экспериментальные данные для начального участка изотермы, обработанные в координатах экстраполяции для нахождения состава адсорбционного слоя. Постоянную равновесия адсорбции можно рассчитать как 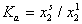
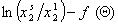
Предполагается, что растворитель не адсорбируется и тогда найденные значения постоянной адсорбционного равновесия при 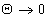
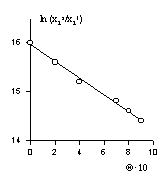
Становится очевидным, что адсорбция таких веществ на твердой поверхности будет подавлять мицеллообразование и протекать по молекулярному механизму. Отметим, что для построения графика в координатах (рис. 1.47) необходимо независимо измерять как равновесную адсорбцию, так и количество адсорбированного вещества. Такую возможность дает метод радиоактивной метки на адсорбируемом веществе.
Часто переход от мономолекулярной адсорбции к полимолекулярной из водных растворов ПАВ на неполярных непористых адсорбентах и на полярных непористых адсорбентах из среды органических растворителей с малой диэлектрической проницаемостью происходит в области равновесных концентраций, близких ККМ.
Агрегированные слои образуются и при адсорбции поверхностно-активных веществ на полярном мелкопористом адсорбенте. Пример такой изотермы адсорбции приведен на рис. 1.48. Перегиб на изотермах, соответствующий завершению формирования первого монослоя в таких системах наблюдается при ККМ в равновесных растворах. Это происходит потому, что энергия Гиббса адсорбции и мицеллообразования имеют один порядок, что является основным отличием адсорбции ПАВ на мелкопористых сорбентах, поры которых недоступны для адсорбата, по сравнению с волокнами, адсорбция на которых может сопровождаться диффузией ПАВ внутрь. Вместе с тем можно полагать, что адсорбция на мелкопористых адсорбентах протекает с агрегированием адсорбционного слоя, по-видимому, с образованием надмолекулярных структур с пониженной подвижностью молекул ПАВ.
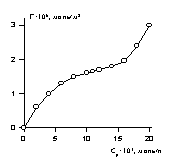
Несколько иной характер адсорбции наблюдается для крупнопористых адсорбентов, когда адсорбируются оба компонента раствора. В таких системах равновесие наступает при концентрациях выше ККМ. Зависимость гиббсовской адсорбции в них проходит через максимум. Пример такой зависимости приведен на рис. 1.49. Во избежание неправильной интерпретации изотермы адсорбции следует учитывать и адсорбцию растворителя, в связи с чем для обработки экспериментальных данных следует использовать уравнение Эверетта (1.5.8). В таких системах адсорбцию можно рассчитывать как отнесенную к массе адсорбента, так и к его удельной поверхности, найденной независимым методом, например, по адсорбции азота.
Рис. 1.50. Изотерма адсорбции в координатах уравнения Эверетта
Как пример на рис. 1.50 приведена изотерма адсорбции диэтилдодецилбензолсульфоната на силикагеле в линейной форме уравнения Эверетта. Такая зависимость позволяет определить предел адсорбции и постоянную обмена K. Следует отметить, что построение зависимостей в координатах уравнения Эверетта (1.5.8) требует кропотливой работы по независимому определению количества адсорбированного вещества непосредственно на поверхности адсорбента и определения состава равновесного раствора. Это позволяет рассчитать состав адсорбционного слоя. Затем по найденным значениям постоянной равновесия адсорбции Kа и предела адсорбции рассчитывается изотерма адсорбции с использованием уравнения Ленгмюра в форме (1.5.11). Пример полученных данных представлен на рис. 1.51. Полученная изотерма адсорбции носит типичный для ленгмюровских кривых вид с насыщением мономолекулярного слоя при концентрациях, близких ККМ, причем молекулярные площадки свидетельствуют о расположении молекул адсорбата на поверхности адсорбента «плашмя», т.е. при взаимодействии с поверхностью как полярных групп, так и углеводородных радикалов.
Расчет энергии Гиббса адсорбции на крупнопористом адсорбенте проводят следующим образом.
Общий объем адсорбционного слоя можно представить в виде суммы парциальных объемов адсорбированных компонентов.
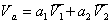
где 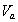
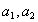
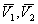
Выразив 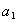
Экстраполяция экспериментальных данных к 
Таким образом, характер адсорбции зависит как от природы ПАВ, так и от вида адсорбента. Характер адсорбции во многом определяет такие процессы, как поверхностное модифицирование волокон- например, антиэлектростатическую обработку, моющее действие ПАВ и т.д.
При изучении адсорбции из водных растворов, например красителей на поверхности волокон, в качестве характеристики их сродства к адсорбенту часто используют изменение энергии Гиббса в процессе перехода из раствора на поверхность по постоянной адсорбционного равновесия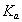
Хотя эта характеристика, рассчитанная по уравнению (1.5.18), используется достаточно широко в технической литературе и в ряде учебников по технологии текстильных производств, применение ее встречает, по крайней мере, два затруднения, которые чаще всего делают найденные величины неопределенными.
Во-первых, расчет 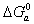
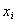
Во-вторых, уравнение (1.5.18) предполагает, что между молекулами адсорбата (красителя, ТВВ) и субстратом (волокном) проявляются лишь силы межмолекулярного взаимодействия ван-дер-ваальсова типа (а также молекулярные или даже химические взаимодействия) в отсутствие электрических сил. Но поскольку мы рассматриваем адсорбцию на заряженной поверхности (а все без исключения волокна в водной среде несут на своей поверхности двойной ионный слой), в расчетах сродства необходимо учитывать изменение электрохимического потенциала
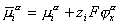
который определяется как сумма работ переноса моля частиц i-того сорта из вакуума в фазу 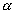
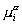

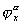
Становится очевидным, что так как потенциал двойного слоя волокон 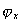
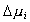
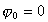
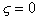
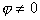
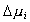
Рассмотрим влияние двойного слоя на адсорбцию заряженных молекул и покажем возможные пути управления этим процессом, а также способы разделения изменения энергии Гиббса процесса адсорбции 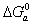
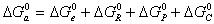
где индексы e, R, P, C обозначают электростатическую компоненту, вклад гидрофобных радикалов, вклад полярных частей и вклад химического взаимодействия в изменении энергии Гиббса при адсорбции.
Обозначим 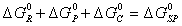
Величина 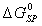
Реферат: Адсорбция и адсорбционные равновесия
| Название: Адсорбция и адсорбционные равновесия Раздел: Рефераты по химии Тип: реферат Добавлен 16:01:44 27 января 2009 Похожие работы Просмотров: 6813 Комментариев: 24 Оценило: 7 человек Средний балл: 4.3 Оценка: 4 Скачать | ||||||||
| 1. Изотерма (рис. 8) | 2. Изобара | 3. Изостера |
| А =fT (c) | А =fP (T) | c=fA (T) |
| A=fT (P) | A=fC (T) | P=fA (T) |
Фундаментальное уравнение Гиббса. Определение Гиббсовской адсорбции. Адсорбционное уравнение Гиббса
Считаем V поверхности раздела = 0.
dU = TdS + s dS +
Проинтегрировав, получим: U = TS + sS +
Полный дифференциал от этого уравнения:
dU = TdS + SdT + s dS + 

Подставляя значение dU из (6) в (7) и сократив одинаковые члены правой и левой части, получим:
SdT + Sd s + 
Предположим, что T = const:
Разделив правую и левую часть на поверхность S , получим фундаментальное адсорбционное уравнение Гиббса :



Определение зависимости поверхностного натяжения от адсорбции одного компонента, при постоянстве химических потенциалов других компонентов.

Известно, что 



Активность связана с концентрацией: с = × а . Предположим, что = 1 (при с ® 0). Тогда

Обычно уравнение Гиббса применяют для растворов. Растворителем может быть не только индивидуальное вещество, но и смесь. В разбавленных растворах гиббсовская адсорбция очень мала, а его химический потенциал меняется очень мало с изменением концентрации растворенного вещества, т.е. d m= 0. Поэтому для разбавленного раствора фундаментальное уравнение Гиббса выглядит так:
Из этих уравнений следует, что зная зависимость 

Зная эти производныеуравнения Гиббса, можно рассчитать значение Г , что позволяет построить зависимость Г = f (С) . Уравнение Гиббса показывает, что единица измерения гиббсовской адсорбции не зависит от единицы измерений концентрации, а зависит от размерности величины R . Так как величина R отнесена к молю вещества, а s — к единице площади, то Г = [моль/ единица площади]. Если s выразить в [Дж/м 2 ], то R нужно подставлять: R = 8,314 Дж/моль×К.
Поверхностная активность. Поверхностно-активные и поверхностно-инактивные вещества. Анализ уравнения Гиббса. ПАВ. Эффект Ребиндера. Правило Дюкло-Траубе
В уравнении Гиббса влияние природы вещества на адсорбцию отражается производной

g = [Дж×м/моль] = [Н×м 2 /моль]; [эрг см/моль] = [Гиббс].
Уравнение показывает, что чем сильнее снижается 
Физический смысл поверхностной активности состоит в том, что она представляет силу, удерживающую вещество на поверхности и отнесенную к единице гиббсовской адсорбции .
Поверхностную активность можно представить как отрицательный тангенс угла наклона к касательной, проведенной к кривой Г = f ( C ) в точке пересечения с осью ординат. Поверхностная активность может быть положительной и отрицательной. Значение и знак ее зависят от природы растворенного вещества и растворителя.
1. 
1. 
http://xumuk.ru/colloidchem/60.html
http://www.bestreferat.ru/referat-102895.html