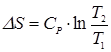Изменение энтропии
Вы будете перенаправлены на Автор24
Энтропия – это фундаментальная физическая величина. Введение этого понятия завершило этап становления понятийного аппарата термодинамики. Следующим этапом развития этой науки было выяснение физического смысла энтропии.
Установление принципа Больцмана (формулы Больцмана) и таким образом связи между термодинамикой и статистической физикой, позволило энтропии покинуть пределы физики и войти в другие области знаний.
Энтропия – это общезначимое понятие, применяемое во множестве наук, например, в:
Введено это понятие было Р. Клаузиусом. Важные работы посвятил энтропии Л. Больцман, М. Планк.
Функция состояния полным дифференциалом которой является δQ/T называется энтропией ($S$):
где $\delta Q$ – элементарное тело, получаемое термодинамической системой; $T$- термодинамическая температура.
Отметим, что формула (1) справедлива только для обратимых процессов. Например, для процессов, проводимых в идеальном газе.
Важно, что выражение (1) определяет не саму энтропию, а ее изменение, или разность энтропий. При помощи данной формулы можно вычислить, каково изменение энтропии, если термодинамическая система переходит из одного состояния в другое, но нельзя понять, какова энтропия каждого из этих состояний.
Напомним формулу Больцмана для энтропии, так как она нам поможет понять физический смысл, процессов, которые происходят с энтропией:
$S=klnW\, \left( 2 \right)$
где ($W$) – термодинамическая вероятность (статистический вес состояния), то есть количество способов, реализации данного состояния термодинамической системы. $W$ ≥1; $k$- постоянная Больцмана.
Изменение энтропии, исходя из статистической формулы Больцмана, найдем как:
Готовые работы на аналогичную тему
Вычисление изменения энтропии в изотермическом процессе
Вычислим изменение энтропии в одном моле идеального газа при изотермическом процессе ($T=const$). Оттолкнемся от первого начала термодинамики в дифференциальной форме:
$\delta Q=dU+pdV\, \left( 3 \right)$,
где $dU$ — изменение внутренней энергии идеального газа; $pdV$=$\delta A$ – работа, совершаемая газом.
Найдем отношение всех слагаемых выражения (3) и температуры:
где $C_V$ – теплоемкость газа при $V=const$.
Для идеального газа справедливо уравнение Менделеева – Клапейрона, учитывая, что у нас 1 моль газа:
$\frac
в этом случае мы можем записать для уравнения (4):
$\frac<\delta Q>
По определению (1), и принимая во внимание (7), запишем:
$dS=d\left( C_
Формула (8) показывает нам, что в изотермическом процессе изменяется только второе слагаемое правой части:
- при увеличении объема энтропия увеличивается,
- с уменьшением объема энтропия уменьшается.
Данный результат очевиден, так как если увеличивается объем, то возрастает количество мест, которое смогут занять частицы при неизменяющемся их количестве. Следовательно, растет число разных возможностей расположения на этих местах (увеличивается количество пространственных микросостояний). Увеличение числа микросостояний означает увеличение энтропии (см формулу (2)).
Изменение энтропии в изохорическом процессе
Рассмотрим изохорный процесс в идеальном газе ($V=const$ или $dV=0$). Из формулы (7) для изохорного процесса следует:
$dS=d\left( C_
После интегрирования (9), получим:
Формула (10) показывает, что в изохорическом процессе при увеличении температуры происходит рост энтропии. Данный результат можно пояснить так:
- при увеличении температуры растет средняя энергия частиц газа;
- увеличивается количество возможных энергетических состояний.
Изменение энтропии в адиабатном процессе
Адиабатный процесс характеризуется тем, что он происходит без теплообмена (δQ=0). Исследуя адиабатный процесс в идеальном газе, за основу для вычисления энтропии примем выражение (8). Найдем интеграл правой и левой частей этого выражения, получим:
Запишем уравнение адиабатного процесса в параметрах $T,V$:
где $\gamma =\frac
$\ln \left( \frac
Преобразуем выражение (11), приняв во внимание формулу (13):
Вспомним соотношение Майера:
и сделаем вывод о том, что изменение энтропии в адиабатном процессе нет:
Адиабатный процесс является изоэнтропийным ($S=const$).
При адиабатном расширении газа увеличение энтропии может идти только за счет увеличения объема, но при этом происходит уменьшение температуры, и энтропия уменьшается из-за уменьшения температуры. Данные тенденции взаимно компенсируют друг друга.
Рассмотрим пример. Два сосуда разного объема содержат по $\nu$ молей одинакового идеального газа. Температуры газов равны $ T_1$ и $ T_2$. Сосуды соединяют, газы перемешиваются. Система приходит в состояние равновесия. Определим изменение энтропии в этом процессе.
Рисунок 1. Изменение энтропии в адиабатном процессе. Автор24 — интернет-биржа студенческих работ
Будем считать, что изобарное расширение каждого из газов до конечного объема является обратимым. В этом процессе температура каждой из газовых компонент изменяется до конечной температуры $\frac
$\Delta S_<1>=\int\limits_a^b \frac
\ln \left(\frac
где $a=T_<1>;b=\frac
Изменение энтропии второго газа запишем аналогично:
$\Delta S_<2>=\nu c_
\ln \left( \frac
Поскольку энтропия является аддитивной величиной, то полное изменение энтропии найдем как сумму:
Изменение энтропии для изобарных процессов
Уравнение состояния идеального газа
Д.И.Менделеев придал этой формуле общую форму, воспользовавшись законом Авогадро. Пусть масса газа равна 1 кмоль, тогда:
Поведение реальных газов можно описать уравнением Ван-дер-Ваальса:
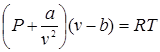
Майер на основе опытных данных установил эквивалентность между теплотой и работой:

где А – коэффициент пропорциональности.
математическим выражением первого закона термодинамики:
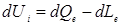
где U – внутренняя энергия системы.
Работу расширения и сжатия, где
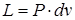
Следовательно, выражение (2.3) для одного килограмма газа примет вид:

В изохорном процессе все подводимое тепло идет на увеличение внутренней энергии газа



первое математическое выражение первого закона термодинамики примет вид:

Первый закон термодинамики через энтальпию
второе математическое выражение первого закона термодинамики:

уравнение Майера:

На практике важное значение имеет величина показателя адиабаты К, который равен:

Из молекулярно – кинетической теории газов вытекает:
— для одноатомных газов 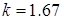
— для двухатомных газов 
— для трех- и многоатомных газов 
Для процессов протекающих при постоянном давлении установили, что 

Зная величину показателя адиабаты можно определить теплоемкости различных веществ:


Изменение внутренней энергии определяется по общей формуле:

Изохорный процесс. Доля теплоты, идущей на изменение внутренней энергии:

Изобарный процесс.Доля теплоты, идущая на изменение внутренней энергии:

где k – показатель адиабаты.

уравнение адиабаты:

уравнение политропы:

Теплоемкость газов в политропном процессе
1) в изохорном процессе 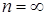

Вычтем из обеих частей уравнения по единице, получим:


2) в изобарном процессе n=0 получаем, что


3) в изотермическом процессе n=1 получаем, что


4) в адиабатном процессе n=k получаем, что
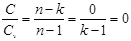

уравнение политропы
термического КПД:
термического КПД цикла Карно:
Степень расширения (сжатия) — это отношения большего объема к меньшему объему в процессе:

Для оценки эффективности работы холодильных машин служит холодильный коэффициент 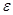

термического КПД обратимого и необратимого циклов имеет вид:

Термический КПД обратимый цикл
. Термический КПД обратимого цикла
Интегральная сумма приведенных теплот

для обратимых и необратимых циклов общее выражение для приведенной теплоты примет вид:


Для обратимого адиабатного процесса:

изменение энтропии для изотермических, изохорных процессов;
изменение энтропии для изобарных процессов
угловые коэффициенты изохоры и изобары


Изменение энтропии в политропном процессе можно определить по формуле:

значение углового коэффициента для политропных процессов:
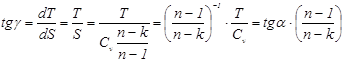

Блог об энергетике
энергетика простыми словами
Основные термодинамические процессы
Основными процессами в термодинамике являются:
- изохорный, протекающий при постоянном объеме;
- изобарный, протекающий при постоянном давлении;
- изотермический, происходящий при постоянной температуре;
- адиабатный, при котором теплообмен с окружающей средой отсутствует;
- политропный, удовлетворяющий уравнению pv n = const.
Изохорный, изобарный, изотермический и адиабатный процессы являются частными случаями политропного процесса.
При исследовании термодинамических процессов определяют:
- уравнение процесса в p—v иT—s координатах;
- связь между параметрами состояния газа;
- изменение внутренней энергии;
- величину внешней работы;
- количество подведенной теплоты на осуществление процесса или количество отведенной теплоты.
Изохорный процесс

При изохорном процессе выполняется условие v = const.
Из уравнения состояния идеального газа (pv = RT) следует:
т. е. давление газа прямо пропорционально его абсолютной температуре:
Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const).
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при cv = const определяется по формуле:
Т. к.l = 0, то на основании первого закона термодинамики Δu = q, а значит изменение внутренней энергии можно определить по формуле:
Изменение энтропии в изохорном процессе определяется по формуле:
Изобарный процесс
Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа слуедует:
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре.
Работа будет равна:
Количество теплоты при cp = const определяется по формуле:
Изменение энтропии будет равно:
Изотермический процесс
При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается.
Работа процесса будет равна:
Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения:
При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии равно:
Адиабатный процесс
Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид:
В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через cад, и условие dq = 0 выразим следующим образом:
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (cад = 0).
и уравнение кривой адиабатного процесса (адиабаты) в p, v-диаграмме имеет вид:
В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона).
kвыхлопных газов ДВС = 1,33
Из предыдущих формул следует:
Техническая работа адиабатного процесса (lтехн) равна разности энтальпий начала и конца процесса (i1 – i2).
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. В T, s-диаграмме он изображается вертикальной линией.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds > 0, и процесс называется реальным адиабатным процессом.
Политропный процесс
Политропным называется процесс, который описывается уравнением:
Показатель политропы n может принимать любые значения в пределах от -∞ до +∞, но для данного процесса он является постоянной величиной.
Из уравнения политропного процесса и уравнения Клайперона можно получить выражение, устанавливающее связь между p, vи Tв любых двух точках на политропе:
Работа расширения газа в политропном процессе равна:
В случае идеального газа эту формулу можно преобразовать:
Количество подведенной или отведенной в процессе теплоты определяется с помощью первого закона термодинамики:
представляет собой теплоемкость идеального газа в политропном процессе.
При cv, k и n = const cn = const, поэтому политропный процесс иногда определят как процесс с постоянной теплоемкостью.
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
Графическое представление политропа в p, v координатах в зависимости от показателя политропа n.
pv 0 = const (n = 0) – изобара;
pv = const (n = 1) – изотерма;
p 0 v = const, p 1/∞ v = const, pv ∞ = const – изохора;
n > 0 – гиперболические кривые,
n По материалам моего конспекта лекций по термодинамике и учебника «Основы энергетики». Автор Г. Ф. Быстрицкий. 2-е изд., испр. и доп. — М. :КНОРУС, 2011. — 352 с.
http://lektsii.org/10-8192.html
http://energoworld.ru/theory/osnovnyie-termodinamicheskie-protsessyi/