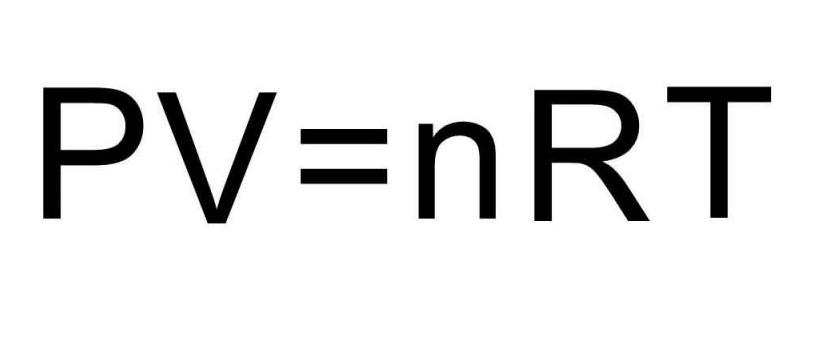Внутренняя энергия идеального газа
На этой странице вы можете рассчитать внутреннюю энергию идеального газа с помощью калькуляторов онлайн или самостоятельно по формулам.
через массу, молярную массу и температуру
Формула для нахождения внутренней энергии идеального одноатомного газа через массу, молярную массу и температуру:
через давление и объем
Формула для нахождения внутренней энергии идеального одноатомного газа через давление и объем:
через количество вещества и температуру
Формула для нахождения внутренней энергии идеального одноатомного газа через количество вещества и температуру:
через степени свободы
Формула для нахождения внутренней энергии идеального одноатомного газа через количество вещества и температуру:
Количество степеней свободы молекулы идеального газа
Число степеней свободы (i) — наименьшее число независимых координат, которое необходимо ввести, чтобы определить положение тела в пространстве.
Внутренняя энергия и работа идеального газа
теория по физике 🧲 термодинамика
Числом степеней свободы механической системы называют количество независимых величин, с помощью которых может быть задано положение системы.
Внутренняя энергия идеального газа представляет собой сумму только кинетической энергии всех молекул, а потенциальной энергией взаимодействия можно пренебречь:
U = ∑ E k 0 = N E k 0 = m N A M . · i k T 2 . . = i 2 . . · m M . . R T = i 2 . . ν R T = i 2 . . p V
i — степень свободы. i = 3 для одноатомного (или идеального) газа, i = 5 для двухатомного газа, i = 6 для трехатомного газа и больше.
Изменение внутренней энергии идеального газа в изопроцессах
| Основная формула | |||||||||||
| Изотермический процесс | |||||||||||
| Изобарное расширение | |||||||||||
| Изохорное увеличение давления | |||||||||||
| Произвольный процесс |
| Изобарное расширение: A ‘ = p ( V 2 − V 1 ) | 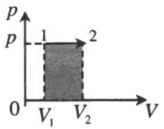 |
| Изобарное сжатие: A ‘ = p ( V 2 − V 1 ) | 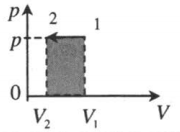 |
| Изохорное охлаждение: | 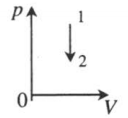 |
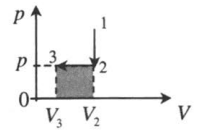 | |
| Замкнутый цикл: 1–2: A ‘ = ( p 1 − p 3 ) ( V 2 − V 1 ) | 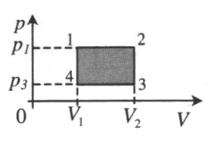 |
| Произвольный процесс: A ‘ = p 1 + p 2 2 . . ( V 2 − V 1 ) | 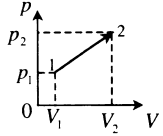 |
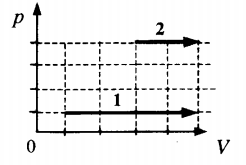
Пример №2. На pV-диаграмме показаны два процесса, проведенные с одним и тем же количеством газообразного неона. Определите отношение работ A2 к A1 в этих процессах.
Неон — идеальный газ. Поэтому мы можем применять формулы, применяемые для нахождения работы идеального газа. Работа равна площади фигуры под графиком. С учетом того, что в обоих случаях изобарное расширение, получим:
A 2 = p ( V 2 − V 1 ) = 4 p ( 5 V − 3 V ) = 4 p 2 V = 8 p V
A 1 = p ( V 2 − V 1 ) = p ( 5 V − V ) = 4 p V
Видно, что работа, совершенная во втором процессе, вдвое больше работы, совершенной газом в первом процессе.
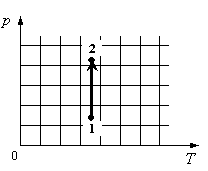
Для каждой величины подберите соответствующий характер изменения:
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Алгоритм решения
- Определить по графику, как меняется давление.
- Определить, как меняется объем.
- Определить, отчего зависит внутренняя энергия газа, и как она меняется в данном процессе.
Решение
На графике идеальный одноатомный газ изотермически сжимают, так как температура остается неизменной, а давление увеличивается. При этом объем должен уменьшаться. Но внутренняя энергия идеального газа определяется его температурой. Так как температура постоянна, внутренняя энергия не изменяется.
pазбирался: Алиса Никитина | обсудить разбор | оценить
Один моль аргона, находящийся в цилиндре при температуре T1=600 K и давлении p1=4⋅10 5 Па, расширяется и одновременно охлаждается так, что его температура при расширении обратно пропорциональна объёму. Конечное давление газа p2=10 5 Па. Какое количество теплоты газ отдал при расширении, если при этом он совершил работу A=2493 Дж?
Формула внутренней энергии идеального газа. Изменение внутренней энергии газа: формула
Изучая поведение газов в физике, часто возникают задачи на определение запасенной в них энергии, которую теоретически можно использовать для совершения некоторой полезной работы. В данной статье рассмотрим вопрос, по каким формулам внутренняя энергия идеального газа может быть рассчитана.
Понятие о газе идеальном
Четкое понимание концепции идеального газа важно при решении задач с системами, находящимися в этом агрегатном состоянии. Любой газ принимает форму и объем сосуда, в который его помещают, однако, не всякий газ является идеальным. Например, воздух можно считать смесью идеальных газов, в то же время водяной пар не является таковым. В чем же заключается принципиальная разница между реальными газами и их идеальной моделью?

Ответом на поставленный вопрос будут две следующие особенности:
- соотношение между кинетической и потенциальной энергией молекул и атомов, составляющих газ;
- соотношение между линейными размерами частиц газа и средним расстоянием между ними.
Газ считается идеальным только в том случае, когда средняя кинетическая энергия его частиц несоизмеримо больше энергии связи между ними. Разница между этими энергиями такова, что можно считать, что взаимодействие между частицами полностью отсутствует. Также для идеального газа характерно отсутствие размеров у его частиц, вернее эти размеры можно не учитывать, поскольку они намного меньше средних межчастичных расстояний.

Хорошими эмпирическими критериями, позволяющими определить идеальность газовой системы, являются такие ее термодинамические характеристики, как температура и давление. Если первая больше 300 К, и второе меньше 1 атмосферы, то любой газ может полагаться идеальным.
Что это внутренняя энергия газа?
Прежде чем записать формулу внутренней энергии газа идеального, необходимо познакомится с этой характеристикой ближе.
В термодинамике внутреннюю энергию, как правило, обозначают латинской буквой U. Определяется в общем случае она по следующей формуле:
Где H — энтальпия системы, P и V — давление и объем.
По своему физическому смыслу внутренняя энергия состоит из двух составляющих: кинетической и потенциальной. Первая связана с различного рода движением частиц системы, а вторая — с силовым взаимодействием между ними. Если применить это определение к концепции газа идеального, у которого отсутствует потенциальная энергия, то величина U при любом состоянии системы будет точно равна его кинетической энергии, то есть:
Вывод формулы внутренней энергии
Выше мы установили, что для ее определения у системы с идеальным газом необходимо рассчитать его кинетическую энергию. Из курса общей физики известно, что энергия частицы массой m, которая поступательно движется в некотором направлении со скоростью v, определяется по формуле:
Ее также можно применить для газовых частиц (атомов и молекул), однако, необходимо сделать некоторые замечания.
Во-первых, под скоростью v следует понимать некоторую среднюю величину. Дело в том, что газовые частицы движутся с разными скоростями согласно распределению Максвелла-Больцмана. Последнее позволяет определить среднюю скорость, которая с течением времени не изменяется, если отсутствуют внешние воздействия на систему.
Во-вторых, формула для Ek1 предполагает энергию на одну степень свободы. Газовые частицы могут двигаться во всех трех направлениях, а также вращаться в зависимости от их строения. Чтобы учесть величину степени свободы z, следует ее умножить на Ek1, то есть:
Кинетическая энергия всей системы Ek в N раз больше, чем Ek1z, где N — общее число газовых частиц. Тогда для U получаем:
Согласно этой формуле, изменение внутренней энергии газа возможно только в том случае, если поменять число частиц N в системе, либо их среднюю скорость v.
Внутренняя энергия и температура
Применяя положения молекулярно-кинетической теории идеального газа, можно получить следующую формулу связи между средней кинетической энергией одной частицы и абсолютной температурой:
Здесь kB — постоянная Больцмана. Подставляя это равенство в формулу для U, полученную в пункте выше, приходим к следующему выражению:
Данное выражение можно переписать через количество вещества n и газовую постоянную R в следующем виде:
В соответствии с этой формулой, изменение внутренней энергии газа возможно, если поменять его температуру. Величины U и T зависят друг от друга линейно, то есть график функции U(T) представляет собой прямую линию.
Как строение газовой частицы влияет на внутреннюю энергию системы?
Под строением частицы газа (молекулы) имеется в виду количество атомов, которое ее составляет. Оно играет определяющую роль при подстановке соответствующей степени свободы z в формулу для U. Если газ является одноатомным, формула внутренней энергии газа принимает такой вид:
Откуда взялась величина z=3? Ее появление связано всего с тремя степенями свободы, которыми обладает атом, поскольку он может двигаться только в одном из трех пространственных направлений.
Если рассматривается двухатомная молекула газа, то внутреннюю энергию следует вычислять по такой формуле:
Как видим, двухатомная молекула уже имеет 5 степеней свободы, 3 из которых являются поступательными и 2 вращательными (в соответствии с геометрией молекулы, она может вращаться вокруг двух взаимно перпендикулярных осей).
Наконец, если газ является трех- и более атомным, то справедливо следующее выражение для U:
Сложные молекулы имеют 3 поступательных и 3 вращательных степени свободы.
Пример задачи
Под поршнем находится одноатомный газ при давлении 1 атмосфера. В результате нагрева газ расширился так, что его объем увеличился от 2-х литров до 3-х. Как при этом изменилась внутренняя энергия газовой системы, если процесс расширения был изобарным.
Чтобы решить эту задачу, недостаточно приведенных в статье формул. Необходимо вспомнить об уравнении состояния идеального газа. Оно имеет вид, представленный ниже.
Поскольку поршень закрывает цилиндр с газом, то в процессе расширения количество вещества n остается постоянным. Во время изобарного процесса температура изменяется прямо пропорционально объему системы (закон Шарля). Это означает, что формула выше запишется так:
Тогда выражение для внутренней энергии одноатомного газа примет форму:
Подставляя в это равенство значения давления и изменения объема в единицах СИ, получаем ответ: ΔU ≈ 152 Дж.
http://spadilo.ru/vnutrennyaya-energiya-i-rabota-idealnogo-gaza/
http://1ku.ru/obrazovanie/55211-formula-vnutrennej-jenergii-idealnogo-gaza-izmenenie-vnutrennej-jenergii-gaza-formula/