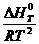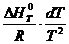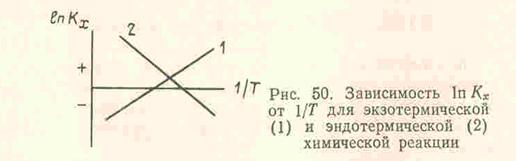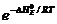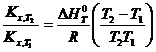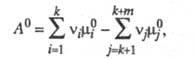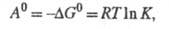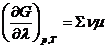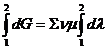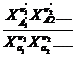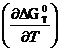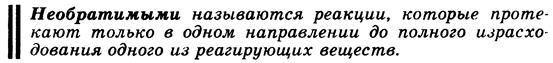Уравнение изобары химической реакции и приведите его вывод
ЛЕКЦИЯ № 5. Химическое равновесие
1. Понятие химического равновесия. Закон действующих масс
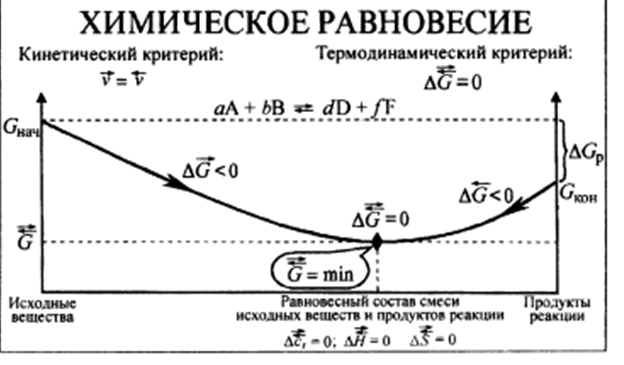
При протекании химической реакции через некоторое время устанавливается химическое равновесие. Существует два признака химического равновесия: кинетический, термодинамический. В кинетическом – ?пр = ?обр, в термодинамическом – характеризует химическую реакцию при условиях P, t – const (?G = 0); при условиях V, Т – const (?F = 0).
Химический потенциал – функция, которая характеризует состояние i-го компонента при определенных внешних условиях.
где n1 – число молей i-го компонента.
Если к бесконечно большому количеству раствора прибавить определенное количество какого-нибудь компонента, то химический потенциал системы определяется изменением изобарного потенциала при изобарных условиях или изменением изохорного потенциала при изохорных условиях.
Химический потенциал зависит от концентрации данного компонента
где Рi– парциальное давление – вклад каждого компонента в общее давление или давление, которое компонент имел бы, если бы находился в смеси.
Парциальное давление – элементарная функция (можно складывать). Пример (O2, N2, H2) – их общее давление
?0– значение химического потенциала при стандартных условиях.
Химический потенциал характеризует способность данного компонента выходить из данной фазы путем испарения, растворения, кристаллизации и т. д. Переход этот происходит произвольно.
В результате химического равновесия скорость прямой реакции уменьшается, а скорость обратной реакции увеличивается.
Концентрации, которые соответствуют химическому равновесию, называются равновесными концентрациями. Связь между равновесными концентрациями устанавливается законом действующих масс (ЗДМ). Этот закон в 1867 г. вывели К. М. Гульберг и П. Вааге.
Кинетический вывод ЗДМ
f – фугитивность – парциальное давление для реальных газов. Возникает вопрос, будут ли равняться Кpи Кс.
Кpи Кc– отличаются на RT ?vi в сумме стехиометрических коэффициентов.
если ?vi = 0, то Kp = Kc. ?vi = 1 + 1 – 1 – 1 =0 – когда стехиометрический коэффициент = 1.
2. Уравнение изотермы химической реакции
Если реакция протекает обратимо, то ?G= 0.
Если реакция протекает необратимо, то ?G? 0 и можно рассчитать изменение ?G.
где ? – пробег реакции – величина, которая показывает, сколько молей изменилось в ходе реакции. I сп – характеризует равновесное и неравновесное состояние реакции, II сп – характеризует только неравновесные состояния.
это уравнение изотермы химической реакции.
С помощью уравнения изотермы химической реакции можно судить о направлении протекания реакции.
3. Уравнения изохоры, изобары химической реакции
Зависимость К от температуры
По ним судят о направлении протекания реакции:
4. Расчет KP (метод Темкина-Шварцмана)
термодинамический метод расчета Kp.
Пример. Расчет Kp для реакции PbS04 распадается на РbО и S03.
Результаты вычислений занесены в таблицу 2.
5. Расчет равновесного состава химического равновесия
Равновесный состав можно рассчитать только для газовой системы
Исходная концентрация всех компонентов
Изменение каждого компонента по числу молей (или стехиометрическому коэффициенту):
??– (пробег реакции) – химическая переменная.
Она показывает изменение количества вещества по числу молей. Если реакция не началась, то ?? = 0. Если количество исходных веществ превратилось в такое же количество продуктов реакции, то ?? = 1.
Рассчитать равновесный состав по третьему компоненту при условии, что А = а моль/л; В = в моль/л.
Рассчитываем по 4 компоненту:
Газообразные вещества реагируют по уравнению:
Найти парциальное давление каждого компонента.
Вещества А и В превращаются в С в количестве Х. Исходные вещества А= 2 моль, В= 1 моль.
Для того, чтобы найти парциальное давление, мы должны Роб умножить на мольную долю. Мольная доля определяется отношением числа молей каждого компонента, отнесенного к общему числу молей всех компонентов.
где En – общее число молей, участвующих в этой газовой смеси.
где РА – парциальное давление.
Уравнение изобары химической реакции и приведите его вывод
40. Выведите уравнение изобары. Его практическое применение.
Уравнение изобары химической реакции для стандартных (или любых других условий) условий можно получить, объединяя уравнение Гиббса — Гельмгольца:
∆ G 0 T = ∆ H 0 T + T
с уравнением изотермы изотермы реакции:
Из этих двух уравнений получим:
RT 2 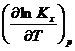
Из этого уравнения изобара химической реакции будет иметь такой вид:
RT 2 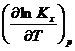
Где ∆ H 0 T — тепловой эффект химической реакции, Дж/моль.
Последнее уравнение можно использовать в дифференциальной форме для расчета теплового эффекта или Кх с помощью ЭВМ или аналитически по интегральным уравнениям. Их молено получить с помощью метода неопределенлого или определенного интегрирования уравнения.
Неопределенное интегрирование. Вначале разделим переменные в уравнении RT 2 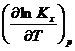
dlnKx =
Для неширокого интервала изменения температуры можно принять тепловой эффект постоянным ( ∆ H 0 T = const ) и тогда уравнение легко проинтегрировать:
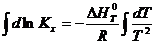
После завершения интегрирования получим:
lnKx =- 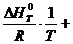
Это уравнение решается графически, если его представить в координатах lnKx = K (1/ T )
По тангенсу угла наклона прямой к оси абсцисс можно рассчитать теплоту реакции tgφ =-∆ H 0 T / R , а на оси ординат прямая отсекает отрезок, равный In С. В экспоненциальной форме уравнение принимает такой вид:
Kx = C
Это уравнение графически изображается экспонентой.
Определенное интегрирование. Для неширокого интервала температуры, при условии независимости ∆ H 0 T от температуры, уравнение RT 2 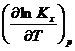
можно проинтегрировать методом определенного интегрирования;
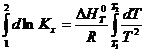
ln
С помощью этого уравнения можно рассчитать ∆ H 0 T по экспериментальным значениям Kx при различных температурах или можно рассчитать Kx , T 2 если известны значения теплового эффекта реакции и Kx , T 1
Общая температурная зависимость константы равновесия от температуры.
В широком интервале изменения температурь] тепловой эффект химической реакции зависит от температуры, которую можно определить по формуле Кирхгофа;
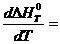
I Теплоемкости чаще всего в литературе определяют по степенному ряду типа: СР=а+ b Т+сТ 2
или согласно Матвееву по уравнению: СР=а+ b Т+сТ 2 + dT 3 + e / T 2 + f / T
Для химической реакции ∑ ν i Ai =∑ ν ’ i A ’ i разность теплоемкостей продуктов реакции и исходных веществ определится по формуле: ∆ СР=∆а+ ∆ b Т+∆сТ 2
Подставим этот степенной ряд в формулу Кирхгофа:
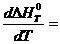
Разделяя переменные и интегрируя в интервале от 0 до Т К:
где ∆ H 0 0 —эмпирическая константа интегрирования, которая в данном случае не имеет физического смысла. Она приобретает четкое физическое содержание, если для теплоемкостей веществ используется теоретическое уравнение зависимости СР=Ср (Т). Подставим это выражение в уравнение изобары, получим:
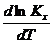
Разделяя переменные в этом уравнении и беря йеодределен-ный интеграл, получим такую зависимость Кх от Т:
где /—константа интегрирования. Ее величину рассчитывают по опытным данным или теоретически с помощью тепловой теоремы Нернста.
Практическое применение. Изобара химической реакции позволяет рассчитывать константы равновесия для разных температур.
39. Понятие о химическом сродстве. Что такое стандартное химическое сродство?
В смеси один вещества активно реагируют между собой (например, олефины и О2), а другие при обычных условиях не взаимодействуют друг с другом — N 2 и О2, N2 и Н2. Из этого следует, что способность молекул различных веществ химически взаимодействовать друг с другом связана с какими-то особыми силами, которые химики назвали химическим сродством. Следовательно, химическое сродство определяется, как способность веществ подвергаться химическим превращениям или химическому взаимодействию с образованием продуктов реакции.
Вначале за меру химического сродства предлагали принимать скорость химической реакции. Однако скорость химической реакции при одних и тех же условиях можно было изменять путем воздействия на вещества катализаторами разной природы. Это приводило к неопределенности при определении химического сродства. Поэтому скорость химической I реакции не может быть мерой химического сродства.
I Ю. Томсен (1853) и П. Бертло (1867) предложили за меру г химического сродства принимать тепловой эффект химической реакции, которая проходит самопроизвольного выделением теплоты (экзотермические процессы). Однако работами Д. И. Менделеева было показано, что этот принцип не обладает общностью. Дело в том, что, во-первых, некоторые реакции проходят самопроизвольно, но с поглощением энергии в форме теплоты при обычных температурах. Во-вторых, все реакции являются обратимыми. Еще Бекетов показал, что одни и те же реакции при одних условиях проходят с выделением теплоты, а при других —с поглощением, как например, реакции гидрирования этилена.
При обычных температурах эта реакция идет в прямом направлении с выделением теплоты, а при высоких температурах — в обратном направлении с поглощением теплоты. Следовательно, теплоту реакции также нельзя использовать при обычных условиях в качестве меры химического сродства.
Правильное направление в определении меры химического сродства было намечено работами Дж. В. Гиббса и Г. Гельмгольца,который был развит Вант-Гоффом , который предложил в качестве меры химического сродства использовать максимальную работу химического процесса. Максимальная и максимально-полезная работы определяются по выражениям:
Эти величины являются интегральными и не зависят от способа проведения химического процесса, а зависят только от начального и конечного состояния системы. Учитывая, что;
B еличина ∆ GT будет равна тепловому эффекту реакции при T →0
Следовательно, сродство по Вант-Гоффу и Томсену — Бертло будут совпадать, если T ∆ ST =0 при Т=0, а
Для стандартных условий химическое сродство можно рассчитывать, по формуле: ∆ GT 0 = ∆ HT 0 — T ∆ ST 0
Стандартные условия характеризуют, что энергия Гиббса рассчитывается при давлении вещества в системе, равном Р= = 1 атм ; 101,3 кПа; 1,013-10 5 Па.
Знак изменения энергии Гиббса характеризует направление самопроизвольного или несамопроизвольного протекания процесса при данных условиях, а равенство ( д ∆ GT °)р,Т=0 определяет равновесное состояние в смеси химических веществ, между которыми возможно химическое взаимодействие. Равновесие имеет динамический характер, то есть при равновесии υпр = υобр .
Химическое сродство можно рассчитывать по изменению энергии Гиббса, по изотермам, изохорам и изобарам химической реакции. С его помощью и закона действующих масс можно рассчитывать равновесный состав химического процесса.
Стандартное химическое сродство определяется соотношением:
где 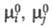
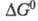
38. Выведите уравнение изотермы химической реакции, протекающей в идеальной газовой смеси.
Изменение энергии Гиббса в ходе реакции при изменении числа прореагировавших эквивалентов участников реакции определится по выражениям:
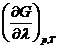
где Р i -парциальные давления, а Р ∑ νi i определяется по соотношению:
Р ∑ νi i = 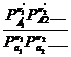
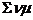
Завершая интегрирование, получим:
G 2 — G 1 = 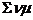
Так как в идеальном газе парциальные давления исходных компонентов равны единице, то:
Если в ходе реакции превращается только один эквивалент веществ,тогда :
λ 2 — λ 1 =1, и получим уравнение:
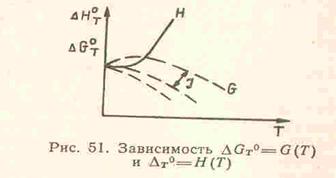
37. Докажите графически тепловую теорему Нернста.
Тепловая теорема Нернста
Изменение энергии Гиббса определяется для стандартных условий согласно выражению:
∆ GT 0 = ∆ HT 0 — T ∆ ST 0 При температуре абсолютного нуля справедлив принцип Бертло , когда значения ∆ GT 0 и ∆ HT 0 равны между собой, то есть:
Это равенство выполняется вследствие того, что кривые, определяющие зависимость ∆ GT 0 = G (Т) и ∆ HT 0 = H ( T ), сближаются при понижении температуры и совпадают между собой уже в окрестности абсолютного нуля и они имеют общую касательную. На этом основании В. Нернст сформулировал теорему о тангенсе угла наклона касательной к обеим кривым в такой форме: при температуре, стремящейся к абсолютному нулю для реакций, протекающих между веществами в конденсированной фазе, тепловой эффект равен изменению энергии Гиббса или изменению энергии Гельмгольца, а производные от этих функций равны друг другу и равны нулю:
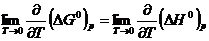
Эта теорема доказывается экспериментально-графическим способом. Для этого строят на графике по формуле Кирхгофа кривую зависимости теплового эффекта от температуры ∆НТ°=Н(Т).
Затем подставляют формулу Кирхгофа в формулу 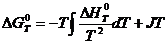
Из семейства кривых для ∆ GT 0 = G ( T ) реальной является та, которая совпадает со сплошной кривой для зависимости ∆НТ°=Н(Т) и идет совместно с ней параллельно оси абсцисс вплоть до T =0 К. Эта закономерность отражает независимость термических свойств веществ вблизи абсолютного нуля и является утверждением, что с термодинамической точки зрения абсолютный нуль недостижим. Вблизи абсолютного нуля термические свойства рабочего тела перестают зависеть от температуры. Производные от теплового эффекта и ∆ GT ° вблизи абсолютного нуля при P = const п o T будут равны нулю. Далее, учитывая, что:
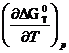
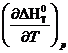
на основе тепловой теоремы Нернста можно получить равенство нулю изменения энтропии и теплоемкости конденсированных веществ при Т→0 К, то есть:
Для конденсированных систем эти величины слабо зависят от Р и Т, поэтому индекс нулик можно не применять.
С помощью тепловой теоремы Нернста можно определить численное значение константы интегрирования J при условии, что T =0 К и реакция проходит между веществами, находящимися в конденсированном состоянии. С этой целью уравнение:
∆ GT 0 = ∆ H 0 0 — T 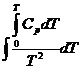
Продифференцируем по температуре при P = const ,получим такое выражение:
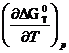
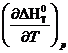
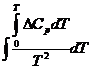
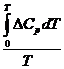
Устремим температуру к нулю Кельвина:
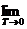
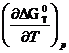
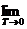
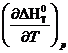
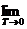
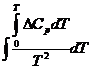
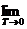
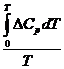
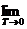
Применяя к этому выражению тепловую теорему в форме соотношений 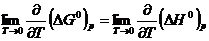
Таким образом, для химической реакция, протекающей между веществами в конденсированном состоянии, изменение энергии Гиббса можно уже рассчитывать по уравнению, не содержащему константу интегрирования:
∆ GT 0 = ∆ H 0 0 — T
В этом уравнении в правой части содержатся только термические и калорические величины ∆ H о ° и СР и не содержатся функции равновесия, то есть константа интегрирования J . Поэтому по уравнению можно рассчитать равновесие реакции между конденсированными веществами только по термическим данным, не изучая опытно химическое равновесие в такой системе. Подставляя в это уравнение изотерму химической реакции, можно рассчитать уже константу равновесия.
36. Покажите какая связь существует между константами равновесия химических реакций Кр , Кс , Кх ,К f , Кр 0 ?
Реакции в газовой фазе, в общем случае, проходят с изменением числа молей веществ, поэтому численные значения констант равновесия зависят от тех параметров, через которые они Выражены, то есть:
Кс= 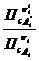
Кр= 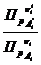
Кх= 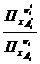
Эти константы в общем случае не равны между собой: Кс ≠КР ≠КХ.
Для идеальной газовой смеси веществ, участвующих в химической реакции, связь между константами равновесия можно получить на основе перехода от одних единиц измерения состава смеси к другим, используя законы Клапейрона —Менделеева и Дальтона в такой форме:
Р i =с i R Т и Р i = х i Р;при подстановке этих уравнений в Кр= 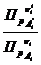
где для исходных веществ стехиометрические коэффициенты берутся со знаком минус, а для продуктов реакции — со знаком плюс; кроме того,
Численные значения констант равновесия будут равны между собой только при условии, когда ∑ νi = 0 или при условии проведения реакции в конденсированной фазе. Тогда:
Обращаем внимание на то, что константы равновесия являются безразмерными величинами.
35. Выведите закон действующих масс для системы, в которой реакция протекает в растворе.
Для реакций, протекающих в растворах (жидких или твердых), в качестве параметра, измеряющего его свойства, используют активность. Изменение химического потенциала общего типа определяется по разности химических потенциалов продуктов реакции и исходных веществ Химический потенциал компонентов в растворе при Т=со nst рассчитывается по выражению: μi = RTln а i + φi ( T ) , где а i , — активность i -го вещества в смеси.. Для химической реакции общего вида ∑ υ i А i = ∑ υ ’ i А ’ i разность химических потенциалов запишется в таком виде:∑ μν =
∑ μν = RTln а ∑ν + ∑ν φ( T), где
а ∑ ν = 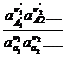
и из уравнения получим такое выражение:
ln а ∑ ν равн = — ∑ ν φ ( T )/ RT , где знак « равн .» определяет равновесные значения активностей.
где а ∑ ν —отношение произведений активностей компонентов в растворе, которое представляется в таком виде:
а ∑ ν =
При постояннойТ в уравнение ln а ∑ ν = — ∑ ν μ 0 ( T )/ RT можно ввести константу равновесия Ка :
Сравнивая уравнения, получим;
Потенцируя это выражение, Получим закон действующих масс в форме:
Ка= 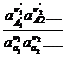
34. Кинетический и термодинамический выводы закона действующих масс для реакции, протекающей в газовой фазе при низких давлениях.
Все химические реакции одновременно протекают в 2 направлениях: в сторону образования продуктов реакции (прямая реакция) и в сторону превращения продуктов в исходные вещества (обратная реакция). Вследствие химической обратимости реакции не доходят до конца, так как скорость реакции прямо пропорциональна концентрации, то с течением времени скорость прямой реакции будет уменьшаться, а скорость обратной расти. Когда обе скорости сравняются, наступит химическое равновесие. Химическое равновесие – динамическое, характеризуется постоянством равновесных концентраций (или парциальных давлений) всех участков реакции при постоянстве внешних условий и минимальном значении энергии Гиббса или Гельмгольца.
Например, для реакции синтеза иодида водорода Н2+ I 2 ↔2 HI скорости прямой и обратной реакции υпр = k пр сН2с I 2 ; υобр = k обр с 2 HI . При равновесии υпр = υобр , а концентрации становятся равновесными (с ’ ). Тогда k пр с’Н2с ’ I 2 = k обр с ‘2 HI или k пр / k обр = с ‘2 HI / с’Н2с ’ I 2 , где k пр и k обр — константы скорости соответственно прямой и обратной реакции.
Эти величины не зависят от концентрации и при постоянной температуре являются постоянными. Поэтому их отношение есть некая постоянная величина Кс, называемая константой химического равновесия: Кс= k пр / k обр = с ‘2 HI / с’Н2с ’ I 2 . В общем виде для реакции υаА + υвВ ↔ υсС + υ d D
Кс= ( с ‘ с ) υс (с ‘ d ) υ d /( с ‘ a ) υ a (с ‘ B ) υ B ,где с ‘ с с ‘ D с ‘ A с ‘ B -равновесные концентрации участников реакции. Это уравнение выражает закон действующих масс: отношение произведения равновесных концентраций(давлений) продуктов реакции, взятых в степенях ,равных их стехиометрическим коэффициентам, к такому же произведению концентраций(давлений парциальных) исходных веществ при данной температуре есть величина постоянная, называемая константой химического равновесия.
Химический потенциал компонентов в смеси при Р, Т=со nst рассчитывается по выражению:
где X i , — мольная доля i -го вещества в смеси. Это произвольная (неравновесная) величина. Для химической реакции общего вида ∑ υ i А i = ∑ υ ’ i А ’ i разность химических потенциалов запишется в таком виде:
∑ μν = RTln X ∑ν + ∑ν μ 0 (P, T), где
X ∑ ν =
Выражение записано для некоторого состояния смеси веществ, удаленного от равновесия. После достижения равновесия: ∑ ν μ =0,
и из уравнения получим такое выражение:
ln X ∑ ν = — ∑ ν μ 0 ( P , T )/ RT ,
где X ∑ ν —отношение произведений равновесных мольных долей веществ в смеси, которая представляется в таком виде:
X ∑ ν =
При постоянных Р иТ в уравнение ln X ∑ ν = — ∑ ν μ 0 ( P , T )/ RT можно ввести константу равновесия Кх :
ln Кх= — ∑ ν μ 0 ( P , T )/ RT .
Сравнивая уравнения, получим;
Потенцируя это выражение, Получим закон действующих масс в форме:
Кх=
Константа равновесия Кх зависит уже от Р и Т.
33. Условия равновесия в химической системе. Химическая переменная. Какие методы вычисления ∆ G 0 реакции вам известны?
Химические реакции являются двухсторонними, то есть они одновременно протекают как в сторону продуктов реакции, так и в сторону образования исходных веществ со скоростями: υпр — прямой реакции и υ обр — обратной реакции. В начальных условиях эти скорости реакций не равны, а результирующая скорость процесса будет равна разности скоростей реакций прямого и обратного направления: υ = υпр — υобр
Реакция проходит в направлении достижения равновесного состояния в системе, которое определяется как динамическое равновесие. Для равновесия:
Систему можно подвести к равновесию термодинамически обратимо, если в системе имеется сопротивление типа проницаемой перегородки, или термодинамически необратимо. В химической системе; можно выделить истинно равновесные смеси веществ и системны с ложным равновесием. Истинное равновесие характеризуется тем, что с изменением термодинамических параметров (Р, Т) на бесконечно малую величину на такую же величину изменяется и равновесный состав смеси веществ. При возвращении параметров до исходного значения равновесие также возвращается к исходному состоянию. Это легко можно проиллюстрировать на примере реакции:
При комнатной температуре эта смесь содержит в равновесной смеси небольшую концентрацию N02 и смесь бесцветна. При нагревании смеси при повышенной, но постоянной температуре, равновесие c двигается вправо и смесь приобретает желто-бурую окраску. Если смесь охладить до комнатной температуры, то окраска смеси снова исчезает, то есть система возвращается к исходному состоянию равновесия.
Ложное равновесие характеризуется тем, что при малых воздействиях на смесь веществ в ней протекают конечные изменения. Так, смесь, содержащая 2 объема Н2 и один объем О2, может существовать длительное время без изменения и находится как бы в состоянии равновесия. При внесении в такую смесь накаленной платиновой Проволочки она реагирует со взрывом. Изменения в такой системе уже необратимы.
Изменения в равновесных химических системах можно изучать с помощью термодинамических функций и, в частности, с помощью энергий Гельмгольца и Гиббса. Для удобства изучения химических процессов вводится понятие химической переменной или пробега реакций. Для этого записываем общее выражение химического превращения веществ, учитывая, что взаимодействие молекул друг с другом в смеси проходит в строго стехиометрических соотношениях (закон Дальтона) в таком виде:
ν 1 А1+ ν 2 А2+… 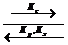
где νi ν ’ i — стехиометрические коэффициенты исходных веществ и продуктов реакции: Кс, КР,Кх — константы равновесия. В термохимических и термодинамических уравнениях для химических реакций принято стехиометрические коэффициенты исходных веществ записывать со знаком минус, а продуктов реакции — со знаком плюс. В смеси вещества реагируют между собой в строго эквивалентном количестве, что определяется следующими соотношениями:
— 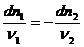
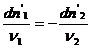
где 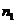
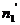
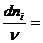
Параметр λ называют химической переменной или пробегом реакции, величина которого зависит от величины числа моль веществ и величины стехиометрического коэффициента. Так, если в химической смеси веществ одновременно может протекать несколько химических реакций, то каждая из них будет характеризоваться своей химической переменной, то есть λ1, λ2, λ3 и т. д.
Ранее было показано, что состояние химически неоднородной системы можно рассчитать с помощью энергии Гиббса по уравнению:
dG =- SdT + VdP -ν1 d 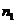
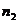
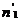
Подставив в это уравнение значение химической переменной,
При постоянных Р и Т уравнение сведется к виду
dG =(∑ μν ) d λ , где
Из уравнения находится первая производная от энергии Гиббса по химической переменной при Р, Т=со nst :
Это выражение определяет изменение энергии Гиббса в зависимости от глубины протекания реакции, то есть от изменения числа прореагировавших эквивалентов веществ, если реакция проходит на некотором удалении от равновесия. Это выражение показывает, что: 1) сме c ь веществ обладает разностью химических потенциалов не равной нулю∑ νμ ≠0,
2) смесь идет к равновесию термодинамически обратимо,
3)д вижущей силой химической реакции является разность∑ νμ ≠0 . По достижении равновесия энергия Гиббса не меняется и тогда производная будет равна нулю:
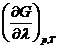
На основе этого равенства находим, что: ∑ νμ =0.
Это равенство показывает, что равновесие в химической системе характеризуется тем, что алгебраическая сумма химических потенциалов, умноженная на стехиометрические коэффициенты, равна нулю. Это есть общее условие равновесия в смеси химических веществ, между которыми проходят реакции.
Для термодинамически необратимого процесса, протекающего самопроизвольно, величина производной будет меньше нуля:
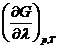
Это неравенство безусловно выполняется для изолированной системы, в которой могут протекать только самопроизвольные процессы. Аналогично можно получить критерии, определяющие состояние смеси веществ в изолированной системе при постоянных объеме и температуре, то есть:
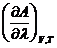
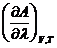
I. По свойствам энергии образования химических соединений при любой температуре: от свободной энергии образования берем свободную энергию образования из справочника.
II. Приближенный метод.
∆ G =∆ H + Т∆ S В стандартных условиях: ∆ G °т= ∆ H °т — Т∆ S °т ,
III . По уравнению Гиббса-Гельмгольца
∆ G 0 =∆ H 0 + Т
С 0 р=∆ H 0 -∆аТ lnT -∆ b Т 2 /2 +∆сТ 3 /6+ JT , J -константа интегрирования. Она не должна быть не очень маленькой, не очень большой.
∆ G 0 т =А+ВТ,где А и В-коэффициенты, которые находятся суммированием групповых составляющих, на которое разбивается данное химическое соединение + поправки на образование колец и поправки на разветвление в основной структуре молекулы. Для улучшения или точности метода коэффициенты А и В дают для 2-х интервалов температут 300-600, 600-1500.
Уравнение изобары химической реакции
Термодинамические условия равновесия. Стандартная энергия Гиббса образования вещества, стандартная энергия Гиббса биологического окисления вещества. Стандартная энергия Гиббса реакции. Примеры экзергонических и эндергонических процессов, протекающих в организме. Принцип энергетического сопряжения.

Под стандартной энергией Гиббса биологического окисления ΔG°, понимают изменение энергии Гиббса при реакции биологического окисления 1 моль вещества, находящегося в стандартном состоянии
Под стандартной энергией Гиббса образования ΔG°, понимают изменение энергии Гиббса при реакции образования 1 моль вещества, находящегося в стандартном состоянии
Химическое равновесие. Обратимые и необратимые по направлению реакции. Термодинамические условия равновесия в изолированных и закрытых системах. Константа химического равновесия.
Обратимые по направлению химические реакции – реакции, которые при данных внешних условиях могут самопроизвольно протекать как в прямом, так и в обратном направлениях
Константа химического равновесия – для обратимой реакции общего вида aA + bB ó pP + qQ при постоянных внешних условиях в равновесии отношение произведений концентраций продуктов к произведению концентрации реагентов есть величина постоянная, не зависящая от химического состава системы
Kc = [A] a [B] b = const при p, T = const
Уравнение изотермы химической реакции:
Уравнение изобары химической реакции
Прогнозирование смещения химического равновесия. С помощью уравнения изотермы можно рассчитать G реакции при заданном значении Πc, если известна Kc реакции. И наоборот, если известна G реакции при заданном Πc, то можно рассчитать Kc.
Гомеостаз — относительное динамическое постоянство внутренней среды (крови, лимфы, тканевой жидкости) и устойчивость основных физиологических функций (кровообращения, дыхания, терморегуляции, обмена веществ и т.д.) организма человека и животных. Регуляторные механизмы, поддерживающие физиологическое состояние или свойства клеток, органов и систем целостного организма на оптимальном уровне, называются гомеостатическими.
Учение о гомеостазе — это учение о жизненных процессах, имеющих только одну цель: поддержание постоянства условий жизни во внутренней среде, как необходимый элемент свободной и независимой жизни.
Основная функция буферных систем предотвращение значительных сдвигов рН путём взаимодействия буфера как с кислотой, так и с основанием. Действие буферных систем в организме направлено преимущественно на нейтрализацию образующихся кислот.
В организме одновременно существует несколько различных буферных систем. В функциональном плане их можно разделить на бикарбонатную и небикарбонатную. Небикарбонатная буферная система включает гемоглобин, различные белки и фосфаты. Она наиболее активно действует в крови и внутри клеток.
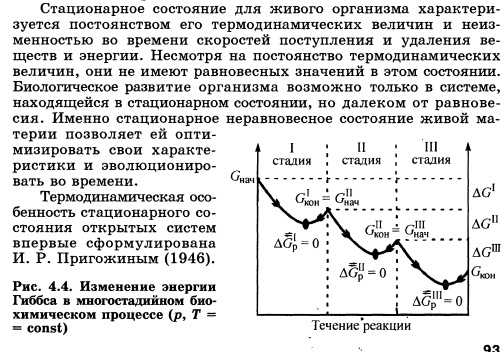
Организм можно определить как физико-химическую систему, существующую в окружающей среде в стационарном состоянии. Именно эта способность живых систем сохранять стационарное состояние в условиях непрерывно меняющейся среды и обусловливает их выживание. Для обеспечения стационарного состояния у всех организмов — от морфологически самых простых до наиболее сложных — выработались разнообразные анатомические, физиологические и поведенческие приспособления, служащие одной цели — сохранению постоянства внутренней среды.
Организм взрослого человека характеризуется относительным постоянством многих параметров, в том числе и биохимических показателей, представляющих собой определенные концентрации биологически активных веществ. Однако такое состояние нельзя назвать равновесием, так как оно не приложимо к открытым системам.
Организм человека, как живая система, постоянно обменивается с окружающей средой различными веществами: потребляет питательные вещества и выделяет продукты их окисления и распада. Следовательно, для организма характерно стационарное состояние, определяемое как постоянство параметров при постоянной скорости обмена системы с окружающей средой веществом и энергией. В первом приближении стационарное состояние можно рассматривать как ряд родственных состояний, связанных между собой процессами релаксации.
Для поддержания стационарного состояния организму взрослого человека требуется поступление извне около 3000 ккал в сутки. Рациональное питание предусматривает сбалансированное питание при соотношении белков, жиров и углеводов по массе 1:1:4.
http://igrudcinov.narod.ru/33-40.htm
http://lektsii.org/14-29468.html