Уравнение изобары вант гоффа в интегральной форме
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
1.7 ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Как было показано выше, протекание самопроизвольного процесса в термодинамической системе сопровождается уменьшением свободной энергии системы (dG 2 Y > 0. Таким образом, условием термодинамического равновесия в закрытой системе является минимальное значение соответствующего термодинамического потенциала :
Изобарно-изотермические (P = const, T = const):
Изохорно-изотермические (V = const, T = const):
Состояние системы с минимальной свободной энергией есть состояние термодинамического равновесия:
Термодинамическим равновесием называется такое термодинамическое состояние системы, которое при постоянстве внешних условий не изменяется во времени, причем эта неизменяемость не обусловлена каким-либо внешним процессом.
Учение о равновесных состояниях – один из разделов термодинамики. Далее мы будем рассматривать частный случай термодинамического равновесного состояния – химическое равновесие. Как известно, многие химические реакции являются обратимыми, т.е. могут одновременно протекать в обоих направлениях – прямом и обратном. Если проводить обратимую реакцию в закрытой системе, то через некоторое время система придет в состояние химического равновесия – концентрации всех реагирующих веществ перестанут изменяться во времени. Необходимо отметить, что достижение системой состояния равновесия не означает прекращения процесса; химическое равновесие является динамическим, т.е. соответствует одновременному протеканию процесса в противоположных направлениях с одинаковой скоростью. Химическое равновесие является подвижным – всякое бесконечно малое внешнее воздействие на равновесную систему вызывает бесконечно малое изменение состояния системы; по прекращении внешнего воздействия система возвращается в исходное состояние. Ещё одним важным свойством химического равновесия является то, что система может самопроизвольно прийти в состояние равновесия с двух противоположных сторон. Иначе говоря, любое состояние, смежное с равновесным, является менее устойчивым, и переход в него из состояния равновесия всегда связан с необходимостью затраты работы извне.
Количественной характеристикой химического равновесия является константа равновесия, которая может быть выражена через равновесные концентрации С, парциальные давления P или мольные доли X реагирующих веществ. Для некоторой реакции
соответствующие константы равновесия выражаются следующим образом:
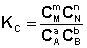
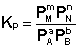
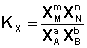
Константа равновесия есть характерная величина для каждой обратимой химической реакции; величина константы равновесия зависит только от природы реагирующих веществ и температуры. Выражение для константы равновесия для элементарной обратимой реакции может быть выведено из кинетических представлений.
Рассмотрим процесс установления равновесия в системе, в которой в начальный момент времени присутствуют только исходные вещества А и В. Скорость прямой реакции V1 в этот момент максимальна, а скорость обратной V2 равна нулю:
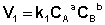
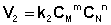
По мере уменьшения концентрации исходных веществ растет концентрация продуктов реакции; соответственно, скорость прямой реакции уменьшается, скорость обратной реакции увеличивается. Очевидно, что через некоторое время скорости прямой и обратной реакции сравняются, после чего концентрации реагирующих веществ перестанут изменяться, т.е. установится химическое равновесие.
Приняв, что V1 = V2, можно записать:
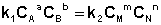
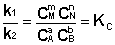
Т.о., константа равновесия есть отношение констант скорости прямой и обратной реакции. Отсюда вытекает физический смысл константы равновесия: она показывает, во сколько раз скорость прямой реакции больше скорости обратной при данной температуре и концентрациях всех реагирующих веществ, равных 1 моль/л.
Теперь рассмотрим (с некоторыми упрощениями) более строгий термодинамический вывод выражения для константы равновесия. Для этого необходимо ввести понятие химический потенциал . Очевидно, что величина свободной энергии системы будет зависеть как от внешних условий (T, P или V), так и от природы и количества веществ, составляющих систему. В случае, если состав системы изменяется во времени (т.е. в системе протекает химическая реакция), необходимо учесть влияние изменения состава на величину свободной энергии системы. Введем в некоторую систему бесконечно малое количество dni молей i-го компонента; это вызовет бесконечно малое изменение термодинамического потенциала системы. Отношение бесконечно малого изменения величины свободной энергии системы к бесконечно малому количеству компонента, внесенному в систему, есть химический потенциал μ i данного компонента в системе:
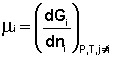
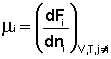
Химический потенциал компонента связан с его парциальным давлением или концентрацией следующими соотношениями:
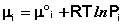
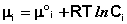
Здесь μ°i – стандартный химический потенциал компонента (Pi = 1 атм., Сi = 1 моль/л.). Очевидно, что изменение свободной энергии системы можно связать с изменением состава системы следующим образом:
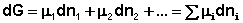
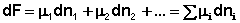
Поскольку условием равновесия является минимум свободной энергии системы (dG = 0, dF = 0), можно записать:
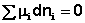
В закрытой системе изменение числа молей одного компонента сопровождается эквивалентным изменением числа молей остальных компонентов; т.е., для приведенной выше химической реакции имеет место соотношение:
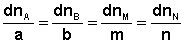
Отсюда можно получить следующее условие химического равновесия в закрытой системе:
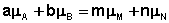
В общем виде условие химического равновесия можно записать следующим образом:
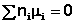
Выражение (I.94) носит название уравнения Гиббса – Дюгема. Подставив в него зависимость химического потенциала от концентрации, получаем:
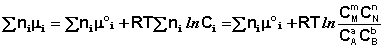
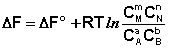
Для изобарно-изотермического процесса аналогичным образом можно получить:
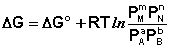
Полученные нами выражения I.96 – I.97 есть изотерма химической реакции . Если система находится в состоянии химического равновесия, то изменение термодинамического потенциала равно нулю; получаем:
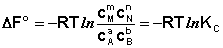
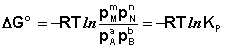
Здесь сi и рi – равновесные концентрации и парциальные давления исходных веществ и продуктов реакции (в отличие от неравновесных Сi и Рi в уравнениях I.96 – I.97).
Поскольку для каждой химической реакции стандартное изменение термодинамического потенциала ΔF° и ΔG° есть строго определенная величина, то произведение равновесных парциальных давлений (концентраций), возведенных в степень, равную стехиометрическому коэффициенту при данном веществе в уравнении химической реакции (стехиометрические коэффициенты при исходных веществах принято считать отрицательными) есть некоторая константа, называемая константой равновесия. Уравнения (I.98, I.99) показывают связь константы равновесия со стандартным изменением свободной энергии в ходе реакции. Уравнение изотермы химической реакции связывает величины реальных концентраций (давлений) реагентов в системе, стандартного изменения термодинамического потенциала в ходе реакции и изменения термодинамического потенциала при переходе из данного состояния системы в равновесное. Знак ΔG (ΔF) определяет возможность самопроизвольного протекания процесса в системе. При этом ΔG° (ΔF°) равно изменению свободной энергии системы при переходе из стандартного состояния (Pi = 1 атм., Сi = 1 моль/л) в равновесное. Уравнение изотермы химической реакции позволяет рассчитать величину ΔG (ΔF) при переходе из любого состояния системы в равновесное, т.е. ответить на вопрос, будет ли химическая реакция протекать самопроизвольно при данных концентрациях Сi (давлениях Рi) реагентов:
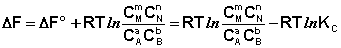
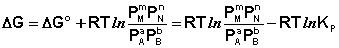
Если изменение термодинамического потенциала меньше нуля, процесс в данных условиях будет протекать самопроизвольно.
1.7.1 Влияние внешних условий на химическое равновесие
При постоянстве внешних условий система может находиться в состоянии равновесия сколь угодно долго. Если изменить эти условия (т.е. оказать на систему какое-либо внешнее воздействие), равновесие нарушается; в системе возникает самопроизвольный процесс, который продолжается до тех пор, пока система опять не достигнет состояния равновесия (уже при новых условиях). Рассмотрим, как влияют на положение равновесия некоторые факторы.
1.7.2 Влияние давления и концентрации
Рассмотрим несколько возможных случаев смещения равновесия.
1. В систему добавлено исходное вещество. В этом случае
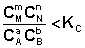
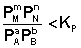
По уравнению изотермы химической реакции (I.100 – I.101) получаем: ΔF 0; ΔG > 0. Химическое равновесие будет смещено влево (в сторону расходования продуктов реакции и образования исходных веществ).
3. Изменено общее давление (для реакций в газовой фазе).
Парциальные давления всех компонентов Рi в этом случае изменяются в одинаковой степени; направление смещения равновесия будет определяться суммой стехиометрических коэффициентов Δn.
Учитывая, что парциальное давление газа в смеси равно общему давлению, умноженному на мольную долю компонента в смеси (Рi = РХi), изотерму реакции можно переписать в следующем виде (здесь Δn = Σ(ni) прод – Σ(ni) исх):
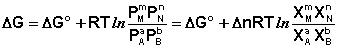
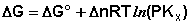
Примем, что Р2 > Р1. В этом случае, если Δn > 0 (реакция идет с увеличением числа молей газообразных веществ), то ΔG > 0; равновесие смещается влево. Если реакция идет с уменьшением числа молей газообразных веществ (Δn изобару Вант-Гоффа :
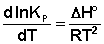
Рассуждая аналогичным образом, для процесса, проходящего в изохорных условиях, можно получить изохору Вант-Гоффа :
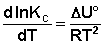
Изобара и изохора Вант-Гоффа связывают изменение константы химического равновесия с тепловым эффектом реакции в изобарных и изохорных условиях соответственно. Очевидно, что чем больше по абсолютной величине тепловой эффект химической реакции, тем сильнее влияет температура на величину константы равновесия. Если реакция не сопровождается тепловым эффектом, то константа равновесия не зависит от температуры.
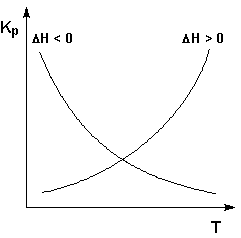
Экзотермические реакции: ΔH° 0 (ΔU° > 0). В этом случае температурный коэффициент логарифма константы равновесия положителен; повышение температуры увеличивает величину константы равновесия (смещает равновесие вправо).
Графики зависимостей константы равновесия от температуры для экзотермических и эндотермических реакций приведены на рис. I.4.
Рис. 1.4 Зависимость константы равновесия от температуры.
Действие рассмотренных нами факторов (давления, концентрации и температуры), равно как и любых других, на систему, находящуюся в состоянии равновесия, обобщает принцип смещения равновесия , называемый также принципом Ле Шателье – Брауна :
Если на систему, находящуюся в состоянии истинного равновесия, оказывается внешнее воздействие, то в системе возникает самопроизвольный процесс, компенсирующий данное воздействие.
Принцип Ле Шателье – Брауна является одним из следствий второго начала термодинамики и применим к любым макроскопическим системам, находящимся в состоянии истинного равновесия.
Copyright © С. И. Левченков, 1996 — 2005.
ЛЕКЦИЯ 03. 3. 1 Закон действующих масс. Константа химического равновесия
| Название | 3. 1 Закон действующих масс. Константа химического равновесия |
| Анкор | ЛЕКЦИЯ 03.doc |
| Дата | 04.03.2018 |
| Размер | 345 Kb. |
| Формат файла |  |
| Имя файла | ЛЕКЦИЯ 03.doc |
| Тип | Закон #16226 |
| Подборка по базе: 1. Основы трудового законодательства в охране труда в Республике, Понятие и признаки уголовного наказания по современному уголовно, Реферат на тему Основные законы древней греции.docx, Основы законодательства Пр №1.docx, Федеральный закон о физической культуре и спорте в Российской Фе, Важнейшие экологические законы.docx, Т-1 Основные требования законодательства Российской Федерации об, ВПП Российское законодательство.doc, Обр сила закона.doc, Лекция Законы распределения.doc Термодинамика химического равновесия. Константа химического равновесия. Закон действующих масс. Принцип Ле-Шателье. Изотерма химической реакции. Равновесие в гетерогенных реакциях. Влияние температуры на химическое равновесие. Уравнения изобары и изохоры химической реакции. Cуществуют реакции, протекающие в двух противоположных направлениях, которые называются обратимыми Н2 газ + I2 газ С течением времени скорость (V) прямой реакции, которая пропорциональна произведению концентраций исходных веществ, будет уменьшаться, так как уменьшаются концентрации исходных веществ (Н2 и I2), а скорость обратной реакции, которая пропорциональна концентрации НI в квадрате, увеличивается, так как увеличивается концентрация НI. Наконец, наступит такой момент, когда Vпрямой = Vобратной, т. е. наступает состояние химического равновесия. Устойчивые равновесия (в том числе и химические) характеризуются следующими общими признаками: 1. Неизменностью равновесного состояния системы при сохранении внешних условий. 2. Подвижностью равновесия 3. Динамическим характером равновесия, т.е. установлением и сохранением его вследствие равенства скоростей прямого и обратного процессов. 4. Возможностью подхода к состоянию равновесия с двух противоположных сторон (т.е. вводя только исходные вещества, либо только продукты реакции). 5. Минимальным значением G (или F или соответствующим экстремальным значением другой характеристической функции при иных путях проведения процесса). Можно вывести конкретные условия равновесия, одним из которых является закон действующих масс (закон действия масс), который был выведен кинетическим способом Гульдбергом и Вааге в 1867 г. (кинетический метод менее строгий, чем термодинамический). Кинетический вывод закона действующих масс. Рассмотрим обратимую реакцию: Н2 газ + I2 газ Для прямой реакции при постоянной температуре скорость реакции равна: Vпрямой = k1 Для обратной реакции скорость равна: Это математическая форма записи так называемого основного постулата химической кинетики. Здесь k1 и k2 – константы скорости прямой и обратной реакции. При равновесии: Vпрямой = Vобратной, т.е . откуда где Здесь kс – константа равновесия, выраженная через равновесные концентрации (ее иногда называют классической константой равновесия или концентрационной константой равновесия). Это и есть математическое выражение закона действующих масс для рассмотренной реакции, который формулируется следующим образом: отношение произведения равновесных концентраций (или парциальных давлений) продуктов реакции, взятых в степенях, равных их стехиометрическим коэффициентам, к аналогичному произведению для исходных веществ при данной температуре есть величина постоянная для данной реакции. Химические реакции обратимы и могут протекать как в прямом так и в обратном направлении. В случае реальных систем равновесные концентрации заменяют на равновесные активности (аi) и получают термодинамическую константу химического равновесия:
где i – стехиометрические коэффициенты уравнения реакции. Величины Константы химического равновесия, выраженные через равновесные парциальные давления рi или равновесные фугитивности fi участников реакции, имеют вид:
Один из важных выводов из закона действия масс является взаимосвязь парциальных давлений (или концентраций) всех веществ, участвующих в реакции. В условиях равновесия парциальные давления (или концентрации) всех веществ, участвующих в реакции, связаны между собой. Нельзя изменить парциальное давление (или концентрации) ни одного из них, без изменения парциальных давлений (или концентраций) всех остальных веществ, участвующих в реакции, чтобы сохранилось прежнее численное значение константы равновесия при данных условиях. Пример 3.1 Процесс получения хлора окислением хлористого водорода протекает по уравнению:
При смешении 1 моль HCl с 0,48 моль O2 образуется 0,402 моль Cl2. В системе P = 1 атм (1,013*10 5 Па), T =659 K. Найти значение KP. Решение. На образование 0.402 моль Cl2 расходуется 0.804 моль HCl и 0,201 моль O2. При установлении в системе равновесия имеем: Найдем равновесные парциальные давления участников реакции: Рассчитаем константу равновесия реакции:
Рассмотрим реакцию: N2 газ + 3 Н2 газ Но отношения При этом принято, что i 0 – для продуктов реакции, i 0 – для исходных веществ. Величина Для любой химической реакции:
где Можно показать, что если i = сonst (т.е. если состав системы не меняется), то после интегрирования уравнения (1) получается (i 0 – для продуктов, i 0 – для исходных веществ). Для одного пробега реакции, т.е. в случае, когда ξ = 1 (когда прореагировали вещества в количествах, равных их стехиометрическим коэффициентам: ni = i), в условиях постоянного состава системы (в условиях бесконечно большого количества всех компонентов, когда химический потенциал i = сonst) изменение энергии Гиббса равно: Проанализируем последнее выражение.
В этом случае реакция может протекать самопроизвольно слева направо при постоянных температуре и давлении.
В этом случае реакция может протекать самопроизвольно справа налево при постоянных температуре и давлении.
Система находится в состоянии равновесия. Условия (2–4) – условия направленности и равновесия процессов для любой химической реакции. Стандартные условия протекания реакции. В термодинамике под стандартными условиями понимают, что начальные активности всех компонентов ai равны единице, т.е. все ai = 1 (в случае идеальных газов это будет, когда все рi = 1 атм), причем начальные количества веществ будут настолько велики (бесконечно большие), что их изменение в результате протекания 1 пробега химической реакции не скажется на изменении состава исходной смеси, т.е. на протяжении реакции активности всех компонентов останутся постоянными и равными единице. (i 0 – для продуктов, i 0 – для исходных веществ). При равновесии будем иметь:
G 0 – стандартное изменение энергии Гиббса в результате одного пробега химической реакции, протекающей при описанных выше стандартных условиях, (причем не тогда, когда робщ. = 1 атм, а когда рi всех участников реакции равны 1 атм и постоянны). Уравнение изотермы (или просто изотерма) химической реакции позволяет связать возможное направление химической реакции с исходным составом реагирующих веществ. Уравнение изотермы химической реакции легко получить, используя следующие соотношения: где аi – начальная активность i-ого компонента. Но поэтому В уравнении изотермы химической реакции единицы измерения R = 8,314 Здесь G – изменение энергии Гиббса для одного пробега реакции при заданных температуре и давлении и постоянном составе системы (когда количества всех веществ взяты бесконечно большими и их начальные активности заданы равными ai) G 0 – стандартное изменение энергии Гиббса для одного пробега той же реакции, если начальные активности равны единице. Если задать начальные активности каждого из участников реакции равными их соответствующим равновесным активностям, то система (реакция) будет находиться в состоянии равновесия, поэтому G = 0, и из уравнения изотермы получим: где или (здесь i 0 – для продуктов, i 0 – для исходных веществ). тогда Для процессов, протекающих при постоянных объеме и температуре, можно получить аналогичное выражение для энергии Гельмгольца, подставив вместо ai концентрацию сi: где По уравнению изотермы химической реакции (11) с учетом соотношения (13) можно определить направление протекания химической реакции при заданных начальных концентрациях (парциальных давлениях) участников реакции и, например, при постоянных давлении и температуре. Рассмотрим уравнение изотермы химической реакции в виде:
Может быть три случая: 1) 3) Из анализа уравнения изотермы химической реакции видно, что, меняя начальные концентрации (парциальные давления) веществ, в принципе, можно менять и направление протекания реакции. Иногда в качестве критерия приближенной оценки возможности протекания реакции используют не величину G, а величину G 0 , которую можно рассчитать на основании термодинамических характеристик участников реакции: S 0 T = S 0 298 + С 0 р, 298 ln Если рассматривать обратимую газовую реакцию и считать газы идеальными, то выполняются следующие соотношения: 1) Закон Менделеева–Клапейрона pV = nRT (или piV = niRT).
Отсюда можно получить следующие соотношения, показывающие взаимосвязь между kр и kс
Здесь – изменение числа молей газообразных веществ в результате протекания одного пробега данной реакции. Если парциальные давления компонентов выражены в атмосферах, а концентрации в kр не зависит от давления и концентрации, kс не зависит от концентрации и от давления. 3.5 Равновесие в гетерогенных реакциях. До сих пор речь шла о гомогенных реакциях (протекающих в одной фазе). Рассмотрим гетерогенные реакции, в которых не все вещества находятся в газообразном состоянии. В случае гетерогенных систем, в которых жидкие или твёрдые вещества не образуют растворов друг с другом и с газообразными веществами, химические потенциалы этих конденсированных веществ при постоянной температуре будут постоянными, также как и давление насыщенных паров над каждым из таких веществ в смеси. Поэтому в выражения для констант равновесия входят давления только газообразных веществ. СаОтв. + СО2 газ В случае, если в гетерогенной реакции принимают участие растворы, в выражения для констант равновесия будут входить активности (концентрации) этих веществ. Как отмечалось ранее, химические равновесия являются динамичными и подвижными. При изменении внешних условий может происходить сдвиг равновесияв сторону образования либо продуктов реакции, либо исходных веществ. Впервые принцип смещения равновесия сформулировал А. Ле-Шателье. Принцип Ле–Шателье: если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие смещается в сторону того процесса, который уменьшает это воздействие. Теоретически этот принцип был выдвинут Ф. Брауном и теперь известен, как принцип Ле-Шателье – Брауна. Обычно в качестве внешних факторов, влияющих на состояние равновесия, рассматривают влияние температуры, давления и изменения концентрации реагирующих веществ. Например, с повышением температуры равновесие смещается в сторону эндотермической реакции, протекающей с поглощением теплоты. Уменьшение давления приводит к смещению равновесия в сторону реакции, протекающей с увеличением числа молей газообразных веществ.
3.7 Влияние температуры на константу химического равновесия. Уравнение изобары Вант-Гоффа. Количественно влияние температуры на константу равновесия выражается с помощью уравнения изобары Вант-Гоффа (р = const) или уравнения изохоры Вант-Гоффа (V = const). Для вывода уравнения изобары Вант-Гоффаз из уравнения найдем частную производную от G по Т при р = const: Это получено, исходя из того, что начальная активность веществ не зависит от температуры, тогда: ( Подставляем в уравнение Гиббса-Гемгольца значения G и После преобразований имеем
После преобразований имеем Здесь Н – тепловой эффект реакции при p = const. Уравнение (27)– это уравнение изобары Вант-Гоффа в дифференциальной форме. Это уравнение показывает, как константа равновесия ka зависит от температуры. Аналогичным способом, рассматривая F вместо G в соответствующих уравнениях типа (23) и (24), можно получить выражение для уравнения изохоры Вант-Гоффа в дифференциальной форме. Здесь U – изменение внутренней энергии (т.е. тепловой эффект реакции при V = const). Если рассматривать газофазную реакцию, то для идеальных газов можно записать Рассмотрим случай, когда реакция проводится в стандартном состоянии при р = 1 атм, тогда уравнение (28) примет следующий вид: Рассмотрим, как изменяется kp с изменением температуры. Проанализируем соотношение (29) (здесь H 0 – тепловой эффект соответствующей химической реакции в стандартном состоянии. Возможны три случая. 1) H 0 > 0 – эндотермическая реакция, протекающая с поглощением теплоты. Так как R > 0; T 2 > 0, тогда, 2) H 0 0 = 0; Зависимость kp (или kp) от температуры может иметь следующий вид: 3. H 0 3 0 не зависит от температуры, то (где А – некоторая константа). Возьмем теперь определенный интеграл: Таким образом, зная значения константы равновесия ( Из уравнения (32) видно, что, зная зависимость kp от Т, можно графически определить величину теплового эффекта химической реакции. Надо провести линеаризацию соответствующего уравнения (т.е. осуществить выбор соответствующих координат, чтобы получить прямую линию: y = lnkp; x =
Из графика можно рассчитать величину теплового эффекта реакции: Реальные растворы. Метод активностей. Определение активности по давлению пара (стр. 3 )
где В химической термодинамике закон действующих масс связывает между собой равновесные активности исходных веществ и продуктов реакции, согласно соотношению: Где ai — активность веществ. Вместо активности могут быть использованы концентрация (для реакции в идеальном растворе), парциальные давления (реакция в смеси идеальных газов), фугитивность (реакция в смеси реальных газов); νi — стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов — положительным); Ka — константа химического равновесия. Индекс «a» здесь означает использование величины активности в формуле. На практике в расчётах, не требующих особой точности, значения активности обычно заменяются на соответствующие значения концентраций (для реакций в растворах) либо парциальных давлений (для реакций между газами). Константу равновесия при этом обозначают Kc или Kp соответственно. Впервые закон действующих масс был выведен из кинетических представлений Гульдбергом и Вааге, а термодинамический вывод его дан Вант-Гоффом в 1885 году. 32. Изотерма химической реакции Вант-Гоффа. Изменение
33. Различные константы равновесия и связь между ними. Химическое равновесие в идеальных и реальных системах. Химическим равновесием называется такое состояние обратимой химической реакции при котором с течением времени не происходит изменения концентраций реагирующих веществ в реакционной смеси. Состояние химического равновесия характеризуется константой химического равновесия:
где Ci – концентрации компонентов в равновесной идеальной смеси. Константа равновесия может быть выражена также через равновесные мольные доли Xi компонентов:
Для реакций, протекающих в газовой фазе, константу равновесия удобно выражать через равновесные парциальные давления Pi компонентов:
Для идеальных газов Pi = CiRT и Pi = XiP, где P – общее давление, поэтому KP, KC и KX связаны следующим соотношением: KP = KC (RT) c+d–a–b = KXP c+d–a–b. Константа равновесия связана с В случае идеальных р-ров вместо активностей компонентов используют их молярные доли xi. где k1 и k-1 — константы скорости прямой и обратной р-ций. 34. Зависимость константы равновесия от температуры. Уравнение изобары (изохоры) Вант-Гоффа в дифференциальной и интегральной форме. Принцип Ле Шателье. Согласно принципу Ле Шателье, если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится так, чтобы уменьшить эффект внешнего воздействия. Так, повышение давления сдвигает равновесие в сторону уменьшения количества молекул газа. Добавление в равновесную смесь какого-либо компонента реакции сдвигает равновесие в сторону уменьшения количества этого компонента. Повышение (или понижение) температуры сдвигает равновесие в сторону реакции, протекающей с поглощением (выделением) теплоты. Количественно зависимость константы равновесия от температуры описывается уравнением изобары химической реакции (изобары Вант-Гоффа) и изохоры химической реакции (изохоры Вант-Гоффа)
Интегрирование уравнения в предположении, что где C – константа интегрирования. Таким образом, зависимость ln KP от 1/Т должна быть линейной, а наклон прямой равен – Интегрирование в пределах K1, K2, и T1, T2 дает: По этому уравнению, зная константы равновесия при двух разных температурах, можно рассчитать 35. Движение ионов в растворе. Удельная и эквивалентная электропроводность. Электропроводность растворов электролитов Электропроводность
где Удельной электропроводностью Эквивалентной электропроводностью
где V = 1/C — разведение (или разбавление) раствора, т. е. объем, в котором содержится 1 г-экв растворенного вещества, а C — эквивалентная концентрация (нормальность) раствора. В системе СИ эквивалентная электропроводность выражается в Ом-1. м2. кг-кв-1. Эквивалентная электропроводность В разбавленных растворах сильных электролитов выполняется эмпирический закон Кольрауша (закон квадратного корня):
где источники: http://topuch.ru/3-1-zakon-dejstvuyushih-mass-konstanta-himicheskogo-ravnovesiy/index.html http://pandia.ru/text/80/175/18093-3.php |

 2 НIгаз
2 НIгаз
 ,
, или
или  ,
, .
. ,
, положительны для продуктов реакции и отрицательны для исходных веществ.
положительны для продуктов реакции и отрицательны для исходных веществ. ,
, .
. .
.




 будут одинаковыми для всех участников реакции.
будут одинаковыми для всех участников реакции. =
=  =
=  =
=  = 0,2
= 0,2 называется степенью полноты протекания реакции, химической переменной или числом пробегов реакции.
называется степенью полноты протекания реакции, химической переменной или числом пробегов реакции. , (1)
, (1) (ξ– химическая переменная).
(ξ– химическая переменная).
 или
или
 (2)
(2) (3)
(3) (4)
(4) (5)
(5) , (6)
, (6)
 (8)
(8) .
. , [G] = [G 0 ] = Дж.
, [G] = [G 0 ] = Дж. (9)
(9) (10)
(10) (11)
(11)
 (13)
(13) (14)
(14) (15)
(15) , (16)
, (16) . Следовательно G 0. В этом случае термодинамически возможно самопроизвольное протекание обратной реакции.
. Следовательно G 0. В этом случае термодинамически возможно самопроизвольное протекание обратной реакции. . Следовательно G = 0. Данная система будет находиться в состоянии химического равновесия.
. Следовательно G = 0. Данная система будет находиться в состоянии химического равновесия. . (18)
. (18) , где
, где  , (19)
, (19) , но т.к. pi = ciRT, то получим:
, но т.к. pi = ciRT, то получим: .
. (20)
(20) , то в соотношение, (21) связывающее kр и kс, вместо R следует ставить величину R = 0,082
, то в соотношение, (21) связывающее kр и kс, вместо R следует ставить величину R = 0,082  .
.
 (
( )
) (23)
(23) (24)
(24) ) то
) то  . (25)
. (25)
 из (23) и (25) соответственно
из (23) и (25) соответственно . (26)
. (26) (27)
(27)
 и тогда
и тогда (28)
(28) (29)
(29) . Известно, что если производная функции (у)
. Известно, что если производная функции (у)  , то у – возрастающая функция (т.е. с возрастанием аргумента ее значение увеличивается, а с уменьшением – уменьшается), тогда при увеличении температуры (dT > 0) величина lnkp, а, следовательно, и kp, возрастает, а при уменьшении температуры kp уменьшается.
, то у – возрастающая функция (т.е. с возрастанием аргумента ее значение увеличивается, а с уменьшением – уменьшается), тогда при увеличении температуры (dT > 0) величина lnkp, а, следовательно, и kp, возрастает, а при уменьшении температуры kp уменьшается. . Функция lnkp (а также и kp) не зависит от температуры, то есть kp – постоянная при Т сonst.
. Функция lnkp (а также и kp) не зависит от температуры, то есть kp – постоянная при Т сonst.
 (32)
(32) (33)
(33) или
или (34)
(34) и
и  ) при двух температурах (Т1 и Т2), можно рассчитать величину теплового эффекта реакции H 0 или же, зная величину H 0 и значение константы равновесия при какой-либо температуре Т1, можно определить kp при другой температуре Т2.
) при двух температурах (Т1 и Т2), можно рассчитать величину теплового эффекта реакции H 0 или же, зная величину H 0 и значение константы равновесия при какой-либо температуре Т1, можно определить kp при другой температуре Т2. ).
).
 и
и  .
.


 и
и — хим. потенциалы соотв. исходных реагентов и продуктов.
— хим. потенциалы соотв. исходных реагентов и продуктов. 
 rG или
rG или  .
. .
. ,
, .
. .
.




 .
.



 («Каппа») раствора — величина, обратная его сопротивлению R, имеет размерность Ом-1. Для проводника постоянного сечения
(«Каппа») раствора — величина, обратная его сопротивлению R, имеет размерность Ом-1. Для проводника постоянного сечения ,
, — удельное сопротивление; S — площадь сечения проводника; l — длина проводника;
— удельное сопротивление; S — площадь сечения проводника; l — длина проводника;  («лямбда») называется электропроводность такого объема раствора, в котором содержится 1 г-экв растворенного вещества; при условии, что электроды находятся на расстоянии 1 см друг от друга, она выражается в Ом-1. см2. г-экв-1.
(«лямбда») называется электропроводность такого объема раствора, в котором содержится 1 г-экв растворенного вещества; при условии, что электроды находятся на расстоянии 1 см друг от друга, она выражается в Ом-1. см2. г-экв-1. ,
, ,
,