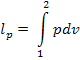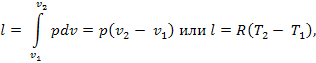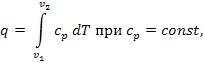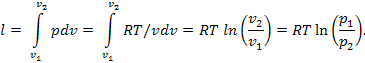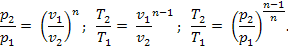Energy
education
сайт для тех, кто хочет изучать энергетику
Термодинамика и тепломассообмен
Идеальный газ
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
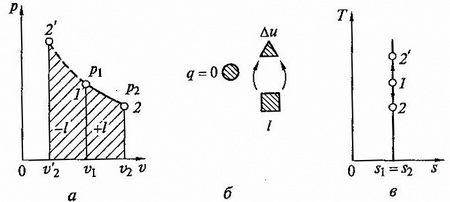
4. Процессы изменения состояния идеальных газов
К основным термодинамическим процессам относят следующие четыре процесса:
- изохорный – при постоянном объеме ($v = const$);
- изобарный – при постоянном давлении ($р = const$);
- изотермический – при постоянной температуре ($Т = const$);
- адиабатный – без теплообмена с внешней средой ($\mathrm
q = 0$).
В реальных условиях указанные ограничения практически не выполняются. В связи с этим в технической термодинамике существует понятие политропного процесса как общего случая термодинамического процесса. Предполагается, что политропный процесс обратим и теплоемкость рабочего тела (идеального газа) $с_n$ в ходе данного процесса не изменяется ($c_n=const$). Уравнение политропного процесса имеет вид:
где $n=\frac
Изобарный процесс – термодинамический процесс, происходящий в системе при постоянном давлении. Параметры состояния идеального газа на изобаре связаны соотношением:
Отсюда следует, что чем выше температура газа, тем больше его удельный объем (т.е. тем меньше плотность). При этом величина v на изобаре при повышении температуры растет тем быстрее, чем меньше давление.
Работа расширения системы в изобарном процессе определяется следующим образом:
Для идеального газа работа расширения системы в изобарном процессе может быть представлена также в следующем виде:
Количество теплоты, сообщаемой системе при нагреве (или отдаваемой системой при охлаждении) в изобарном процессе, определяется следующим образом:
$$\mathrm
Изменение энтропии в изобарном процессе, т.е. разность энтропий, соответствующих состояниям 1 и 2, определяется из соотношения:
Изотермический процесс – процесс изменения состояния термодинамической системы при постоянной температуре.
Для идеального газа давления и объемы в любых точках на изотерме связаны уравнением Бойля—Мариотта, т.е. зависимость объема от давления на изотерме для идеального газа имеет характер гиперболы:
Работа расширения системы в изотермическом процессе между точками изотермы 1 и 2 определяется с помощью общего соотношения:
Количество теплоты , подводимой к системе (или отдаваемой системой) в изотермическом процессе, определяется из известного соотношения:
Количество работы, совершаемой идеальным газом в изотермическом процессе, равно количеству теплоты, подведенной к этому газу:
Изменение энтропии в изотермическом процессе, т.е. разность энтропий, соответствующих состояниям 1 и 2, вычисляется следующим способом:
Адиабатный процесс – такой термодинамический процесс, в котором к системе не подводится и от системы не отводится теплота. Термодинамическую систему, в которой протекает адиабатный процесс, можно представить себе в виде некоторого объема, ограниченного оболочкой, снабженной идеальной теплоизоляцией, абсолютно не пропускающей теплоту. В реальных условиях процесс является адиабатным в тех случаях, когда система снабжена хорошей теплоизоляцией или когда процесс расширения (сжатия) газа происходит настолько быстро, что не успевает произойти скольконибудь заметный теплообмен газа с окружающей средой.
Поскольку для обратимого процесса $\mathrm
Для любого состояния системы в изоэнтропном процессе справедливо соотношение Пуассона:
Если показатель изоэнтропы $k$ изменяется с изменением состояния системы и известен характер зависимости $k$ на изоэнтропе, то для расчета величины $p_2$ по известным $p_1$, $v_1$ и $v_2$ следует вычислить интеграл, стоящий в правой части по известным значениям $k$.
Для идеального газа показатель изоэнтропы $k$ можно определить:
Так как для идеального газа $c_p=c_v+µR$, тогда:
Как известно, теплоемкости идеального газа слабо изменяются с температурой, поэтому и величину $k$ с высокой степенью точности можно считать практически не зависящей от температуры. Известно, что мольная изохорная теплоемкость $μс_v$ идеального газа равна примерно $13$ кДж/(кмоль·К) для одноатомного идеального газа, $21$ кДж/(кмоль·К) для двухатомного и $29$ кДж/(кмоль·К) для трех- и многоатомного газа. Поскольку $µR≈8.3$ кДж/(кмоль·К), то получаем следующие примерные значения показателя изоэнтропы $k$ идеального газа: одноатомный $k=1.67$, двухатомный $k=1.40$, трех- и многоатомный $k=1.29$. Для воздуха показатель изоэнтропы в идеально-газовом состоянии равен примерно $1.40$.
Для изоэнтропного процесса в идеальном газе можно получить соотношения, связывающие между собой значения $p$, $Т$ и $v$:
Работа расширения системы в изоэнтропном процессе определяется следующим образом:
Таким образом, в адиабатном процессе работа расширения системы совершается за счет убыли внутренней энергии системы. Это и понятно – ведь в адиабатном процессе к системе нет притока теплоты извне и единственный источник энергии для совершения работы – внутренняя энергия самой системы.
В случае идеального газа уравнения для расчета работы расширения могут быть представлены также в иной форме:
Следует подчеркнуть, что уравнение выше пригодно для расчета в том случае, если в интервале параметров между точками 1 и 2 показатель изоэнтропы $k$ сохраняется постоянным.
Политропные процессы. Политропными называют термодинамические процессы, удовлетворяющие уравнению:
при произвольном, постоянном для данного процесса значении $n$.
Понятие о политропных процессах было введено в термодинамике по аналогии с понятием об адиабатных процессах. Уравнение политропного процесса по внешнему виду сходно с уравнением адиабаты, однако существенная разница между этими уравнениями состоит в том, что если показатель изоэнтропы (адиабаты) $k$ является в общем случае величиной переменной, то уже само понятие политропного процесса основано на предположении о том, что показатель политропы n является постоянной величиной. В политропном процессе к системе может подводиться (или отводиться от нее) теплота.
Понятие о политропных процессах широко используется главным образом при изучении процессов сжатия и расширения в газовых двигателях, зачастую политропные процессы оказываются удобными для аппроксимации действительных газовых процессов в двигателях. Реальные процессы сжатия в газовых двигателях и компрессорах часто не являются ни адиабатными, ни изотермическими, а занимают промежуточное положение между этими двумя видами процессов. Поэтому обычно встречаемые на практике значения показателя n политропного процесса лежат в интервале от $1$ до $k$.
Если политропный процесс осуществляется в идеальном газе, то нетрудно получить зависимости между начальными и конечными параметрами процесса:
Работа расширения системы в политропном процессе между точками 1 и 2 определяется с помощью уравнения:
Это уравнение можно преобразовать в вид:
Количество теплоты , подводимой к системе (или отводимой от нее) в политропном процессе можно определить с помощью уравнения первого закона термодинамики:
Тогда теплоемкость идеального газа в политропном процессе:
Изменение энтропии системы в политропном процессе, т.е. разность энтропий, соответствующих точкам 1 и 2 на политропе, определяется из соотношения:
Для того чтобы определить значение показателя политропы для того или иного конкретного газового процесса, надо располагать экспериментальными данными для этого процесса.
Администратор сайта: Колосов Михаил
email:
Copyright © 2011-2022. All rights reserved.
Уравнение изоэнтропы для идеального газа
Характеристики основных видов термодинамических процессов идеальных газов при изменениях таких параметров, как температура, объем, давление и производимая газом работа.
Виды процессов. Основными процессами в технической термодинамике, весьма важными и в теоретическом, и в прикладном отношениях, являются:
изохорный – протекающий при постоянном объеме;
изобарный – протекающий при постоянном давлении;
изотермический – протекающий при постоянной температуре;
адиабатный – при котором отсутствует теплообмен с окружающей средой;
политропный – удовлетворяющий уравнению pv n = const.
Первые четыре процесса являются частными случаями политропного процесса.
При исследовании этих процессов определяют уравнение процесса в координатах p, v и T, s,связь между параметрами состояния газа, измерение внутренней энергии, величину внешней работы и количество отведенной теплоты.
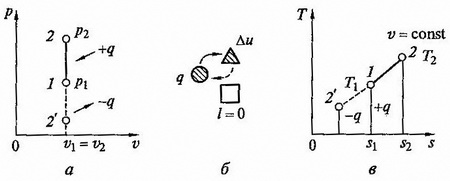
Изохорный процесс. При изохорном процессе выполняется условие dv = 0 или v = const.Из уравнения идеального газа следует, что
т.е. давление газа прямо пропорционально его абсолютной температуре:
рис. 2.4 Изохорный процесс на p — v и T — s диаграммах (а, в) и схема энергобаланса (б)
Графики процесса на p – v и T – s – диаграммах, а также схема энергобаланса представлены на рисунке. Работа расширения в этом процессе равна нулю, так как dv = 0. Количество теплоты, подведенной к рабочему телу в процессе 1 – 2 при cv = const, определяется из соотношения
Так как l = 0, то в соответствии с первым законом термодинамики
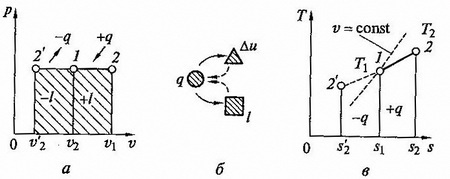
Изобарный процесс. Изобарным называется процесс, происходящий при постоянном давлении. Из уравнения состояния идеального газа при p = const находим
т.е. в изобарном процессе объем газа пропорционален его абсолютной температуре (закон Гей-Люссака). Графики процесса на p — v и T – s – диаграммах, а ттакже схема знергобалланса изображены на рис. 2.5.
рис.2.5. Изобарный процесс на p — v и T — s — диаграммах (а,в) и схема энергобаланса (б)
Количество теплоты сообщаемое газу при нагревании (или отдаваемое им при охлаждении), находим из уравнения
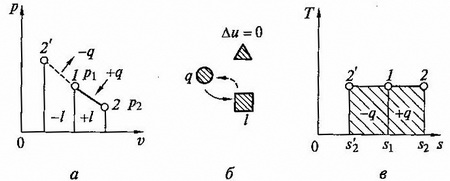
Изотермический процесс. При изотермическом процессе температура постоянная, следовательно, pv = RT = const или p2/p1 = v1/v2, т.е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – падает (закон Бойля – Мариотта).
Графиком изотермического процесса в координатах p, v (рис.2.6,а) является равнобокая гипербола, для которой координатные оси служат асимптомами.
Так как энергия не меняется, то внутренняя энергия идеального газа в данном процессе остается постоянной (Δu = 0) и вся подводимая к газу теплота полностью превращается в работу расширения q = l.
рис. 2.6. Изотермический процесс на p — v и T — s — диаграммах (а,в) и схема энергобаланса (б)
При изотермическом сжатии от газа отводится теплота в количестве, равным затраченной на сжатие работе. Схема энергобаланса и и график изобарного процесса на T – s – диаграмме приведены на рис. 2.6, б,в.
Адиабатный процесс. Адиабатным называется процесс изменения состояния газа, который происходит без теплообмена с окружающей средой. Такой процесс соответствует случаю, когда сосуд или оболочка, вмещающие в себе газ, изолированы в тепловом отношении от окружающей среды. Для данного случая уравнение первого закона термодинамики, поскольку в нем по условию dq = 0, принимает вид
Это означает, что в адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа и что при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через сад и выразим условие du= 0 следующим образом:
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю, т.е. сад = 0. Известно, что
Уравнение кривой адиабатного процесса (адиабаты) в координатах p, v (рис.2.7 а) имеет вид
где k – называется показателем адиабаты (эту величину называют также коэффициентом Пуассона).
т.е. техническая работа адиабатного процесса расширения равна разности энтальпий начала и конца процесса.
Рис.2.7 Адиабптный процесс на p — v и T — s lиаграммах (а, в) и схема энергобаланса (б)
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. На T – s диаграмме (рис.2.7, в) он изображается вертикальной прямой.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате которого всегда выделяется теплота, которая тут же сообщается самому рабочему телу. В этом случае ds > 0, процесс называется реальным адиабатным процессом.
Политропный процесс и его обобщающее значение. Политропным называется процесс, который происходит при постоянной теплоемкости и описывается уравнением
Показатель политропы n может принимать любое численное значение в пределах от -∞ до +∞, но для данного процесса он является величиной постоянной.
Из уравнения (2.13) и уравнения Клайперона нетрудно получить выражения, устанавливающие связь между p v и T в любых двух точках на политропе:
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
1″ :pagination=»pagination» :callback=»loadData» :options=»paginationOptions»>
Уравнение состояния идеального газа. Изопроцессы
Соотношение p = n k T – это формула, связывающая значение давления газа с его температурой и концентрацией молекул на единицу объема.
Они взаимодействуют со стенками сосуда посредствам упругих соударений. Данное выражение можно записать иначе, учитывая параметрические состояния объема V , давления p , температуры T и количества вещества ν . Применим неравенства:
n = N V = ν N А V = m M N A V .
Значением N является количество молекул данного сосуда, N А – постоянной Авогадро, m – массой газа в емкости, М – молярной массой газа. Исходя из этого, формула примет вид:
p V = ν N А k T = m M N А k T .
Произведение постоянной Авогадро N А на постоянную Больцмана k называют универсальной газовой постоянной и обозначают R .
По системе С И имеет значение R = 8 , 31 Д ж / м о л ь · К .
Соотношение p V = ν R T = m M R T получило название уравнения состояния идеального газа.
Один моль газа обозначается p V = R T .
При температуре T н = 273 , 15 К ( 0 ° C ) и давлении ρ н = 1 а т м = 1 , 013 · 10 5 П а говорят о нормальных условиях состояния газа.
Из уравнения видно, что один моль газа при нормальных условиях занимает один и тот же объем, равный v 0 = 0 , 0224 м 3 / м о л ь = 22 , 4 д м 3 / м о л ь . Выражение получило название закона Авогадро.
Если имеется смесь невзаимодействующих газов, то формулу запишем как:
p V = ν 1 + ν 2 + ν 3 + . . . R T ,
где ν 1 , v 2 , v 3 обозначает количество вещества каждого из них.
Еще в ХХ веке Б. Клапейрон получил уравнение, показывающее связь между давлением и температурой:
p V = ν R T = m M R T .
Впоследствии оно было записано Д.И. Менделеевым. Позже его назвали уравнением Клапейрона-Менделеева.
Задолго до получения уравнения состояния идеального газа на основе молекулярно-кинетической теории поведения газов изучались в различных условиях экспериментально. То есть уравнение p V = ν R T = m M R T служит обобщением всех опытных фактов.
Газ принимает участие в процессах с постоянно изменяющимися параметрами состояния: ( p , V и T ).
При протекании процессов медленно, система находится в состоянии, близком к равновесному. Процесс получил название квазистатического.
Соотнеся с происхождением процессов в нашем времени, то его протекания нельзя считать медленными.
Обычное время для разрежения и сжатия газа сотни раз в секунду. Это рассматривается как квазистатический процесс. Они изображаются с помощью диаграммы состояний параметров, где каждая из точек показывает равновесное состояние.
При неизменном одном параметре из ( p , V или T ) процесс принято называть изопроцессом.
http://altinfoyg.ru/nit/td/termodinamicheskie-protsessy-idealnykh-gazov.html
http://zaochnik.com/spravochnik/fizika/molekuljarno-kineticheskaja-teorija/uravnenie-sostojanija-idealnogo-gaza-izoprotsessy/