Уравнение изотермы адсорбции Фрейндлиха и его логарифмическая форма.
Представления, развитые И.Ленгмюром в значительной степени идеализируют и упрощают действительную картину адсорбции. На самом деле поверхность большинства адсорбентов неоднородна, между адсорбционными частицами имеет место взаимодействие, и адсорбция часто не ограничивается образованием мономолекулярного слоя. В этом случае уравнение изотермы адсорбции усложняется. Г.Фрейндлих предположил, что масса адсорбированного газа или растворенного вещества, приходящаяся на единицу массы адсорбента, должна быть пропорциональна равновесному давлению (для газа) или равновесной концентрации (для твердого вещества, адсорбируемого из раствора), возведенной в какую-то степень. Другими словами, чем выше давление и чем больше концентрация растворенного вещества, тем больше вещества будет адсорбироваться на поверхности, однако пропорциональность должна носить не прямой, а экспоненциальный характер. Это положение выражается эмпирическим уравнением:
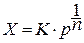
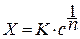
где х- масса адсорбированного вещества, приходящаяся на 1 г адсорбирующего материала,г; р- равновесное давление; с- равновесная концентрация; К и n-константы. Константа К колеблется в широких пределах и зависит от природы адсорбента и адсорбата, а также от температуры. К представляет собой величину адсорбции при давлении или концентрации равных единице. Константа 1/n –адсорбционный показатель, её значения обычно лежат в пределах 0,1-1 и зависят от природы адсорбата и температуры. С повышением температуры константа К уменьшается, а 1/n увеличивается.
Переписывая уравнение в логарифмической форме, получаем
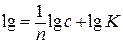
Зависимость lgx от lgC выражается прямой линией, тангенс угла наклона которой равен 1/n, отсекающий на оси ординат отрезок, равный lgK.
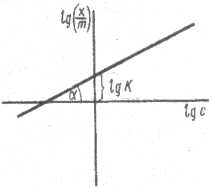 |
Рис 3 График для определения констант уравнении адсорбции
3.2 Теория полимолекулярной адсорбции Поляни
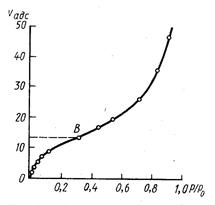
Если адсорбция протекает с образованием полимолекулярного адсорбционного слоя, то изотерма адсорбции отличается от ленгмюровской и имеет более сложный вид (рис.4).
Рис 4 Изотерма полимолекулярной адсорбции
Для объяснения и описания S-образных изотерм адсорбции М.Поляни (1915) предложил теорию полимолекулярной адсорбции. В основе этой теории лежали следующие положения.
1. Адсорбция создается чисто физическими силами.
2. На поверхности адсорбента нет активных центров, а адсорбционные силы действуют вблизи от поверхности адсорбента, образуя непрерывное силовое поле.
3. Силовое поле, обусловливающее адсорбцию, действуют на расстояния, которые больше, чем размеры отдельных молекул адсорбата. Иначе говоря, у поверхности адсорбента существует так называемый адсорбционный объем, который заполняется при адсорбции молекулами адсорбата. По природе адсорбционные силы являются силами Ван-дер-Ваальса. Молекулы газа, попадая в адсорбционное поле, притягиваются поверхностью адсорбента. Образуется полимолекулярный слой, плотность которого убывает по мере удаления от поверхности адсорбента (подобно атмосфере воздуха).
4. Притяжение молекулы адсорбата поверхностью адсорбента не зависит от наличия в адсорбционном объеме других молекул, вследствие чего возможна полимолекулярная адсорбция.
5. Адсорбционные силы не зависят от температуры и, следовательно, с изменением температуры адсорбционный объем не изменяется.
Обе рассмотренные теории адсорбции – теория мономолекулярной адсорбции Ленгмюра и теория полимолекулярной адсорбции не могут описать с достаточной полнотой сложного процесса адсорбции.
3.3 Обобщенная теория Брунауэра, Эммета и Теллера (БЭТ)
Делались попытки обобщить представления И.Ленгмюра и М.Поляни и описать изотермы различной формы различной формы с помощью одного уравнения. Такая обобщенная теория была развита С.Брунауэром, П.Эмметом и Е.Теллором (1935…1940) применительно к адсорбции паров. Она получила название БЭТ по первым буквам фамилий авторов. Основные положения этой теории следующие.
1. На поверхности адсорбента имеется определенное число равноценных в энергетическом отношении активных центров.
2. Взаимодействие соседних адсорбционных молекул в первом и последнем слоях отсутствует.
3. Каждая молекула предыдущего слоя представляет собой возможный активный центр для адсорбции следующего адсорбционного слоя.
4. Предполагается, что все молекулы во втором и более далеких слоях ведут себя подобно молекулам жидкости.
Таким образом, адсорбционная фаза может быть представлена как совокупность адсорбционных комплексов – цепей молекул, первая из которых связана с поверхностью адсорбента. Все эти цепи энергетически не взаимодействуют друг с другом. Схема строения адсорбционного слоя по теории БЭТ показана на рисунке 5.
Рис 5 Схема строения адсорбционного слоя по теории БЭТ
С.Брунауэр, П.Эммет и Е.Теллер вывели уравнение:
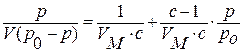
где р0 – давление насыщенного пара; V – объем адсорбированного газа при данном давлении газа р; VM – объем адсорбированного газа в монослое; 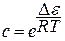
Вопрос 6. Адсорбция на границе твердое тело раствор
Первые исследования по адсорбции из растворов принадлежат русскому ученому Т.Е.Ловицу (1785). Он впервые предложил использовать уголь для очистки спирта от сивушных масел и удаления из воды неприятно пахнущих веществ.
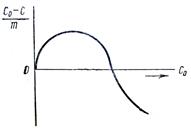
Изотермы адсорбции растворенных веществ из раствора в общем по своему виду аналогичны адсорбционным изотермам для газов, и, как было показано, для разбавленных растворов эти изотермы достаточно хорошо подчиняются уравнению Фрейндлиха или уравнению Ленгмюра, если в них подставить равновесную концентрацию С растворенного вещества в растворе.
Рис 6 Изотерма адсорбции из растворов
Однако адсорбция из растворов по сравнению с газовой адсорбцией оказывается значительно более сложным явлением прежде всего потому, что наряду с адсорбцией растворенного вещества (адсорбата) на поверхности адсорбента может происходить и адсорбция самого растворителя. В результате этого между адсорбатом и растворителем происходит конкуренция за «обладание адсорбентом» и чем хуже адсорбируется растворитель, тем лучше адсорбируется растворенное вещество из раствора. Поэтому различного рода искажения обычной изотермы адсорбции происходят довольно часто.
Советский физико-химик П.А.Ребиндер (1898-1972) сформулировал правило выравнивания полярностей: на полярных адсорбентах лучше адсорбируются полярные адсорбаты из малополярных растворителей; на неполярных адсорбентах –- неполярные адсорбаты из полярных растворителей.
Для системы адсорбат – адсорбент влияние природы растворителя на адсорбцию может быть сформулировано в виде правила: чем лучше в данном растворителе растворяется данный адсорбат, тем он лучше адсорбируется; чем хуже растворяется — тем лучше из него адсорбируется.
Адсорбция вещества из раствора идет медленнее адсорбции газа, так как уменьшение концентрации в граничном слое может восполняться только путем диффузии растворенного вещества в поры адсорбента, что осуществляется довольно медленно. Для ускорения установления адсорбционного равновесия часто применяют перемешивание системы.
На адсорбцию влияет также способность растворителя растворять адсорбент. Чем лучше растворитель растворяет адсорбент, тем хуже идет адсорбция из раствора. С повышением температуры адсорбция обычно уменьшается, однако не так сильно, как адсорбция газов, но иногда, например , когда температурный коэффициент растворимости вещества отрицательный, адсорбция увеличивается.
Массу а вещества, адсорбированного одним килограммом адсорбента из раствора, обычно вычисляют по уравнению:
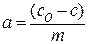
Где С0 и С – начальная и равновесная концентрация адсорбата соответственно, кмоль/м 3 ; V – объем раствора, из которого происходит адсорбция, м 3 ; м- масса адсорбента, кг. Если есть возможность определить площадь адсорбции, величину адсорбции относят к единице поверхности (м 2 ).
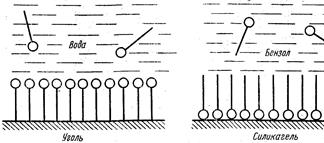
Зависимость адсорбции от строения молекул адсорбата очень сложна. Многие молекулы органических веществ (кислот, спиртов, аминов) состоят из двух частей: полярной группы и неполярного углеводородного радикала. Такие молекулы называются дифильными. К полярным группам относятся группы –COOH, –OH, –NH2, –SH, –CN, –NO2, –CHO, –SO2OH. Эти группы при взаимодействии с водой хорошо гидратируются, т.е. являются гтдрофильными. В отличии от них углеводородные радикалы гидрофобны. Они не взаимодействуют с водой, но сольватируются молекулами неполярных растворителей. Схематически прямой чертой обозначен углеводородный (неполярный) радикал, а кружком – полярная группа (рис.7).
А б
Рис 7 Ориентация дифильных молекул на поверхности адсорбента
При адсорбции на твердом адсорбенте дифильные молекулы растворенного вещества ориентируются на его поверхности так, чтобы полярная группа молекулы была обращена к полярной фазе, а неполярная – к неполярной. Так, при адсорбции органической кислоты из водного раствора на неполярном адсорбенте – угле молекулы её будут ориентироваться «хвостами» к адсорбенту (рис.7а). При адсорбции этой же кислоты из раствора в бензоле (неполярный растворитель) на полярном адсорбенте – силикагеле ориентация будет другой (рис.7б).
Следовательно, гидрофобные адсорбенты (уголь, тальк) лучше адсорбируют органические (дифильные) вещества из водных растворов, а гидрофильные адсорбенты (силикагель, глины) лучше адсорбируют их из неполярных и слабополярных жидкостей.
Дата добавления: 2016-11-04 ; просмотров: 7707 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Уравнение изотермы адсорбции фрейндлиха и его логарифмическая форма
Теоретические представления, развитые Ленгмюром и Поляни, в значительной степени идеализируют и упрощают истинную картину адсорбции. На самом деле поверхность адсорбента неоднородна, между адсорбированными частицами имеет место взаимодействие, активные центры не являются полностью независимыми друг от друга и т.д. Все это усложняет вид уравнения изотермы. Г. Фрейндлих показал, что при постоянной температуре число молей адсорбированного газа или растворенного вещества, приходящееся на единицу массы адсорбента (т.н. удельная адсорбция x/m), пропорционально равновесному давлению (для газа) или равновесной концентрации (для веществ, адсорбируемых из раствора) адсорбента, возведенным в некоторую степень, которая всегда меньше единицы:
Изотерма адсорбции Фрейндлиха в обычных (а) и логарифмических (б)
координатах
Показатель степени n и коэффициент пропорциональности а в уравнении Фрейндлиха определяются экспериментально. Логарифмируя уравнения, получаем:
Т.о., зависимость логарифма удельной адсорбции от логарифма концентрации (давления) графически выражается прямой линией, отсекающей на оси ординат отрезок, равный lga, тангенс угла наклона которой к оси абсцисс равен по величине показателю степени при давлении или концентрации:
Уравнение изотермы адсорбции фрейндлиха и его логарифмическая форма
Адсорбция. Изотермы адсорбции Лэгмюра, Фрейндлиха. Уравнение БЭТ и его анализ.
Поверхностная энергия стремится самопроизвольно уменьшиться. Это выражается в уменьшении межфазной поверхности или поверхностного натяжения ( s ).
Вследствие этого стремления происходит адсорбция.
Адсорбция – процесс самопроизвольного перераспределения компонентов системы между поверхностным слоем и объемной фазой. То есть адсорбция может происходить в многокомпонентных системах, в слой переходит тот компонент, который сильнее уменьшает поверхностное натяжение. В общем случае адсорбция может быть результатом химического взаимодействия компонентов с поверхностью – хемосорбция.
Адсорбент – фаза, определяющая форму поверхности, она более плотная, может быть твердой или жидкой.
Адсорбат – вещество, которое перераспределяется (газ или жидкость).
Десорбция — переход вещества из поверхностного слоя в объемную фазу.
Для количественного описания адсорбции применяют две величины. Одна измеряется массой адсорбента, то есть числом молей или граммов, приходящихся на единицу площади поверхности или на единицу массы адсорбента. Эту величину обозначают «А» (метод «слоя конечной толщины»). Другая характеристика величины адсорбции определяется избытком вещества в поверхностном слое по сравнению с его количеством в таком же объеме фазы также отнесенным к единице площади или единице массы адсорбента.
Физико – химическая классификация.
1. физическая (молекулярная),
Наиболее широко распространена физическая адсорбция.
При физической адсорбции происходит взаимодействие адсорбата и адсорбента за счет сил Ван-дер-Ваальса и водородных связей. Силы Ван-дер-Ваальса включают три вида взаимодействия: диполь-дипольное, индукционное и дисперсионное. Для всех видов взаимодействия выполняется один закон изменения энергии притяжения от расстояния между атомами.
Адсорбция – изменение концентрации вещества на границе раздела фаз по сравнению с объемом. Этим термином обозначают также и процесс поглощения и количество поглощенного вещества Г, отнесенного к единице площади поверхности или массы адсорбента (ммоль/м 2 или ммоль/г).
Адсорбция идет с выделением энергии, следовательно, этот процесс самопроизвольный.
Адсорбент – вещество, на поверхности которого происходит адсорбция.
Адсорбат – адсорбирующееся вещество.
Адсорбция физическая – адсорбция, обусловленная силами межмолекулярного взаимодействия (как правило, обратима).
Хемосорбция – поглощение газов, паров или растворенных веществ твердыми или жидкими поглотителями, сопровождающееся образованием химических соединений.
Теплота адсорбции – отнесенная к одному молю вещества теплота, которая выделяется при его адсорбции.
Адсорбция – экзотермический процесс ( Q >0) . При постоянной адсорбции(Г, Q = const ):


Величина Q является косвенным критерием определения типа адсорбции: если Q Q >40 кДж/моль – хемосорбция.
Изотерма адсорбции – функциональная зависимость количества адсорбированного поверхностью вещества от давления или концентрации этого вещества в другой фазе Г= f ( p ) T = const , Г= f (с) T = const .При монослойной локализованной адсорбции на однородной поверхности Г= f ( p ) описывается изотермой Ленгмюра.
Уравнение изотермы абсорбции (1916 –1918 г) получено исходя из следующих предположений:
1.) поверность адсорбента энергетически однородна, т.е. адсорбция молекул на любом ее участке проходит с одинаковым тепловым эффектом
2.) отсутствует взаимодействие между адсорбированными молекулами, т.е. молекулы покрывают адсорбент только мономолекулярным слоем. Максимум адсорбции наблюдается тогда, тогда когда вся поверхность покрыта мномолекулярным слоем
3.) адсорбция обратима, т.е. между адсорбционным слоем и газовой (жидкой) фазой восстанавливается термодинамическое равновесие.
При равновесии скорость адсорбции V ад должна равняться скорости десорбции V дес .
Для того, чтобы молекула адсорбировалась, она должна удариться о поверхность и попасть на незанятое место. Так как число ударов пропорционально концентрации С, а вероятность попасть на незанятое место пропорциональна числу незанятых мест, то
где k 1 – константа скорости адсорбции. q — доля занятых мест, 1– q – доля не занятых мест.
Молекула десорбируется, когда ее энергия окажется достаточной для того, чтобы оторваться от поверхности. Число таких молекул пропорционально числу адсорбированных молекул, поэтому
где k 2 – константа десорбции.
отсюда 

Если число мест на адсорбенте равно z , то адсорбция Г= z q и уравнение изотермы будет

Исследуем это уравнение:
1.) адсорбция мала: либо мала k 1 , либо мала С, тогда bC zbC = 

2.) Адсорбция велика: bc >> 1, тогда Г= z , т.е. наступает предельная адсорбция Г ¥ . Отношение 


Отсекаемые на оси координат отрезки и наклоны этих прямых позволяют определить константы уравнения Ленгмюра z и b . Однако уравнении Ленгмюра неудовлетворительно истолковывает данные по адсорбции. Отклонение от теории Ленгмюра является результатом неоднородной поверхности, которая характеризуется наличием неодинаковых адсорбционных центров обладающих различным сродством с адсорбируемым веществом. Если поверхность энергетически неоднородна, используют эмпирическое уравнение Френдлиха

где х – количество адсорбированного вещества,
m – масса адсорбента,
С – равновесная концентрация после адсорбции,
k , n – константы (аппроксимационные параметры).
Константа k – представляет собой количество вещества, адсорбированное 1 г. адсорбента при С = 1моль/литр. Для каждого адсорбатива k имеет свое значение при одном и том же адсорбенте, т.е. она характеризует способность данного адсорбата адсорбироваться определенным адсорбентом

где n – наклон прямой, а k – антилогарифм отрезка прямой. Уравнение Фрейндлиха можно вывести предположив, что поверхность энергетически неоднородна и что адсорбция на каждом из типов адсорбционных центров подчиняется уравнению Ленгмюра. Тогда константа k отвечает константе адсорбционного равновесия, а n – степени агрегативности. Согласно уравнению Фрейндлиха количество адсорбируемого вещества неограниченно возрастает с увеличение концентрации и давления, поэтому это уравнение не является удовлетворительным для высоких заполнений поверхностей.
При многослойной адсорбции изотерма адсорбции описывается уравнением БЭТ (Брунаэр, Эммет, Теллер). Они предположили, что на поверхности адсорбента имеются однородные локализованные адсорбционные центры и что адсорбция на одном центре не оказывает никакого влияния на адсорбцию на соседних центрах, также как и в теории Ленгмюра. Далее они предположили, что молекулы могут адсорбирваться во втором, третьем и n -ом молекулярном слоях, причем доступная площадь для молекул n -го слоя равна площади покрытой ( n -1) слоем.
где ps – давление насыщенного пара адсорбата,
p – давление адсорбата в другой фазе.
Отличительной чертой адсорбции паров является переход к объемной конденсации при предельном давлении, равном давлению насыщенного пара жидкости, p = ps . Целью этого уравнения является нахождение Г ¥ с помощью которой можно рассчитать доступную поверхность адсорбента.
http://www.sites.google.com/site/kolloidnaahimia/adsorbcia-svistat-vseh-na-poverhnost/izoterma-adsorbcii-frejndliha
http://www.trotted.narod.ru/physchem/24.htm