УРАВНЕНИЕ АДСОРБЦИИ ГИББСА
Выше (п. 2.4) мы пришли к выводу, что процесс адсорбции обусловлен снижением поверхностного натяжения. Очевидно, чем в большей степени ПАВ снижает поверхностное натяжение, тем большей должна быть его адсорбция. Напротив, ПИВ должна быть присуща отрицательная адсорбция.
Исходя из второго закона термодинамики американский ученый Дж. Гиббс в 70–х гг. XIX в. вывел важное уравнение, связывающее величину адсорбции со способностью растворенного вещества изменять поверхностное натяжение раствора:

где Гi, – избыточная адсорбция i-го компонента (см. 2.10), ci – его молярная концентрация в растворе, Т – температура, при которой происходит адсорбция, R – газовая постоянная, 
В такой форме уравнение Гиббса применяется для разбавленных растворов. Вы, очевидно, помните, что для концентрированных растворов концентрацию нужно заменить активностью:

Уравнение Гиббса было выведено теоретически. В дальнейшем оно было подтверждено экспериментально Мак–Беном методом среза тонких слоев с последующим их химическим анализом. Аналогичные исследования были проведены Сазаки с использованием метода радиоактивных индикаторов.
Проанализируем уравнение Гиббса.
Если 

Рис. 3.2. Определение избыточной адсорбции
Рис. 3.3. Изотерма адсорбции
Значение избыточной адсорбции для любой концентрации
| сi |  | Zi | Гi | сi |  | Zi | Гi |
| c1 |  1 1 | Z1 | Г1 | c4 |  4 4 | Z4 | Г4 |
| c2 |  2 2 | Z2 | Г2 | … | … | … | … |
| c3 |  3 3 | Z3 | Г3 | … | … | … | … |
ПОВЕРХНОСТНАЯ АКТИВНОСТЬ.
ПРАВИЛО ДЮКЛО-ТРАУБЕ
Из уравнения Гиббса следует, что характеристикой поведения вещества при адсорбции является величина производной 


[g] = Дж–м 3 /м 2 -моль = Дж–м/моль или Н-м 2 /моль.
Чем в большей степени уменьшается поверхностное натяжение с увеличением концентрации адсорбируемого вещества, тем больше поверхностная активность этого вещества, и тем больше его гиббсовская адсорбция.
Поверхностную активность можно определить графически как отрицательное значение тангенса угла наклона касательной, проведенной к кривой 
Таким образом, для ПАВ: g > 0; 
2. В гомологическом ряду прослеживаются четкие закономерности в изменении поверхностной активности (g): она возрастает по мере увеличения длины углеводородного радикала.
На основании большого экспериментального материала в конце XIX в. Дюкло и Траубе сформулировали правило:
Поверхностная активность предельных жирных кислот в водных растворах возрастает в 3–3,5 раза при удлинении углеводородной цепи на одно звено (группу –CH2).
На рис. 3.4 приведены изотермы поверхностного натяжения для ряда кислот.
Рис.3.4. Изотерма поверхностного натяжения некоторых кислот
1 – СН3СООН – уксусная кислота (nс=1); 2 – СН3СН2СООН – пропионовая кислота (nс =2); 3 – СН3(СН2)2СООН – масляная кислота (nс =3); 4 – СН3(СН2)3СООН – изовалериановая кислота (nс = 4); 5 – СН3(СН2)4СООН – капроновая кислота (nс =5); nс – число атомтов С в углеводородном радикале.
Рис. 3.6 Ориентация молекул ПАВ на поверхности водного раствора
а – при малых концентрациях; б – при умеренных концентрациях; в – в насыщенном адсорбционном слое.
При малых концентрациях углеводородные цепи, вытолкнутые в воздух, «плавают» на поверхности воды, тогда как полярная группа погружена в воду (рис. 3.6а), такое положение возможно из-за гибкости углеродной цепи. С ростом концентрации число молекул в поверхностном слое увеличивается, цепи поднимаются. Какие-то из них принимают вертикальное положение (рис. 3.6б). В насыщенном адсорбционном слое поверхность воды оказывается сплошь покрытой «частоколом» из вертикально ориентированных молекул ПАВ (рис. 3.6в), значение поверхностного натяжения в этом случае приближается к значению, характерному для чистого жидкого ПАВ на границе с воздухом.
Из-за вертикальной ориентации молекул ПАВ в поверхностном слое максимальная адсорбция ( 
Экспериментально найденная величина 
Предельная избыточная адсорбция ПАВ равна:

где 

где Na — число Авогадро.
Подставляя полученное значение S1,2 в уравнение (3.5), получаем


Так было найдено, что поперечный размер So молекул всех жирных кислот равен 20 * 10 -16 см 2 , а предельных спиртов – 25 * 10 -16 см 2 . Из величины предельной адсорбции была найдена также длина молекулы 
Масса 1 см 2 поверхностного слоя равна
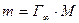
где М – молярная масса ПАВ.
В то же время плотность

так как объем 1 см 3 поверхностного слоя равен 

Экспериментальные данные показали, что длина молекулы ПАВ 

Таким образом, размеры молекул впервые в истории химии были определены коллоидно-химическим методом. В дальнейшем эти результаты были подтверждены другими методами.
УРАВНЕНИЕ ШИШКОВСКОГО
В 1908 г. киевский ученый Б. А. Шишковский эмпирическим путем получил уравнение, связывающее поверхностное натяжение водных растворов ПАВ с их концентрацией:

где 

Для того чтобы выяснить физический смысл постоянной В, обратимся к.уравнению Гиббса:

Разделим переменные и примем, что
Интегрируем это уравнение, принимая во внимание, что . 

где А – постоянная интегрирования.
Уравнение (3.12) получено в результате преобразования уравнения Гиббса для предельной адсорбции. Теперь для этих же условий запишем уравнение Шишковского, принимая во внимание, что максимальная адсорбция может быть достигнута при достаточно больших концентрациях ПАВ.
Тогда с >> 1, Кс >> 1 и 1 + Кс 

Сравнивая уравнения (3.13) и (3.12), видим, что

Теперь становится понятным, почему величина В в уравнении Шишковского остается постоянной в пределах одного гомологического ряда.
Однако смысл удельной капиллярной постоянной К пока остается неясным
ТЕОРИЯ МОНОМОЛЕКУЛЯРНОЙ
АДСОРБЦИИ ЛЕНГМЮРА
Отметим основные положения этой теории.
1. Адсорбция мономолекулярна.
2. При адсорбции устанавливается динамическое равновесие, которое можно рассматривать как квазихимическое. В условиях равновесия скорости процессов адсорбции и десорбции равны.
Константа адсорбционного равновесия

где кадс – константа скорости адсорбции; кдес – константа скорости десорбции.
Исходя из данной теории было выведено уравнение, которое мы приводим без вывода:

где 
Зависимость величины адсорбции от концентрации представлена на рис.3.7.
На кривой четко видны три участка:
I участок – прямая линия, выходящая из начала координат. Действительно, из уравнения Ленгмюра (3.15) при малых концентрациях Кс > 1 и 1 + Кс 
II участок – соответствует криволинейной части графика и описывается полным eравнением Ленгмюра (3.15).
Рис.3.7. Зависимость адсорбции от концентрации ПАВ.
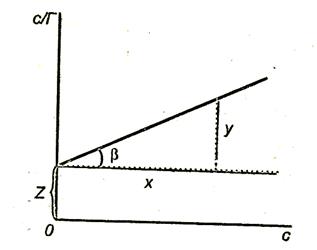
Чтобы найти постоянные в уравнении Ленгмюра, его следует привести к линейной форме. Для этого правую и левую части уравнения надо «перевернуть»:

Умножим обе части уравнения (3.16) на с:

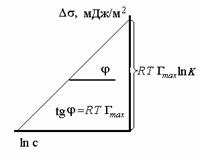
На рис. 3.8. показан график 
Тангенс угла наклона 
Отрезок, отсекаемый прямой на оси ординат,
Рис.3.8. Зависимость величины с/Г от концентрации ПАВ.
Доказано, что К в уравнении Шишковского (удельная капиллярная постоянная) и К в уравнении Ленгмюра (константа адсорбционного равновесия) – это одна и та же величина.
Построив график 

Так как адсорбция рассматривается как псевдохимическая реакция, на основе химической термодинамики можно записать

где Аmах – работа адсорбции.
Шишковский эмпирическим путем установил, что константа К увеличивается в 3–3,5 раза при удлинении цепи на одно звено –СН2.
Напишем выражение для разности работ адсорбции двух соседних членов гомологического ряда.
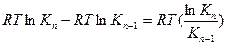

где n – число атомов углерода в углеводородном радикале.
Это означает, что для перевода каждой –СН2–группы из поверхностного слоя в объемную фазу надо затратить 3,2 кДж/моль энергии. Это работа раздвижения диполей воды на величину объема –СН2–группы – величина аддитивная и одинаковая для различных рядов алифатических предельных соединений. Постоянная разность работ адсорбции для двух соседних членов превращается в постоянное отношение (3–3,5), фигурирующее в правиле Дюкло–Траубе. Сущность этого правила, таким образом, заключается в том, что работа адсорбции на каждую –СН2–группу является постоянной, близкой к 3,5 кДж/молъ.
В заключение отметим, что помимо уравнения Гиббса, Шишковского и Ленгмюра существует уравнение Фрумкина, позволяющее рассчитать изменение поверхностного натяжения в результате адсорбции:

ЗАКЛЮЧЕНИЕ
Адсорбция поверхностно-активных веществ (ПАВ) на поверхности «жидкий раствор–газ» – самопроизвольный процесс, обусловленный уменьшением поверхностного натяжения. Для поверхностно-инактивных веществ (ПИВ), повышающих поверхностное натяжение, характерна отрицательная адсорбция.
Основным уравнением адсорбции является уравнение Гиббса, связывающее величину избыточной адсорбции с концентрацией ПАВ и его поверхностной активностью. Кривая, выражающая зависимость поверхностного натяжения от концентрации ПАВ при постоянной температуре, называется изотермой поверхностного натяжения. Тангенс угла наклона к оси абсцисс касательной к изотерме поверхностного натяжения при с 
Поверхностная активность ПАВ, согласно теории Ленгмюра, обусловлена дифильным строением их молекул: полярные группы втягиваются в глубь фазы, а неполярные углеводородные части выталкиваются в неполярную среду (воздух, газ), снижая тем самым поверхностное натяжение. С увеличением углеродной цепи на одну –СН2–группу поверхностная активность увеличивается в 3-3,5 раза (правило Дюкло–Траубе). Исходя из теории Ленгмюра, были впервые рассчитаны площадь, занимаемая одной молекулой, и длина молекулы ПАВ.
Зависимость величины адсорбции ПАВ от концентрации выражается уравнением Ленгмюра, выведенным исходя из представлений о скоростях процессов адсорбции и десорбции. Соответствующий график Г = f(с) называется изотермой Ленгмюра.
Изменение поверхностного натяжения в зависимости от адсорбции рассчитываются по уравнению Фрумкина.
ВОПРОСЫ И ЗАДАЧИ ДЛЯ САМОКОНТРОЛЯ
1. Какие вещества называются поверхностно-активными, поверхностно-инактивными?
2. В чем состоят особенности строения молекул ПАВ и ПИВ и их адсорбции?
3. Как зависит поверхностное натяжение от концентрации ПАВ в растворе?
4. Что называется поверхностной активностью? Как ее можно определить графически и аналитически?
5. В чем заключается правило Дюкло–Траубе?
6. Как графически и аналитически можно определить предельную адсорбцию?
7. Как рассчитать площадь, занимаемую молекулой, и толщину поверхностного слоя?
8. Для водных растворов изоамилового спирта константы уравнения Шишковского: В = 21,12 * 1СГ 3 Дж/м 2 ; К = 42,0 м 3 /кмоль. Поверхностное натяжение чистой воды при заданной температуре равно 72,9 * 10 -3 Дж/м 2 :
а) определите поверхностное натяжение растворов концентраций: 0,012; 0,016; … 0,032 кмоль/м 3 ,
б) постройте изотерму поверхностного натяжения,
в) определите графически поверхностную активность спирта,
г) по уравнению Гиббса вычислите адсорбцию спирта для заданных в п. а) концентраций,
д) постройте изотерму адсорбции и определите графи чески предельную адсорбцию,
е) определите площадь, занимаемую одной молекулой спирта в поверхностном слое.
9. Сравните поверхностную активность этанола и н-бутанола в водных растворах одинаковой концентрации.
10 Изотерма адсорбции ПАВ описывается уравнением Ленгмюра Г=Гmах*(Кс/(1 + Кс)). Найдите графическим методом константы Гmах и К.
11. Предельная адсорбция пропионовой кислоты равна 4,18 * 10 -6 моль/м 2 . Рассчитайте значение константы В в уравнении Шишковского, при стандартной температуре.
Закончив изучение главы 3, вы должны
1. понятия «поверхностно–активные» и «поверхностно-инактивные» вещества, «поверхностная активность»;
2. от чего зависит поверхностная активность ПАВ;
3. сущность теории мономолекулярной адсорбции Ленгмюра;
4. уравнения Гиббса, Шишковского, Ленгмюра, Фрумкина, какие зависимости каждое из них выражает;
1. строить изотерму поверхностного натяжения и определять графически поверхностную активность;
2. рассчитывать поверхностную активность по уравнению Гиббса;
3. рассчитывать поверхностное натяжение по уравнению Шишковского;
4. строить изотерму гиббсовской адсорбции и определять предельную адсорбцию ПАВ;
5. исходя из предельной адсорбции рассчитывать поперечный размер So и длину молекул 
1.5. Поверхностное натяжение растворов и адсорбция
Свободная поверхностная энергия самопроизвольно может только уменьшаться, что проявляется в уменьшении либо поверхности раздела фаз, либо межфазного (поверхностного) натяжения. Поверхностное натяжение может уменьшаться в результате самопроизвольного перераспределения компонентов системы между объемами фаз a и b и поверхностью их раздела. В поверхности раздела фаз будут преимущественно концентрироваться те компоненты, которые способны уменьшать избыточную свободную поверхностную энергию. Это явление получило название «адсорбция». Количественно мерой адсорбции служит избыток вещества в поверхностном слое определенной толщины по сравнению с его количеством в таком же слое в объеме фазы. Этот избыток обычно относят к единице площади поверхности (или к единице массы адсорбента). Такая адсорбция называется гиббсовской и обозначается буквой Гi. Поверхностный избыток является алгебраической величиной. Если он положителен, то вблизи поверхности данный компонент присутствует в избытке, если отрицателен, то концентрация компонента на поверхности фазы ниже, чем в ее объеме .
Рассмотрим распределение в системе i -го компонента, предполагая, что это вещество способно понижать поверхностное натяжение. В соответствии с уравнением (1.1.6) число молей n вещества i-го компонента в системе определяется как 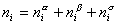
Количество вещества в обеих фазах составляет
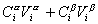
где С a , С b — концентрация вещества в фазах a, b.
Количество вещества на поверхности раздела фаз 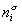
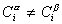
Учитывая уравнение (1.1.81) ,
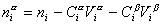
Разделив выражение (1.1.82) на площадь поверхности раздела фаз А, можем определить гиббсовскую адсорбцию:
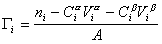
Фундаментальным уравнением физической химии поверхностей является взаимосвязь между адсорбцией и межфазным натяжением, которую можно определить экспериментально при одновременном изменении многих факторов. Остановимся на системах, в которых адсорбция протекает при постоянной температуре. Связь между адсорбцией и межфазным натяжением при постоянной температуре T называется изотермой адсорбции, фундаментальное уравнение которой известно как уравнение Гиббса. Рассмотрим его вывод.
При небольшом обратимом изменении энергии системы dU с учетом формулы (1.1.4) можем написать
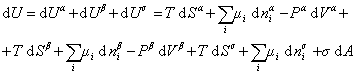
где U – полная внутренняя энергия системы; U a , U b , U s – внутренняя энергия фаз aиb и поверхности их раздела; P a , P b — давление в фазах aиb; m — химический потенциалi-того компонента; S a , S b , S s – энтропия фаз a иb и их поверхности раздела; s — поверхностное натяжение.
Поскольку из курса химической термодинамики известно, что
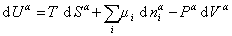
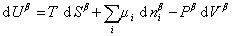
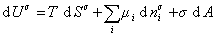
Если энергию, энтропию и количество компонентов увеличивать от нуля до некоторого определенного значения при постоянстве температуры T, площади поверхности раздела фаз A и количестве вещества на этой поверхности 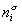
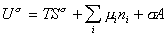
дифференцирование которого приводит к выражению
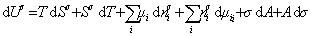
Сравнивая его с уравнением (1.1.88), получаем
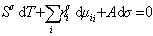
В расчете на единицу поверхности
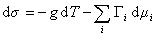
где 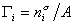
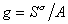
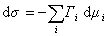
Для двухкомпонентной системы
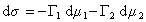
где индекс 1 относится к растворителю, а индекс 2 – к растворенному веществу.
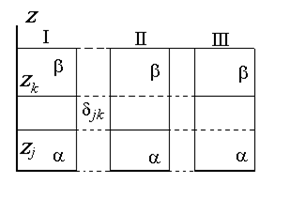
Разделяющая поверхность Гиббса может быть проведена так, чтобы обратилась в нуль адсорбция любого наперед заданного компонента, но только одного, как это показано на рис. 1.15.
Расстояние между двумя плоскостями (разделяющими поверхностями), одна из которых соответствует условию Гj = 0, а другая — Гk = 0, обозначим dkj:
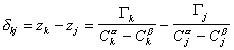
где Гk, Гj– избытки 
Поскольку значения Г1 в уравнении (1.1.93) определены относительно произвольно выбранного положения разделяющей плоскости, то ее можно расположить так, чтобы избыток растворителя в поверхностном слое был равен нулю ( Г1 = 0).
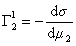
где верхний индекс 1 означает, что для выбранной поверхности раздела Г1=0.
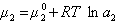
получаем после дифференцирования уравнения (1.1.96)
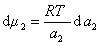
где 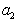
Поэтому, подставляя уравнение (1.1.97) в уравнение (1.1.95), получаем
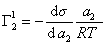
Из уравнения (1.1.98) следует, что если 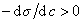
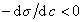
Поскольку 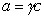
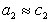
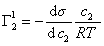
Уравнение (1.1.99) представляет собой наиболее употребляемую форму изотермы адсорбции Гиббса, причем так как рассматривается адсорбция именно растворенного вещества, индексы при адсорбции и концентрации опускают, т.е.
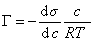
Исследования показывают, что существуют такие вещества, растворение которых приводит к резкому снижению поверхностного натяжения раствора. Эти вещества называют поверхностно-активными. В соответствии с уравнением Гиббса адсорбция их всегда положительна, т.е. концентрация в поверхностном слое выше объемной концентрации. По предложению Ребиндера мера поверхностной активности обозначается первой буквой фамилии Гиббса. Обычно используют значения поверхностной активности в бесконечно разбавленных растворах
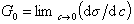
К классу поверхностно-активных веществ (ПАВ) относятся жирные кислоты и их соли (мыла), сульфокислоты, их соли, спирты, алкилсульфоэфиры и др. Если 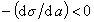
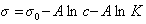
Обозначим постоянной В постоянные при изотермических условиях величины 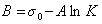
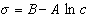
Следовательно, при относительно высокой концентрации растворов ПАВ их поверхностное натяжение должно уменьшаться экспоненциально с увеличением концентрации.
Уравнение (1.1.107) может быть получено непосредственно из уравнения изотермы адсорбции Гиббса:
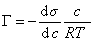
При достаточно высокой концентрации растворенного вещества адсорбция достигает предела , т.е. Г = Гmax , поэтому
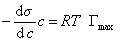
где при постоянной температуре правая часть представляет собой постоянную величину и может быть обозначена RT Гmax = A. Следовательно,
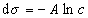
откуда после интегрирования получаем
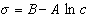
Таким образом, уравнение Шишковского может быть выведено из уравнения Гиббса, так как уравнения (1.1.107) и (1.1.109) идентичны. Точность уравнения Шишковского связана с тем, что в нем уже заложено условие насыщения адсорбционного слоя.
Если уравнение Шишковского в форме
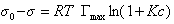
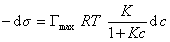
и подставить в уравнение Гиббса величину
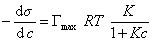
то уравнение изотермы адсорбции примет вид
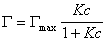
В такой форме уравнение изотермы адсорбции носит название изотермы Ленгмюра. Американский ученый И. Ленгмюр в 1917 г. развил представление о мономолекулярной адсорбции и на основании молекулярно- кинетической теории получил уравнение (1.1.113) .
Уравнение Шишковского позволяет определить предел адсорбции (при Kc>>1), так как в таком случае это уравнение принимает вид
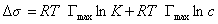
Построив график 
Понимание адсорбционных процессов имеет чрезвычайно важное значение, так как они лежат в основе многих процессов, протекающих на границе раздела фаз, например крашения, отмывания загрязнений, отделки текстильных материалов и т.д., т.е. в основе всех коллоидно -химических процессов на границе жидкость–газ.
Реферат: Адсорбция и адсорбционные равновесия
| Название: Адсорбция и адсорбционные равновесия Раздел: Рефераты по химии Тип: реферат Добавлен 16:01:44 27 января 2009 Похожие работы Просмотров: 6813 Комментариев: 24 Оценило: 7 человек Средний балл: 4.3 Оценка: 4 Скачать | ||||||||
| 1. Изотерма (рис. 8) | 2. Изобара | 3. Изостера |
| А =fT (c) | А =fP (T) | c=fA (T) |
| A=fT (P) | A=fC (T) | P=fA (T) |
Фундаментальное уравнение Гиббса. Определение Гиббсовской адсорбции. Адсорбционное уравнение Гиббса
Считаем V поверхности раздела = 0.
dU = TdS + s dS +
Проинтегрировав, получим: U = TS + sS +
Полный дифференциал от этого уравнения:
dU = TdS + SdT + s dS + 

Подставляя значение dU из (6) в (7) и сократив одинаковые члены правой и левой части, получим:
SdT + Sd s + 
Предположим, что T = const:
Разделив правую и левую часть на поверхность S , получим фундаментальное адсорбционное уравнение Гиббса :



Определение зависимости поверхностного натяжения от адсорбции одного компонента, при постоянстве химических потенциалов других компонентов.

Известно, что 



Активность связана с концентрацией: с = × а . Предположим, что = 1 (при с ® 0). Тогда

Обычно уравнение Гиббса применяют для растворов. Растворителем может быть не только индивидуальное вещество, но и смесь. В разбавленных растворах гиббсовская адсорбция очень мала, а его химический потенциал меняется очень мало с изменением концентрации растворенного вещества, т.е. d m= 0. Поэтому для разбавленного раствора фундаментальное уравнение Гиббса выглядит так:
Из этих уравнений следует, что зная зависимость 

Зная эти производныеуравнения Гиббса, можно рассчитать значение Г , что позволяет построить зависимость Г = f (С) . Уравнение Гиббса показывает, что единица измерения гиббсовской адсорбции не зависит от единицы измерений концентрации, а зависит от размерности величины R . Так как величина R отнесена к молю вещества, а s — к единице площади, то Г = [моль/ единица площади]. Если s выразить в [Дж/м 2 ], то R нужно подставлять: R = 8,314 Дж/моль×К.
Поверхностная активность. Поверхностно-активные и поверхностно-инактивные вещества. Анализ уравнения Гиббса. ПАВ. Эффект Ребиндера. Правило Дюкло-Траубе
В уравнении Гиббса влияние природы вещества на адсорбцию отражается производной

g = [Дж×м/моль] = [Н×м 2 /моль]; [эрг см/моль] = [Гиббс].
Уравнение показывает, что чем сильнее снижается 
Физический смысл поверхностной активности состоит в том, что она представляет силу, удерживающую вещество на поверхности и отнесенную к единице гиббсовской адсорбции .
Поверхностную активность можно представить как отрицательный тангенс угла наклона к касательной, проведенной к кривой Г = f ( C ) в точке пересечения с осью ординат. Поверхностная активность может быть положительной и отрицательной. Значение и знак ее зависят от природы растворенного вещества и растворителя.
1. 
1. 
http://xumuk.ru/colloidchem/27.html
http://www.bestreferat.ru/referat-102895.html