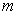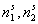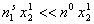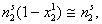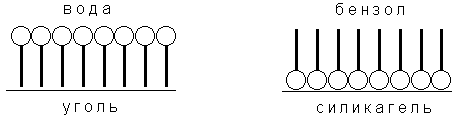Лако-красочные материалы — производство
Технологии и оборудование для изготовления красок, ЛКМ
Уравнение изотермы адсорбции из растворов с константой обмена
При обменной молекулярной адсорбции из растворов происходит перераспределение компонентов между объемом раствора и поверхностным слоем. Обмен одного компонента в объеме
Раствора или поверхностном слое на другой можно представить как квазихимическую обменную реакцию между компонентами В (компонент /) и С (компонент 2) с константой обмена Ка
В + С С + В: к„ = а2а,/(а, а2) НИ.102)
Где В и С — компоненты, находящиеся в поверхностном слое; о,- и и,— активность компонентов в поверхностном слое и объеме соответственно.
Если выразить активность компонентов через молярную долю х и коэффициент активности у, то уравнение (III.102) примет вид
Где K^ — коэффициент, учитывающий изменения коэффициентов активности с изменением состава раствора (их отклонения от единицы); К—концентрационная константа обмена.
Константа К равна
Где Di = Хі/Хі — коэффициент распределения компонента между поверхностным слоем и объемом раствора; .Г,-, х,- — молярные доли компонента в поверхностном слое и в объеме раствора.
Выразим молярную долю компонента / через молярную долю компонента 2 (,v,—J—X2= 1), тогда уравнение (III.104) примет вид
Из этого уравнения найдем молярную долю компонента 2 в поверхностном слое:
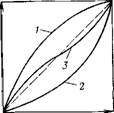
Уравнение (III. 105) называют общим уравнением изотермы адсорбции из бинарных растворов с константой обмена. Константа К является также коэффициентом разделения компонентов 1 и 2, т. е. отношением коэффициентов распределения второго и первого компонентов (III.104). Концентрационная константа обмена равна термодинамической константе обмена Ка только при условии /С, = 1 (111.103). Если коэффициенты активности компонентов и соответственно Л’т изменяются при изменении состава раствора, то не останется постоянной и К (III.103). Выражение концентраций в молярных долях позволяет графически представить изотерму при всех соотношениях компонентов, даже для неограниченно смешивающихся веществ (рис. III.16).
Проведем анализ зависимости (III. 105). Если л’2—>-0, то при любом значении К в знаменателе уравнения (III.105) можно пренебречь величиной (К
)х2, и тогда изотерма приобретает вид закона Генри:
Поэтому в начале изотермы наблюдается линейная зависимость х2 от х2. При К> 1 изотерма идет выше диагонали (рис. 111.16, кривая /), при К
Из соотношения (III.107) следует, что знаменатель растет ■с увеличением концентрации компонента 2 в объеме, и первоначальный прямолинейный участок зависимости х2 от х2 переходит в кривую выпуклой формы — рост величины адсорбции замедляется с увеличением концентрации компонента в объеме (рис. III.16, кривая /).
Рис. III. 16. Изотермы адсорбции из бинарного раствора в соответствии с уравнением (III. 105):
Следовательно, при увеличении концентрации компонента 2 в объеме знаменатель уравнения (III.108) уменьшается и более быстро возрастает величина адсорбции (см. рис. III.16, кривая 2). Зависимость приобретает вид вогнутой кривой. Изотермы при К> 1 и К
Подставляя эти выражения в уравнение (111.100) найдем:
Для удобства обработки экспериментальных результатов полученное соотношение записывают в линейной форме:
Линейная зависимость в координатах s• хіх2/(П0ІХІ)^-ХІ позволяет определить графически величины ns и К, а используя уравнение (III.111), можно рассчитать А2 и построить изотерму адсорбции A2 = f(x2).
5.1.Общие закономерности адсорбции из растворов на твердой поверхности
Исследования адсорбции из жидких растворов обычно осложнены тем, что при контакте раствора с твердым адсорбентом всегда возможна сорбция всех компонентов, что влияет на характер изотермы адсорбции. Если рассматривать лишь двухкомпонентный раствор, то для каждого из компонентов раствора будет своя индивидуальная изотерма, совокупность которых и определяет вид обобщенной изотермы. Обычно количество адсорбированного вещества рассчитывают по изменению концентрации раствора, которое измеряют подходящим химическим методом анализа концентрации растворенного вещества или интерферометрически (для неокрашенных растворов), спектроскопически (для веществ, имеющих характеристические полосы поглощения света), по изменению величины поверхностного натяжения (для ПАВ) или по интенсивности радиоактивного излучения, если исследуемое вещество имеет радиоактивную метку. При больших значениях удельной активной поверхности адсорбента и, соответственно, значительной адсорбции можно определять непосредственно гиббсовский поверхностный избыток весовым методом. Аналогичные данные можно получить по интенсивности радиоактивного излучения адсорбционного слоя.
Изотерма изменения состава раствора, которая при некоторых допущениях считается адекватной изотерме адсорбции, описывается соотношением
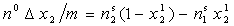
где D x2 – уменьшение мольной доли x2 1 компонента 2 в растворе, обусловленное тем, что 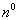


В уравнение (1.5.1) входят две неизвестные величины 
Если растворенное вещество имеет низкую истинную растворимость, что характерно для ПАВ и красителей, и растворы можно считать разбавленными, то даже при сравнительно большом значении 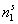

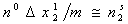
При таких допущениях обобщенная изотерма преобразуется в индивидуальную изотерму адсорбции растворенного вещества, несмотря на возможность адсорбции значительного количества растворителя.
В том случае, если рассчитанная по изменению концентрации раствора изотерма адсорбции растворенного вещества имеет максимум при равновесной мольной доле, меньшей предела растворимости, то можно предполагать, что после насыщения монослоя адсорбция далее не идет и, несмотря на относительно низкие значения мольной доли растворенного вещества 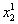
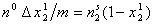
Аналогичная картина возможна и в том случае, если адсорбция растворителя все же происходит, но после насыщения монослоя его состав остается неизменным.
Сложность адсорбционных процессов, отягощенных подчас изменением межмолекулярного взаимодействия компонентов в растворе и в адсорбционном слое, приводит к появлению большого числа разнообразных изотерм адсорбции, которые можно разделить на несколько групп. Такую классификацию предложил Гилльс (рис. 1.45).
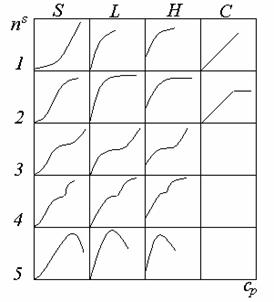
На основе анализа формы начального участка выделены 4 характерных класса изотерм. Деление изотерм на типы проводится на основании изменения формы кривой при более высоких концентрациях. Наиболее общим является класс L (класс изотерм Ленгмюра), на начальном участке изотермы этого класса выгнуты относительно оси концентраций. Изотермы L-2 характерны насыщением адсорбционного слоя при определенной концентрации, выше которой адсорбция достигает предела. Если адсорбция продолжается и после насыщения монослоя, то возможны изотермы L-3, которые при насыщении адсорбционного слоя и появлении второго плато переходят в изотермы L-4. Для изотермы L-5 характерно наличие максимума. Как правило, это возможно в результате какого-либо изменения, происходящего с растворенным веществом, например, при мицеллообразовании или при наличии примесей высокоактивных веществ, находящихся в виде ассоциатов с другими молекулами.
Класс изотерм S характерен вогнутостью начального участка относительно оси концентраций. При последующем увеличении концентрации возможна точка перегиба, что придает таким изотермам характерный S-образный вид. При более высоких концентрациях может происходить насыщение монослоя, образование полимолекулярного слоя и появление второго плато, а также может быть максимум на кривой при вытеснительной адсорбции или при изменении состояния растворенного вещества.
Изотермы класса Н отличаются высоким сродством адсорбата к адсорбенту. Они наблюдаются при чрезвычайно сильной энергии адсорбции и в области очень низких концентраций пересекаются с осью ординат.
Класс С отличается линейным начальным участком изотерм, что указывает на постоянство постоянной распределения растворенного вещества между адсорбционным слоем и раствором. Такие изотермы достаточно часто наблюдаются для микропористых адсорбентов (волокон) при адсорбции красителей, когда в результате адсорбции происходит увеличение поверхности адсорбента пропорционально количеству адсорбированного вещества (происходит раскрытие ранее недоступной поверхности — механизм замка на застежке молния).
Взаимодействие адсорбированных молекул с поверхностью адсорбента может быть физическим или химическим. Многие адсорбенты, в том числе подавляющее большинство волокон, в водной среде несут на своей поверхности заряд, знак которого и величина определяются значением рН. Для всех волокон, оксидов, гидроксидов существует такое значение рН, при котором поверхность не заряжена. Это состояние называется точкой нулевого заряда.
Поверхность многих адсорбентов, и особенно волокон, неоднородна- мозаична в связи с распределением на границе раздела фаз активных центров различной адсорбционной активности (высокой и низкой), таких как полярные и неполярные группы, адсорбированные загрязнения (например, жиры и воска на натуральных волокнах, включения силикатов в волокнах) и т.д. В этой связи поверхность многих адсорбентов плохо охарактеризована. Что же касается волокон, то характер их поверхности может меняться и при изменении молекулярной массы полимера — их надмолекулярная структура оказывает влияние на микропористость.
Химическая адсорбция или сорбционный процесс, сопровождающийся набуханием полимерных адсорбентов, происходит с разрушением межмолекулярных связей между макромолекулами и с образованием новых связей адсорбент-адсорбат (полярные группы макромолекул — вода или другая полярная жидкость). Как первая стадия хемосорбции всегда проявляется адсорбция физическая, т.е. непосредственно процесс притяжения молекул адсорбата к поверхности адсорбента, и лишь затем происходит поверхностная реакция, диффузия молекул адсорбата через границу раздела фаз внутрь волокна с раскрытием «внутренней» поверхности пористого пространства в аморфных участках волокон и т.д. Таким процессам соответствуют изотермы типа С-2. В таком процессе число свободных адсорбционных центров остается постоянным в широкой области концентраций растворов. По мере заполнения одних центров появляются новые и доступная для адсорбции поверхность увеличивается пропорционально количеству адсорбированного из раствора вещества.
Большое значение при адсорбции имеет состояние растворенного вещества. Многие поверхностно-активные вещества в водных растворах при определенной концентрации находятся в виде агрегатов, содержащих от нескольких молекул до сотен и даже тысяч молекул или ионов. Образование мицелл в растворах ПАВ, как правило, препятствует адсорбции. Образование агрегатов молекул, вплоть до выделения коллоидных частиц, например, красителей, изменяет характер взаимодействия с поверхностью и вызывает переход от адсорбции к гетероадагуляции. В водных растворах большое значение имеют величина и знак заряда волокон и растворенных веществ.
При изучении адсорбции наиболее информативными являются исследования кинетики процесса, форма изотермы, наличие плато, тип адсорбции — мономолекулярная или полимолекулярная, ориентация молекул в адсорбционном слое, влияние температуры и природа сил взаимодействия молекул адсорбата с поверхностью. Большую пользу приносят ИК-спектроскопические исследования, позволяющие установить тип взаимодействия адсорбированных молекул с активными центрами на поверхности, выявить конкуренцию растворенных веществ за активные центры.
В ряде случаев адсорбцию ПАВ на твердых адсорбентах можно описать эмпирическим уравнением типа изотермы Фрейндлиха
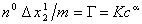
где 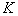
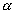
Изотермы типа L в области разбавленных растворов могут быть описаны уравнением адсорбции Ленгмюра, которое при определении адсорбции растворенного вещества должно учитывать возможную адсорбцию растворителя.
Рассматривая адсорбцию из растворов как квазихимический процесс
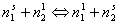
получаем для постоянной равновесия в соответствии с законом действующих масс
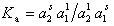
где 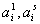
Для разбавленных растворов и ненасыщенных адсорбционных слоев (пренебрегая отклонением от идеальности)
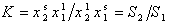

Уравнение (1.5.7) показывает, что постоянная равновесия адсорбции может быть выражена через коэффициент распределения S компонентов системы между адсорбционным слоем и раствором.
Эверетт преобразовал уравнение (1.5.7), включив в него экспериментально определяемую величину изменения концентрации раствора: 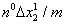
После преобразований уравнение (1.5.7) имеет вид
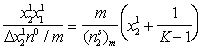
где 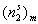
Учитывая, что для разбавленных растворов 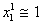
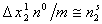
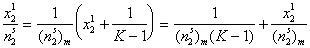
или, переходя к мольным величинам,
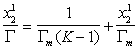
Уравнение (1.5.10) представляет собой линейную форму уравнения изотермы адсорбции Ленгмюра, в котором постояннаяK учитывает обмен компонентов раствора в адсорбционном слое. В обычной форме уравнение имеет вид
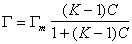
Приведенные уравнения (1.5.4)-(1.5.11) справедливы для мономолекулярной адсорбции и не учитывают латеральных взаимодействий при насыщении адсорбционных слоев (латеральными называют взаимодействия между соседними молекулами в адсорбционном слое). При диссоциации растворенных веществ в растворе и их адсорбции на заряженной поверхности, несущей двойной ионный слой, необходимо учитывать также электростатические взаимодействия в адсорбционном слое. Эти взаимодействия будут подробно обсуждаться при рассмотрении адсорбции ионизированных веществ на твердой поверхности заряженных адсорбентов.
Уравнение изотермы адсорбции из растворов
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
4.1 ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ И АДСОРБЦИЯ
4.1.5 Адсорбция на границе твердое тело – раствор
Молекулярная адсорбция из растворов
Изотермы адсорбции растворенных веществ из раствора по своему виду аналогичны изотермам адсорбции для газов; для разбавленных растворов эти изотермы хорошо описываются уравнениями Фрейндлиха или Ленгмюра, если в них подставить равновесную концентрацию растворенного вещества в растворе. Однако адсорбция из растворов является значительно более сложным явлением по сравнению с газовой, поскольку одновременно с адсорбцией растворенного вещества часто происходит и адсорбция растворителя.
Рис. 4.8 Ориентация молекул ПАВ на поверхности адсорбента
Зависимость адсорбции от строения молекул адсорбата очень сложна, и вывести какие-либо закономерности довольно трудно. Молекулы многих органических веществ состоят из полярной (гидрофильной) и неполярной (гидрофобной) группировок, т.е. являются поверхностно-активными веществами. Молекулы ПАВ при адсорбции на твердом адсорбенте ориентируются на его поверхности таким образом, чтобы полярная часть молекулы была обращена к полярной фазе, а неполярная – к неполярной. Так, при адсорбции алифатических карбоновых кислот из водных растворов на неполярном адсорбенте – активированном угле – молекулы ориентируются углеводородными радикалами к адсорбенту; при адсорбции из бензола (неполярный растворитель) на полярном адсорбенте – силикагеле – ориентация молекул кислоты будет обратной (рис. 4.8).
Адсорбция из растворов электролитов
Адсорбция из водных растворов электролитов происходит, как правило, таким образом, что на твердом адсорбента из раствора адсорбируются преимущественно ионы одного вида. Преимущественная адсорбция из раствора или аниона, или катиона определяется природой адсорбента и ионов. Механизм адсорбции ионов из растворов электролитов может быть различным; выделяют обменную и специфическую адсорбцию ионов.
Обменная адсорбция представляет собой процесс обмена ионов между раствором и твердой фазой, при котором твердая фаза поглощает из раствора ионы какого-либо знака (катионы либо анионы) и вместо них выделяет в раствор эквивалентное число других ионов того же знака. Обменная адсорбция всегда специфична, т.е. для данного адсорбента к обмену способны только определенные ионы; обменная адсорбция обычно необратима.
При специфической адсорбции адсорбция на поверхности твердой фазы ионов какого-либо вида не сопровождается выделением в раствор эквивалентного числа других ионов того же знака; твердая фаза при этом приобретает электрический заряд. Это приводит к тому, что вблизи поверхности под действием сил электростатического притяжения группируется эквивалентное число ионов с противоположным зарядом, т.е. образуется двойной электрический слой. Взаимодействие концентрирующихся на поверхности зарядов приводит к понижению поверхностной энергии системы. Для случая специфической адсорбции электролита Песковым и Фаянсом было сформулировано следующее эмпирическое правило ( правило Песко ва – Фаянс а ):
На поверхности кристаллического твердого тела из раствора электролита специфически адсорбируется ион, который способен достраивать его кристаллическую решетку или может образовывать с одним из ионов, входящим в состав кристалла, малорастворимое соединение.
Copyright © С. И. Левченков, 1996 — 2005.
http://xumuk.ru/colloidchem/58.html
http://physchem.chimfak.sfedu.ru/Source/PCC/Colloids_4.htm