Уравнение состояния идеального газа. Изопроцессы
Соотношение p = n k T – это формула, связывающая значение давления газа с его температурой и концентрацией молекул на единицу объема.
Они взаимодействуют со стенками сосуда посредствам упругих соударений. Данное выражение можно записать иначе, учитывая параметрические состояния объема V , давления p , температуры T и количества вещества ν . Применим неравенства:
n = N V = ν N А V = m M N A V .
Значением N является количество молекул данного сосуда, N А – постоянной Авогадро, m – массой газа в емкости, М – молярной массой газа. Исходя из этого, формула примет вид:
p V = ν N А k T = m M N А k T .
Произведение постоянной Авогадро N А на постоянную Больцмана k называют универсальной газовой постоянной и обозначают R .
По системе С И имеет значение R = 8 , 31 Д ж / м о л ь · К .
Соотношение p V = ν R T = m M R T получило название уравнения состояния идеального газа.
Один моль газа обозначается p V = R T .
При температуре T н = 273 , 15 К ( 0 ° C ) и давлении ρ н = 1 а т м = 1 , 013 · 10 5 П а говорят о нормальных условиях состояния газа.
Из уравнения видно, что один моль газа при нормальных условиях занимает один и тот же объем, равный v 0 = 0 , 0224 м 3 / м о л ь = 22 , 4 д м 3 / м о л ь . Выражение получило название закона Авогадро.
Если имеется смесь невзаимодействующих газов, то формулу запишем как:
p V = ν 1 + ν 2 + ν 3 + . . . R T ,
где ν 1 , v 2 , v 3 обозначает количество вещества каждого из них.
Еще в ХХ веке Б. Клапейрон получил уравнение, показывающее связь между давлением и температурой:
p V = ν R T = m M R T .
Впоследствии оно было записано Д.И. Менделеевым. Позже его назвали уравнением Клапейрона-Менделеева.
Задолго до получения уравнения состояния идеального газа на основе молекулярно-кинетической теории поведения газов изучались в различных условиях экспериментально. То есть уравнение p V = ν R T = m M R T служит обобщением всех опытных фактов.
Газ принимает участие в процессах с постоянно изменяющимися параметрами состояния: ( p , V и T ).
При протекании процессов медленно, система находится в состоянии, близком к равновесному. Процесс получил название квазистатического.
Соотнеся с происхождением процессов в нашем времени, то его протекания нельзя считать медленными.
Обычное время для разрежения и сжатия газа сотни раз в секунду. Это рассматривается как квазистатический процесс. Они изображаются с помощью диаграммы состояний параметров, где каждая из точек показывает равновесное состояние.
При неизменном одном параметре из ( p , V или T ) процесс принято называть изопроцессом.
Лекция № 7 Физические процессы в реальных газах
Физические процессы в реальных газах
Выписка из рабочей программы дисциплины «Молекулярная физика и термодинамика»
Название темы, литература
4.1 Физические процессы в реальных газах
Изотермы реального газа. Критическое состояние. Понятия пересыщенного пара, растянутой жидкости и метастабильного состояния. Внутренняя энергия реального газа. Эффект Джоуля — Томсона. Сжижение газов.
1. Изотермы Ван-дер-Ваальса
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) имеет вид:

Если в идеальном газе процесс протекает при постоянной температуре (изотермический процесс), то график зависимости 
Рис. 1 Изотермы идеального газа
Уравнение состояния реального газа (уравнение Ван-дер-Ваальса) имеет вид:

Для простоты предположим, что имеется 1 моль реального газа. Тогда уравнение Ван-дер-Ваальса можно записать в виде:


Приведём к общему знаменателю:


Разделим на 

Сгруппируем члены с одинаковыми показателями степени объёма:

Уравнение (1) является уравнением третьей степени и должно иметь три корня: V1, V2, V3. Это означает, что эти три значения объёма соответствуют одному значению давления и температуры.
Теоретические изотермы Ван-дер-Ваальса. Изотермы реальных газов.

Изотерма, представляющая собой одно из решений уравнения Ван-дер-Ваальса.
Поэтому, в отличие от изотерм идеального газа, представляющих собой гиперболу, изотермы Ван-дер-Ваальса представляют собой кривую, являющуюся решением кубического уравнения, имеет максимум и минимум, а одному значению р1 соответствуют три возможных значения объёма V.
Теоретические изотермы для углекислого газа при различных температурах шкалы Цельсия (температуры указаны над 
Из кривых видно, что по мере повышения температуры изотермы располагаются выше, что естественно, кроме того, максимумы и минимумы изотерм сближаются как по оси абсцисс (уменьшается разность между отвечающими им объемами), так и по оси ординат (уменьшается соответствующая разность давлений). Наконец, при вполне определенной критической температуре (на рис. при 31,4° С) максимум и минимум изотермы сливаются, вырождаясь в точку перегиба при значении n = 2,7 л/моль и р = 73 атм. Это значит, что при повышении температуры постепенно уменьшается различие между тремя значениями объема, соответствующими одному и тому же значению давления, т. е. уменьшается различие между тремя корнями уравнения Ван-дер-Ваальса.
При определенной (критической) температуре Тк все три значения объема сливаются, корни уравнения становятся кратными. При этой температуре исчезает, следовательно, различие между различными состояниями вещества. Это, очевидно, и есть критическая температура, существование которой является характерным свойством вещества.
При температуре выше критической поведение реального газа приближается к поведению идеального, описываемого законом Бойля-Мариотта.
Рассмотрим теперь экспериментальные данные для зависимости p=f(V), получаемые по простой схеме.
Рис. а) схема опыта (М-манометр для измерения давления), б – график полученного результата.
Оказалось, что газовое состояние существовало лишь на участке 1-2, на участке 2-3 вещество представляло собой двухфазную систему «пар+жидкость», а на участке 3-4 наблюдается сжатие практически несжимаемой жидкости.
Более тщательное исследование газов и жидкостей, очищенных от примесей, пыли и т. п. показали, что из теоретической изотермы можно реализовать некоторые участки.

На участке cd изотермы вещество находится в неустойчивом «метастабильном» состояния пересыщенного пара, которое при малом внешнем воздействии самопроизвольно конденсируется в жидкость в виде капель тумана. Это состояние используется, в частности, в камерах Вильсона для наблюдения движения микрочастиц.
На участке af изотермы вещество представляет собой «перегретую жидкость» – также метастабильное состояние, самопроизвольно стремящееся в парообразное состояние. Это состояние также используется для наблюдения за микрочастицами, в пузырьковых камерах.
Участок fd не реализуется ни в каких известных опытах.
На рис. представлены графики для углекислого газа
Фазовая диаграмма для углекислого газа.
Видно, что при температурах ниже Тк на каждой изотерме имеется горизонтальный участок ВС, вдоль которого постоянна не только температура, но и давление, а молярный объём может принимать любые значения от VB до VC.
Оказывается, на участке АВ вещество – жидкость, а на участке СТ – углекислота находится в газообразном состоянии. На участке СВ углекислота одновременно находится в двух агрегатных состояниях — жидком и газообразном. Точка С соответствует началу конденсации СО а при изотермическом сжатии, а точка В — концу конденсации. Наоборот, при изотермическом расширении жидкой углекислоты точка В соответствует началу кипения, а точка С — его концу. Следовательно, точка В соответствует состоянию кипящей жидкости, а точка С состоянию так называемого сухого насыщенного пара. В произвольном состоянии М области ВС СО2 представляет собой смесь кипящей жидкости и сухого насыщенного пара. Такая смесь называется влажным паром.
Обнаружено, что при T>Tк переход в жидкое состояние невозможен ни при каких степенях сжатия.
Параметры критической точки вычислены и равны:
где a и b – константы уравнения Ван-дер-Ваальса, R – универсальная газовая постоянная.
Для СО2: Ткр = 304К; ркр = 7,38 МПа;
Фазовая диаграмма четко делится на ряд областей.
I — первая область — область газа — ни при каких степенях сжатия газа переход в жидкое и твердое состояние невозможен.
II – «газ – пар» — происходит сжатие, которое начиная с некоторого значения р, приводит к возникновению двухфазного состояния
III — двухфазное состояние: «жидкость + пар», количество газообразной и жидкой фаз может быть найдено «правилом рычага», МС – доля жидкой фазы, МВ – доля паровой фазы.
IV — жидкость — практически несжимаемая материя.
13.3. Изотермы реального газа. Критическое состояние
Как мы уже отмечали, по мере увеличения объема или повышения температуры уравнение Ван-дер-Ваальса переходит в уравнение Клапейрона-Менделеева. Наоборот, c увеличением давления и понижением температуры различие между ними становится заметнее. Формально это связано с тем, что рассматриваемое нами уравнение состояния реального газа представляет собой алгебраическое уравнение третьей степени относительно 


Давление 








Если в уравнении (13.3) зафиксировать значение температуры (
Для анализа отдельных участков изотермы Ван-дер-Ваальса рассмотрим опыт, схема которого изображена на том же рисунке. Толстостенная стеклянная трубка, закрытая с одного конца поршнем, заполнена некоторым реальным газом и расположена параллельно оси абсцисс. К левому концу трубки прикреплен ртутный манометр. Объем газа указывается непосредственно положением поршня, а давление – высотой ртутного столба, параллельного оси ординат. Если при постоянной температуре перемещать поршень и регистрировать давление, то можно выяснить, насколько правильно уравнение Ван-дер-Ваальса отражает поведение реального газа[2].
На рис. 125 пунктиром изображен результат подобного опыта, соответствующий некоторой температуре 



Теоретическая изотерма хорошо согласуется с опытной при всех давлениях, исключая область конденсации насыщающего пара. В этой области наблюдается сильное расхождение теории Ван-дер-Ваальса и эксперимента. Однако область «горбов» теоретической изотермы точно попадает на область конденсации пара и это позволяет качественно установить ряд важных закономерностей, наблюдаемых на опыте. Рассмотрим эту область изотермы подробнее.
Повторим рассмотренный выше опыт, но с модельным газом Ван-дер-Ваальса, который при данной температуре может быть сжат до объема меньшего, чем объем насыщающего пара (участок EB). В теоретической модели нет конденсации. Но сжатие реального газа в соответствии с используемой моделью оказывается возможным, если сжимаемый газ тщательно очистить от пыли. В этом случае можно наблюдать задержку возникновения конденсации. Состояние газа, соответствующее этому участку, называется пересыщенным паром. Это состояние неустойчиво. В пересыщенном паре спонтанно (т. е. самопроизвольно) может возникать конденсация, при которой давление скачком падает до значения насыщающего пара. Центрами конденсации являются обычно пылинки, поверхности тел и т. д. Поэтому спонтанная конденсация проявляется в образовании мельчайших капелек жидкости (тумана) или же запотевании поверхностей, например, стекол.
Аналогичным образом при изотермическом расширении жидкости можно наблюдать задержку парообразования. При этом давление в системе будет ниже давления насыщающего пара. Участок CF (см. рис. 125) теоретической кривой хорошо согласуется с задержкой парообразования. Эта часть изотермы Ван-дер-Ваальса соответствует неустойчивому состоянию растянутой жидкости. Иногда ее называют перегретой, так как она имеет объем, больший, чем это соответствует данной температуре.
При определенных условиях газ может находиться в неустойчивых состояниях (пересыщенного пара и перегретой жидкости) длительное время. Поэтому эти состояния называются метастабильными1. Метастабильными называют равновесные состояния с ограниченной устойчивостью. При отклонении от этого состояния система не стремится к нему обратно, а легко переходит в другое устойчивое состояние. Метастабильные состояния существуют ограниченное время.
Участок FE изотермы Ван-дер-Ваальса на практике не реализуется, так как он соответствует нереальному случаю роста давления при увеличении объема. Причина его существования лежит в ограниченности модели. Если этот участок мешал бы практическому использованию теории, модель была бы уточнена, но в данном случае этого не требуется. И хотя модель Ван-дер-Ваальса весьма груба, она все же позволяет сделать очень много. Во-первых, она уточняет опытную изотерму. С учетом возможных метастабильных состояний опытная изотерма в общем случае должна содержать «зубцы», имеющие разный знак для прямого и обратного хода процесса (сжатие и разряжение). Это показано на рис. 126.
Кроме этого, теория Ван-дер-Ваальса позволяет объяснить существование очень важного свойства реальных газов, называемое критическим состоянием. Рассмотрим этот вопрос подробнее.
По мере повышения температуры изотермы Ван-дер-Ваальса поднимаются вверх, а область «горбов» на них становится уже. Это означает, что уменьшается разность объемов 



Величины 



В критической точке исчезает всякое различие между жидкостью и паром, а переход вещества из газообразного состояния в жидкое происходит непрерывно. Вблизи критической точки возрастают флуктуации плотности вещества, приводящие к сильному рассеянию света. Это явление получило название опалисценции (по имени минерала опала, также сильно рассеивающего свет). Значения критических параметров можно найти из уравнения Ван-дер-Ваальса. Для температур меньших критической уравнение (13.3) имеет три различных действительных корня. Для критической температуры уравнение должно иметь три одинаковых корня (

где 
Сравнивая коэффициенты при одинаковых степенях объема в уравнениях (13.3) и (13.4), найдем «координаты» критической точки, т. е. теоретические выражения для критических параметров:

Критические параметры можно определить экспериментально, а из них рассчитать значения постоянных Ван-дер-Ваальса. Этим самым теоретическое уравнение состояния оказывается привязанным как к индивидуальным свойствам газов, так и к любой реальной ситуации.
Если соединить между собой точки, соответствующие 

13.4. Внутренняя энергия реального газа. Эффект Джоуля-Томсона
Одним из важнейших отличий модели реального газа является учет сил межмолекулярного взаимодействия. Это накладывает отпечаток на величину внутренней энергии. Внутренняя энергия идеального газа представляет собой сумму кинетических энергий движения молекул и не зависит для данного количества газа ни от объема, ни от давления. Зависит она только от температуры. В реальном газе силы притяжения между молекулами играют существенную роль. Поэтому пренебрегать потенциальной энергией взаимодействия уже нельзя. Следовательно, внутренняя энергия реального газа должна складываться из кинетической энергии движения молекул и потенциальной энергии их взаимодействия:

Потенциальная энергия должна зависеть от объема, так как при изменении объема изменяется расстояние между молекулами газа. Существование потенциальной энергии взаимодействия между молекулами накладывает отпечаток на изопроцессы, происходящие в реальных газах. Изотермический процесс был уже изложен выше. Теперь рассмотрим процесс адиабатического расширения реальных газов.
В соответствии с определением, при адиабатических процессах отсутствует обмен энергией с окружающей средой. Совершаемая при этом работа связана только с изменением внутренней энергии. Адиабатическое расширение идеального газа без совершения работы происходит при неизменном запасе внутренней энергии, т. е. без изменения температуры. В аналогичном случае для реального газа расширение приведет к изменению потенциальной энергии взаимодействия молекул, а условие неизменности внутренней энергии требует соответствующего изменения кинетической энергии. Изменение кинетической энергии означает изменение температуры реального газа. Для одного моля имеет место соотношение:

Следовательно, при изменении объема реального газа без совершения работы против внешних сил и без теплообмена с окружающей средой должно наблюдаться изменение температуры. Первую попытку наблюдать явление такого рода предпринял Джоуль. Однако, чувствительность его установки была недостаточной. Несколько позже, на более чувствительной установке Джоулем совместно с Томсоном был экспериментально обнаружен эффект изменения температуры адиабатически расширяющегося (без совершения работы) газа, который получил название эффекта Джоуля–Томсона.
Сущность опыта Джоуля и Томсона состояла в следующем. В трубку, соединяющую два баллона с газом, помещалась пористая перегородка (дроссель). На рис. 129 изображен отрезок соединительной трубки с дросселем (баллоны с газом не показаны). По обе стороны от дросселя помещались чувствительные термометры. Давления 

Опыт показал, что для большинства газов расширение сопровождается охлаждением, т. е. температура газа перед дросселем больше, чем после него. Для водорода знак эффекта противоположен.
Эффект Джоуля–Томсона принято называть положительным, если при адиабатическом расширении газ охлаждается. Если же газ нагревается, то эффект отрицательный.
Существование эффекта Джоуля–Томсона является следствием отступления свойств реальных газов от модели идеального газа, а знак его зависит от того, какая из поправок Ван-дер-Ваальса ( 

Для установления связи знака эффекта Джоуля–Томсона с уравнением Ван-дер-Ваальса рассмотрим два предельных случая:
1) газ, для которого можно пренебречь поправкой 
2) газ, для которого можно пренебречь поправкой 
Поправка 



Следовательно, согласно выражению (13.6) температура газа увеличивается, т. е. 
Второй случай 

молекулами изображена на рис.130 б. Теперь при расширении газа потенциальная компонента внутренней энергии изменяется следующим образом:

(Знак минус перед скобками в этом выражении соответствует тому, что потенциальная энергия отрицательна)
Следовательно, в данном случае знак эффекта меняется, т. е.
График изотермического процесса. Основные термодинамические процессы
Главным предметом изучения термодинамики газовых систем является изменение термодинамических состояний. В результате таких изменений газ может совершать работу и запасать внутреннюю энергию. Изучим в приведенной ниже статье разные термодинамические переходы в идеальном газе. Особое внимание будет уделено изучению графика изотермического процесса.
Идеальные газы
Уже судя по самому названию, можно сказать, что 100-процентных идеальных газов в природе не существует. Однако многие реальные вещества удовлетворяют этой концепции с приемлемой для практики точностью.

Идеальным называется любой газ, в котором можно пренебречь взаимодействиями между его частицами и их размерами. Оба условия удовлетворяются только в том случае, если кинетическая энергия молекул будет намного превышать потенциальную энергию связей между ними, а расстояния между молекулами будут намного больше размеров частиц.
Чтобы определить, является ли изучаемый газ идеальным, можно воспользоваться простым эмпирическим правилом: если температура в системе выше комнатной, давление не сильно отличается от атмосферного или меньше него, а составляющие систему молекулы являются химически инертными, то газ будет идеальным.
Главный закон
Речь идет об уравнении идеального газа, которое также называется законом Клапейрона-Менделеева. Записано это уравнение было в 30-е годы XIX века французским инженером и физиком Эмилем Клапейроном. Спустя несколько десятилетий оно было приведено русским химиком Менделеевым к современному виду. Это уравнение имеет следующий вид:
В левой части равенства стоит произведение давления P на объем V, в правой части равенства — произведение температуры T на количество вещества n. Величина R — это универсальная газовая константа. Отметим, что T — это абсолютная температура, которая измеряется в кельвинах.
Закон Клапейрона-Менделеева впервые был получен из результатов предыдущих газовых законов, то есть в его основе лежала исключительно экспериментальная база. С развитием современной физики и кинетической теории текучих сред уравнение идеального газа может быть выведено из рассмотрения микроскопического поведения частиц системы.
Изотермический процесс
Независимо от того, происходит этот процесс в газах, в жидкостях или твердых телах, он имеет вполне четкое определение. Изотермическим называется такой переход между двумя состояниями, при котором температура системы сохраняется, то есть остается неизменной. Поэтому графиком изотермического процесса в осях времени (ось x) — температуры (ось y) будет горизонтальная линия.
Касательно газа идеального отметим, что изотермический переход для него называется законом Бойля-Мариотта. Обнаружен этот закон был экспериментальным путем. Причем он стал первым в этой области (вторая половина XVII века). Его может получить каждый школьник, если рассмотрит поведение газа в закрытой системе (n = const) при постоянной температуре (T = const). Пользуясь уравнением состояния, получаем:
Последнее равенство представляет собой закон Бойля-Мариотта. В учебниках по физике можно также встретить такую форму его записи:
При переходе из изотермического состояния 1 в термодинамическое 2 произведение объема на давление остается постоянным для закрытой газовой системы.
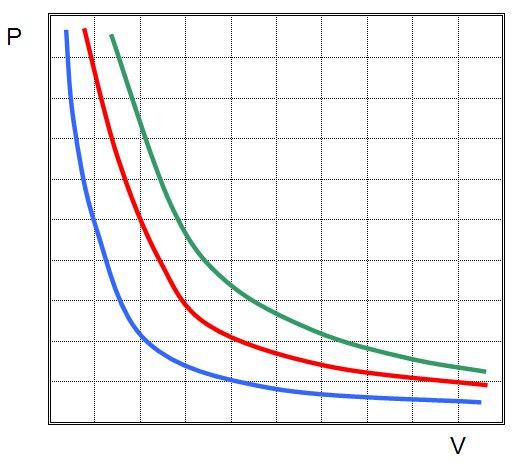
Изучаемый закон говорит об обратной пропорциональности между величинами P и V:
Это означает, что графиком изотермического процесса в идеальном газе будет кривая гипербола. Три гиперболы изображены на рисунке ниже.
Каждая из них называется изотермой. Чем выше температура в системе, тем дальше от осей координат будет стоять изотерма. Из рисунка выше можно сделать вывод, что зеленая соответствует самой высокой температуре в системе, а синяя — самой низкой при условии, что количество вещества во всех трех системах является одинаковым. Если же все изотермы на рисунке построены для одной температуры, то это означает, что зеленая кривая соответствует самой большой в плане количества вещества системе.
Изменение внутренней энергии при изотермическом процессе
В физике идеальных газов под внутренней энергией понимают энергию кинетическую, связанную с вращательным и поступательным движением молекул. Из кинетической теории несложно получить следующую формулу для внутренней энергии U:
U = z / 2 * n * R * T.
Где z — это число степеней свободного движения молекул. Оно изменяется от 3 (одноатомный газ) до 6 (многоатомные молекулы).
В случае процесса изотермического температура остается постоянной, значит, единственной причиной изменения внутренней энергии является выход или приход в систему частиц вещества. Таким образом, в закрытых системах во время изотермического изменения их состояния внутренняя энергия сохраняется.
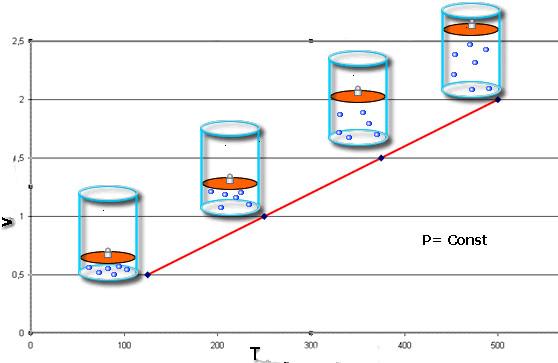
Изобарный и изохорный процессы
Помимо закона Бойля-Мариотта, существуют еще два основных газовых закона, которые также были открыты экспериментальным путем. Они носят фамилии французов Шарля и Гей-Люссака. Математически их записывают так:
V / T = const при P = const;
P / T = const при V = const.
Закон Шарля говорит о том, что во время изобарного процесса (P = const) объем линейно зависит от абсолютной температуры. Закон Гей-Люссака свидетельствует о линейной зависимости между давлением и абсолютной температурой при изохорном переходе (V = const).
Из приведенных равенств следует, что от процесса изотермического графики изобарного и изохорного переходов отличаются существенным образом. Если изотерма имеет форму гиперболы, то изобара и изохора являются прямыми линиями.
Изобарно-изотермический процесс
Рассматривая газовые законы, иногда забывают, что, помимо величин T, P и V, также может изменяться и величина n в законе Клапейрона-Менделеева. Если зафиксировать давление и температуру, то мы получим уравнение изобарно-изотермического перехода:
n / V = const при T = const, P = const.
Линейная зависимость между количеством вещества и объемом говорит о том, что при одинаковых условиях разные газы, содержащие одно и то же количество вещества, занимают равные объемы. Например, при нормальных условиях (0 oC, 1 атмосфера) молярный объем любого газа составляет 22,4 литра. Рассмотренный закон называется принципом Авогадро. Он лежит в основе закона Дальтона об идеальных газовых смесях.
http://pandia.ru/text/80/172/23046.php
http://1ku.ru/obrazovanie/57273-grafik-izotermicheskogo-processa-osnovnye-termodinamicheskie-processy/