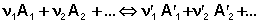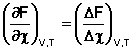Уравнение изотермы химической реакции это
ЛЕКЦИЯ № 5. Химическое равновесие
1. Понятие химического равновесия. Закон действующих масс
При протекании химической реакции через некоторое время устанавливается химическое равновесие. Существует два признака химического равновесия: кинетический, термодинамический. В кинетическом – ?пр = ?обр, в термодинамическом – характеризует химическую реакцию при условиях P, t – const (?G = 0); при условиях V, Т – const (?F = 0).
Химический потенциал – функция, которая характеризует состояние i-го компонента при определенных внешних условиях.
где n1 – число молей i-го компонента.
Если к бесконечно большому количеству раствора прибавить определенное количество какого-нибудь компонента, то химический потенциал системы определяется изменением изобарного потенциала при изобарных условиях или изменением изохорного потенциала при изохорных условиях.
Химический потенциал зависит от концентрации данного компонента
где Рi– парциальное давление – вклад каждого компонента в общее давление или давление, которое компонент имел бы, если бы находился в смеси.
Парциальное давление – элементарная функция (можно складывать). Пример (O2, N2, H2) – их общее давление
?0– значение химического потенциала при стандартных условиях.
Химический потенциал характеризует способность данного компонента выходить из данной фазы путем испарения, растворения, кристаллизации и т. д. Переход этот происходит произвольно.
В результате химического равновесия скорость прямой реакции уменьшается, а скорость обратной реакции увеличивается.
Концентрации, которые соответствуют химическому равновесию, называются равновесными концентрациями. Связь между равновесными концентрациями устанавливается законом действующих масс (ЗДМ). Этот закон в 1867 г. вывели К. М. Гульберг и П. Вааге.
Кинетический вывод ЗДМ
f – фугитивность – парциальное давление для реальных газов. Возникает вопрос, будут ли равняться Кpи Кс.
Кpи Кc– отличаются на RT ?vi в сумме стехиометрических коэффициентов.
если ?vi = 0, то Kp = Kc. ?vi = 1 + 1 – 1 – 1 =0 – когда стехиометрический коэффициент = 1.
2. Уравнение изотермы химической реакции
Если реакция протекает обратимо, то ?G= 0.
Если реакция протекает необратимо, то ?G? 0 и можно рассчитать изменение ?G.
где ? – пробег реакции – величина, которая показывает, сколько молей изменилось в ходе реакции. I сп – характеризует равновесное и неравновесное состояние реакции, II сп – характеризует только неравновесные состояния.
это уравнение изотермы химической реакции.
С помощью уравнения изотермы химической реакции можно судить о направлении протекания реакции.
3. Уравнения изохоры, изобары химической реакции
Зависимость К от температуры
По ним судят о направлении протекания реакции:
4. Расчет KP (метод Темкина-Шварцмана)
термодинамический метод расчета Kp.
Пример. Расчет Kp для реакции PbS04 распадается на РbО и S03.
Результаты вычислений занесены в таблицу 2.
5. Расчет равновесного состава химического равновесия
Равновесный состав можно рассчитать только для газовой системы
Исходная концентрация всех компонентов
Изменение каждого компонента по числу молей (или стехиометрическому коэффициенту):
??– (пробег реакции) – химическая переменная.
Она показывает изменение количества вещества по числу молей. Если реакция не началась, то ?? = 0. Если количество исходных веществ превратилось в такое же количество продуктов реакции, то ?? = 1.
Рассчитать равновесный состав по третьему компоненту при условии, что А = а моль/л; В = в моль/л.
Рассчитываем по 4 компоненту:
Газообразные вещества реагируют по уравнению:
Найти парциальное давление каждого компонента.
Вещества А и В превращаются в С в количестве Х. Исходные вещества А= 2 моль, В= 1 моль.
Для того, чтобы найти парциальное давление, мы должны Роб умножить на мольную долю. Мольная доля определяется отношением числа молей каждого компонента, отнесенного к общему числу молей всех компонентов.
где En – общее число молей, участвующих в этой газовой смеси.
где РА – парциальное давление.
Уравнение изотермы химической реакции
Для решения принципиальной возможности или невозможности того или иного физико-химического процесса необходимо, прежде всего, установить, является ли интересующая нас система при данных условиях (при данных температуре, давлении, концентрации) равновесной или неравновесной. Если система неравновесна, следует выяснить, по какую сторону от равновесия находится система и насколько она удалена от него.
В изобарно-изотермических процессах состояние равновесия или степень отклонения от него определяют по знаку и величине изменения изобарного потенциала ΔG, которое рассчитывают по уравнению изотермы химической реакции или уравнению Вант — Гоффа:
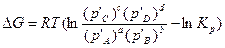
где 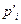
Для изохорно-изотермических процессов состояние равновесия или степень отклонения от него определяют по знаку и величине изменения изохорного потенциала ΔF. Уравнение изотермы запишем, используя концентрации веществ:
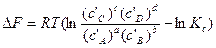
Так как в стандартном состоянии активности веществ принимают равными единице аi=1, то в общем случае стандартное изменение изобарного потенциала:
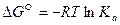
и 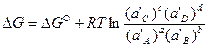
Знак ΔG показывает, по какую сторону от равновесия находится система в данном состоянии, и по нему можно судить о направлении процесса.
Если ΔG G2. Процессы самопроизвольно идут только в сторону меньшего значения потенциала, и реакция будет протекать только вправо (прямое течение). Если ΔG >0, то в системе возможно обратное течение процесса – справа налево согласно записи уравнения химической реакции.
Абсолютная величина │ΔG│ тем больше, чем сильнее отличаются фактические и равновесные концентрации реагентов. Абсолютная величина │ΔG│ является мерой отклонения рассматриваемой системы от равновесия.
Эта же величина является мерой химического сродства, то есть способности веществ вступать между собой в химическое взаимодействие при определённых температуре, давлении и заданном соотношении концентрации реагентов.
Химическое сродство характеризует только стремление к взаимодействию, основанному на разности потенциалов, но ничего не говорит о возможности реализации процессов, об их скорости и пути протекания.
Для сопоставления химического сродства элементов в различных реакциях принимают, что все реагенты находятся в стандартном состоянии при данной температуре, то есть газы считаются идеальными и каждый из них находиться под давлением 1,01·10 5 Па (1атм), а конденсированные вещества в чистом виде берутся в их реальном устойчивом состоянии при той же температуре и при общем давлении 1,01·10 5 Па (1 атм).
Выбор стандартного состояния может быть произвольным. Важно, что при этом активности веществ принимаются равными единице аi=1.
Зная изменение изобарного потенциала процесса в стандартных условиях, можно определить константу равновесия химической реакции из уравнения (41):
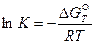
где 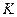
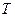
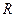
Если 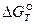
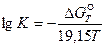
На практике часто используется уравнение, в котором изменение стандартного изобарного потенциала реакции выражено через изменения энтальпии и энтропии (29):
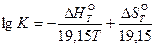
В состоянии равновесия 
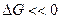
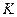
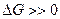
Дата добавления: 2016-02-04 ; просмотров: 929 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Уравнение изотермы химической реакции это
Кафедра физической и коллоидной химии ЮФУ
Материалы к лекциям для студентов химфака
Термодинамический вывод выражения для константы равновесия
Теперь рассмотрим более строгий термодинамический вывод выражения для константы равновесия. Для этого необходимо ввести понятие химический потенциал . Очевидно, что величина свободной энергии системы будет зависеть как от внешних условий, так и от природы и количества веществ, составляющих систему. В случае если количества веществ изменяются в ходе процесса, изобарно-изотермический потенциал является функцией не только температуры и давления, но и количеств веществ:
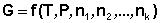
Для изохорно-изотермического потенциала имеем:
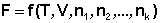
При введении в некоторую систему бесконечно малого количество dni молей i-го компонента произойдёт изменение термодинамического потенциала системы на величину 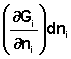
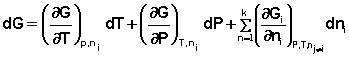
Аналогичным образом для полного дифференциала F получаем:
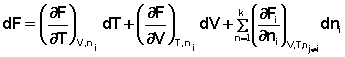
Частная производная термодинамического потенциала по числу молей компонента i-го компонента при постоянных количествах остальных компонентов есть химический потенциал μ i данного компонента в системе:
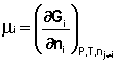
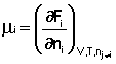
Иначе говоря, химический потенциал i-го компонента равен приращению свободной энергии системы при добавлении одного моля данного компонента к большому объёму системы при постоянных температуре и давлении (объёме). Понятие «большой объём системы» означает, что состав системы практически не изменяется после добавления одного моля компонента. Химический потенциал чистого вещества равен свободной энергии одного моля этого вещества.
Учитывая вышесказанное, уравнения (12-13) можно переписать в виде:
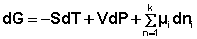
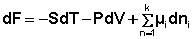
При постоянстве температуры и давления (температуры и объёма) два первых слагаемых в уравнениях (16-17) обратятся в нуль. При этом получаем:
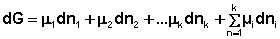
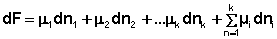
Поскольку условием равновесия является минимум свободной энергии системы (dG = 0, dF = 0), для состояния равновесия можно записать:
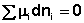
Для вывода соотношения между парциальными давлениями либо концентрациями компонентов в равновесной смеси воспользуемся данным общим условием равновесия через химические потенциалы. Получим выражение для изменения свободной энергии при протекании в системе химической реакции:
В закрытой системе изменение числа молей одного компонента сопровождается изменением числа молей остальных компонентов, пропорциональным стехиометрическим коэффициентам, взятым с соответствующим знаком («–» для исходных веществ, «+» для продуктов реакции); т.е., для приведенной выше химической реакции имеет место соотношение:
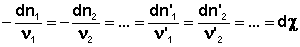
Здесь χ – т.н. химическая переменная , характеризующая только данную химическую реакцию. Поскольку dni = ν id χ , для полного дифференциала G можно записать следующее выражение:
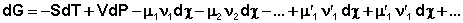
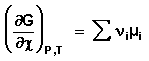
Для системы, находящейся в состоянии равновесия получаем
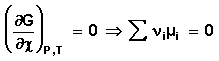
Выражение (24) носит название уравнения Гиббса – Дюгема . Для получения изотермы химической реакции нам следует выразить химический потенциал компонента через его парциальное давление или концентрацию. Если химическая реакция проводится при постоянной температуре, то выражение
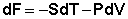
для полного дифференциала свободной энергии Гельмгольца преобразуется к виду dF = – PdV. Для одного моля идеального газа получаем:
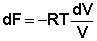
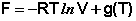
Здесь g(T) – постоянная интегрирования, представляющая собой некоторую функцию от температуры. Поскольку для одного моля идеального газа величина, обратная объёму, есть молярная концентрация, данное выражение преобразуется к виду:
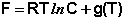
Как было показано ранее, для одного моля чистого вещества μ = F. Получаем:
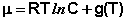
Для каждого из нескольких веществ в смеси можно записать
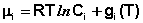
Для стандартных условий (Сi = 1 моль/л) gi(T) = μ °i (стандартный химический потенциал). Окончательно получаем уравнение, связывающее химический потенциал компонента с его концентрацией:
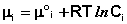
Аналогичным образом можно получить
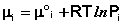
Подставив зависимость химического потенциала от парциального давления в уравнение (26), для состояния равновесия получаем:
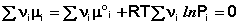
Для системы, находящейся в изохорно-изотермических условиях, аналогично получаем
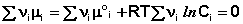
В уравнениях (33-34) Pi и Ci – равновесные парциальные давления и концентрации соответственно. Поскольку Σν i μ °i = const, получаем:
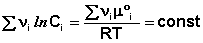
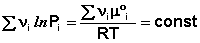
Для обсуждаемой химической реакции
выражения (35) и (36) можно преобразовать к виду
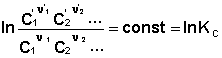
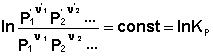
Потенцируя данные выражения, получаем, что в состоянии равновесия произведение концентраций либо парциальных давлений реагентов, взятых в степенях, равных стехиометрическим коэффициентам, при постоянной температуре есть некоторая постоянная величина – константа равновесия.
Изотерма химической реакции (изотерма Вант-Гоффа)
При самопроизвольном протекании химической реакции изменение свободной энергии системы отлично от нуля (ΔG χ , т.е. принять, что
Положив Δ χ = 1, получаем

Поскольку, как следует из (35,37), 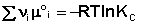
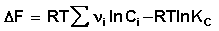
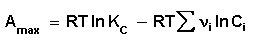
Для изобарно-изотермического процесса аналогичным образом можно получить:
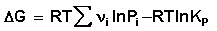
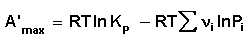
Уравнение изотермы Вант-Гоффа позволяет рассчитать максимальную работу химической реакции и тем самым определить возможность её самопроизвольного протекания в каких-либо конкретных условиях (при температуре Т и концентрациях реагентов Ci или парциальных давлениях Pi).
Copyright © В. В. Луков, С. И. Левченков, 2005.
http://helpiks.org/6-83437.html
http://physchem.chimfak.sfedu.ru/Source/Phys/physchem_23.htm