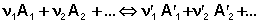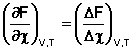Уравнение изотермы химической реакции при постоянном давлении
Большинство химических реакций протекают одновременно в двух направлениях: в сторону образования продуктов реакции (прямая реакция) и в сторону разложения последних (обратная реакция). Вследствие химической обратимости реакции не доходят до конца. Скорость прямой реакции уменьшается, а скорость обратной, напротив, возрастает. Когда эти скорости выравниваются наступает состояние химического равновесия.
Так как химически обратимые реакции до перехода в равновесное состояние протекают с конечными скоростями, то с точки зрения термодинамики они не обратимы. Однако можно мысленно представить, что эти реакции идут бесконечно медленно через смежные равновесные состояния. Тогда к ним можно применить общие условия термодинамического равновесия.
Для гомогенных обратимых реакций экспериментально Гульбергом и Ваге был установлен закон действующих масс. При постоянной температуре отношение произведения равновесных концентраций (или парциальных давлений) продуктов реакции к произведению равновесных концентраций (или парциальных равновесий) исходных веществ есть величина постоянная.
Этот экспериментально установленный закон может быть получен методом термодинамических потенциалов. Рассмотрим реакцию в газовой фазе:
аА(г) + b В ↔ сС + dD
Когда система достигает термодинамического равновесия, то термодинамический потенциал при фиксированных естественных переменных достигает минимума. Равновесие, таким образом, можно охарактеризовать выражением химических потенциалов, когда потенциалы продуктов реакции сравняются с потенциалами исходных веществ:
с μ ( с ) + d μ (D) – a μ (a) — b μ (b) = 0 (6 – 1)
Если естественными переменными являются p и T , то 


Отсюда для систем, подчиняющихся закону идеальных газов, можно получить выражения для μ i
μ i = μ i ° + RTlnCi (6 – 2) 
где μ i ° — стандартный химический потенциал.
Подставляется (6 – 2) в (6 – 1) и перенося постоянные величины в левую часть, получаем
сμ C ° + d μ D ° — a μ A ° — b μ B ° = — RTln 

Поскольку в левой части выражение не зависит от концентраций, то выражение под логарифмом является постоянной величиной при постоянной температуре:

Для идеального газа парциальные давления пропорциональны концентрациям, поэтому константа равновесия может быть всегда выражена через равновесные парциальные давления:
Аналогично может быть записано выражение через мольные доли:
Для идеальных газов эти константы связаны между собой соотношением:
где
Следует обратить внимание, что в полученных соотношениях только KN зависит от общего давления. Она позволяет нам оценивать сдвиг равновесия в газовых реакциях при изменении общего давления. Следует иметь в виду, что давление в этих выражениях складывается из парциальных давлений компонентов системы и не учитывает влияние инертных газов, если они присутствуют в реакционной смеси. Естественно инертный газ «разбавляет» компоненты реакционной смеси и поэтому влияет на KN .
Из уравнения (6 – 3) вытекает связь константы равновесия с ∆ rG °:

Это уравнение было впервые получено Вант – Гофором методом циклов и получило название уравнения изотермической химической реакции. Очевидно, в этом уравнении ∆ rGT ° относится к этой температуре, при которой определена Кр. Уравнение изотермической химической реакции позволяет определить константу равновесия при заданных условиях не прибегая к исследованию равновесия. Величина ∆ rGT ° может быть рассчитана на основе термических констант для индивидуальных веществ.
Если заданы концентрации (парциальные давления) отличные от равновесных, то можно записать более общий вид уравнения изотермической химической реакции:
Это выражение позволяет определить направление самопроизвольного процесса.
Уравнение изотермы химической реакции позволяет получить выражение для температурной зависимости константы равновесия.
Запишем уравнение Гиббса – Гельмгольца:
Подставим выражение для 

Дифференцируем уравнение (6 – 5)


Из уравнения (6 — 5´) получаем уравнение изобары химической реакции:

Если проинтегрировать уравнение (6 – 6) в предположении, что ∆ rHT ° не зависит от температуры, то получим уравнение:
где С – константа интегрирования.
Уравнение (6 – 7) хорошо выполняется в узких интервалах температур и позволяет определить ∆ rGT °.
Для широких интервалов температур ln K р представляют в виде степенных рядов или других аналитических формах:
Такие выражения позволяют рассчитать все термодинамические функции для процессов, для которых данные зависимости получены.
Выражения для термодинамических потенциалов, полученные для идеального газа. Для реальных газов, а особенно для газовых растворов возникают затруднения. Это связано с тем, что расчет концентраций и давлений должен быть проведен исходя из уравнения состояния. Однако для реальных систем единое достаточно простое уравнение состояния получить не удалось.
В связи с этим в термодинамике реальных систем применяется эмпирический метод, предложенный Льюисом. Льюис предложил в уравнениях термодинамики, полученных для идеальных систем заменить давления p на величину летучести f , а концентрации С на активности a .
При такой замене выражения для констант равновесия не меняются по форме. Но этот прием позволяет связать экспериментально найденные свойства реального газа с термодинамическими параметрами.
Летучести и активности – это экспериментальные величины, которые находятся из условия, что для раствора при бесконечном разбавлении или газа при давлении стремящимся к 0 активность приближается к аналитической концентрации, а летучесть к реальному давлению идеального газа. Исходя из этой посылки рассчитываются активности и летучести.
При 1273 К и общем равновесии 30 атм. В равновесной системе




В соответствии с законом Авогадро, объёмный процент равен мольному проценту. Следовательно, 
Отсюда находим
В отличие от 




Для 25% 
Следовательно,
При 2000°С и общем давлении 1 атм. 2% воды диссоцииовано на водород и кислород. Рассчитайте константу равновесия реакции 
Смеси. Уравнение изотермы химической реакции
Максимальная работа реакции, идущей в газовой фазе при постоянных температуре и давлении, является алгебраической суммой работ, совершённых всеми участвующими в реакции веществами при переходе от начальных парциальных давлений к равновесным.
Рассмотрим газовую реакцию, выражаемую в общем виде уравнением
aA + bB Û dD + eE.
Давление р в системе с помощью уравнения Менделеева — Клапейрона может быть выражено через объём V и температуру T:
p = nRT/V ,
откуда, принимая, что суммарное число молей всех компонентов равно 1, получаем для работы расширения
pdV = (RT/V)dV ,
Так как максимальная полезная работа может быть вычислена при интегрировании выражения: V2
w’max = ò pdV ,
где p1 — давление исходной газовой смеси, р2 — равновесное давление.
Заменяя ln р1 суммой логарифмов начальных парциальных давлений, а ln p2 — суммой логарифмов равновесных парциальных давлений веществ, получим:
w’max = RT [(ln pD d равн + ln pE e равн — ln pA a равн — ln pB b равн) —
| рD d рЕ e рD d рЕ e w’max = RT [ln(¾¾¾¾)равн — ln(¾¾¾¾)нач], рA a рB b рA a рB b |
| рD d рЕ e w’max = RT [ln Кр — ln(¾¾¾¾)нач], (4.1) рA a рB b |
а так как w’max = —DGr ,
то можно записать:
| рD d рЕ e DGr = —RT [ln Кр — ln(¾¾¾¾)нач], (4.2) рA a рB b |
Для процессов, идущих при постоянном объёме, можно получить аналогичные выражения, в которые входит максимальная работа и изменение энергии Гельмгольца в ходе реакции. При этом парциальные давления заменяются начальными концентрациями веществ:
| СD d СЕ e wmax = RT [ln Кс — ln(¾¾¾¾)нач], (4.3) СA a СB b |
| CD d CЕ e DAr = —RT [ln Кc — ln(¾¾¾¾)нач], (4.4) CA a CB b |
Уравнения (4.1) — (4.4), выведенные Я.Вант-Гоффом, называются уравнениями изотермы химической реакции. Они дают возможность определить, в каком направлении и до какого предела может протекать реакция в рассматриваемых условиях при заданном составе реакционной смеси при постоянной температуре.
Для стандартных условий, когда исходные парциальные давления (или исходные концентрации или активности) всех веществ-участников реакции равны единице, уравнения изотермы будут выглядеть так:
w’max = RT ln Kp ; DG o r = — RT ln Kp (4.5)
wmax = RT ln Kс ; DА o r = — RT ln Kс .
Отсюда следует, что определяя стандартную величину DG o r или DА o r для реакции, можно легко вычислить её константу равновесия. (Способ расчёта DG o r и DА o r был показан в п. 3.8).
Влияние температуры на равновесие. Уравнения изобары
Уравнение изотермы химической реакции при постоянном давлении
Кафедра физической и коллоидной химии ЮФУ
Материалы к лекциям для студентов химфака
Термодинамический вывод выражения для константы равновесия
Теперь рассмотрим более строгий термодинамический вывод выражения для константы равновесия. Для этого необходимо ввести понятие химический потенциал . Очевидно, что величина свободной энергии системы будет зависеть как от внешних условий, так и от природы и количества веществ, составляющих систему. В случае если количества веществ изменяются в ходе процесса, изобарно-изотермический потенциал является функцией не только температуры и давления, но и количеств веществ:
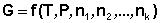
Для изохорно-изотермического потенциала имеем:
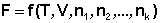
При введении в некоторую систему бесконечно малого количество dni молей i-го компонента произойдёт изменение термодинамического потенциала системы на величину 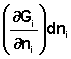
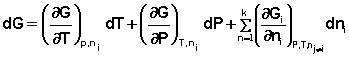
Аналогичным образом для полного дифференциала F получаем:
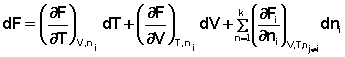
Частная производная термодинамического потенциала по числу молей компонента i-го компонента при постоянных количествах остальных компонентов есть химический потенциал μ i данного компонента в системе:
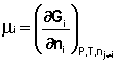
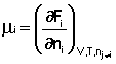
Иначе говоря, химический потенциал i-го компонента равен приращению свободной энергии системы при добавлении одного моля данного компонента к большому объёму системы при постоянных температуре и давлении (объёме). Понятие «большой объём системы» означает, что состав системы практически не изменяется после добавления одного моля компонента. Химический потенциал чистого вещества равен свободной энергии одного моля этого вещества.
Учитывая вышесказанное, уравнения (12-13) можно переписать в виде:
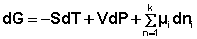
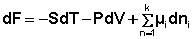
При постоянстве температуры и давления (температуры и объёма) два первых слагаемых в уравнениях (16-17) обратятся в нуль. При этом получаем:
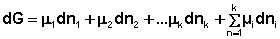
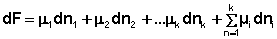
Поскольку условием равновесия является минимум свободной энергии системы (dG = 0, dF = 0), для состояния равновесия можно записать:
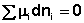
Для вывода соотношения между парциальными давлениями либо концентрациями компонентов в равновесной смеси воспользуемся данным общим условием равновесия через химические потенциалы. Получим выражение для изменения свободной энергии при протекании в системе химической реакции:
В закрытой системе изменение числа молей одного компонента сопровождается изменением числа молей остальных компонентов, пропорциональным стехиометрическим коэффициентам, взятым с соответствующим знаком («–» для исходных веществ, «+» для продуктов реакции); т.е., для приведенной выше химической реакции имеет место соотношение:
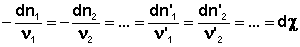
Здесь χ – т.н. химическая переменная , характеризующая только данную химическую реакцию. Поскольку dni = ν id χ , для полного дифференциала G можно записать следующее выражение:
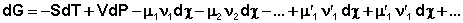
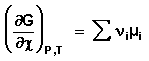
Для системы, находящейся в состоянии равновесия получаем
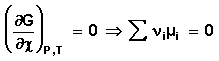
Выражение (24) носит название уравнения Гиббса – Дюгема . Для получения изотермы химической реакции нам следует выразить химический потенциал компонента через его парциальное давление или концентрацию. Если химическая реакция проводится при постоянной температуре, то выражение
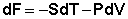
для полного дифференциала свободной энергии Гельмгольца преобразуется к виду dF = – PdV. Для одного моля идеального газа получаем:
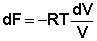
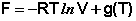
Здесь g(T) – постоянная интегрирования, представляющая собой некоторую функцию от температуры. Поскольку для одного моля идеального газа величина, обратная объёму, есть молярная концентрация, данное выражение преобразуется к виду:
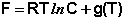
Как было показано ранее, для одного моля чистого вещества μ = F. Получаем:
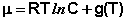
Для каждого из нескольких веществ в смеси можно записать
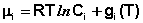
Для стандартных условий (Сi = 1 моль/л) gi(T) = μ °i (стандартный химический потенциал). Окончательно получаем уравнение, связывающее химический потенциал компонента с его концентрацией:
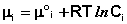
Аналогичным образом можно получить
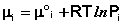
Подставив зависимость химического потенциала от парциального давления в уравнение (26), для состояния равновесия получаем:
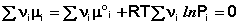
Для системы, находящейся в изохорно-изотермических условиях, аналогично получаем
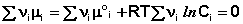
В уравнениях (33-34) Pi и Ci – равновесные парциальные давления и концентрации соответственно. Поскольку Σν i μ °i = const, получаем:
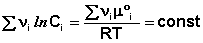
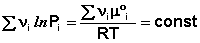
Для обсуждаемой химической реакции
выражения (35) и (36) можно преобразовать к виду
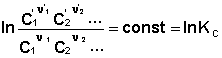
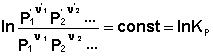
Потенцируя данные выражения, получаем, что в состоянии равновесия произведение концентраций либо парциальных давлений реагентов, взятых в степенях, равных стехиометрическим коэффициентам, при постоянной температуре есть некоторая постоянная величина – константа равновесия.
Изотерма химической реакции (изотерма Вант-Гоффа)
При самопроизвольном протекании химической реакции изменение свободной энергии системы отлично от нуля (ΔG χ , т.е. принять, что
Положив Δ χ = 1, получаем

Поскольку, как следует из (35,37), 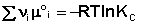
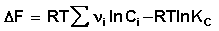
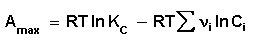
Для изобарно-изотермического процесса аналогичным образом можно получить:
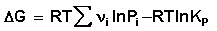
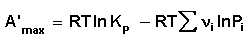
Уравнение изотермы Вант-Гоффа позволяет рассчитать максимальную работу химической реакции и тем самым определить возможность её самопроизвольного протекания в каких-либо конкретных условиях (при температуре Т и концентрациях реагентов Ci или парциальных давлениях Pi).
Copyright © В. В. Луков, С. И. Левченков, 2005.
http://helpiks.org/6-61897.html
http://physchem.chimfak.sfedu.ru/Source/Phys/physchem_23.htm