Уравнение карплюса и эффект оверхаузера
2. 1D selective NOESY
С помощью селективного воздействия на выбранную группу протонов позволяет получить информацию о ближайших соседях в пространстве.
3. 1 H с преднасыщением сигнала, 1H WATERGATE, WEFT
Позволяют подавить интенсивные сигналы растворителя (например H2O), что приводит к увеличению чувствительности для слабых сигналов.
1 Н с преднасыщением сигнала – методика подавления сигнала, в которой перед аквизицией резонансные переходы ядер растворителя насыщаются при помощи длительного селективного импульса малой мощности (продолжительного облучения в течение времени порядка времени релаксации T1 растворителя).
При помощи этой методики можно подавлять и несколько линий, если растворитель имеет не одну резонансную линию. Недостатком методики является то, что воздействие может происходить не только на линию растворителя, но и на соседние с ним.
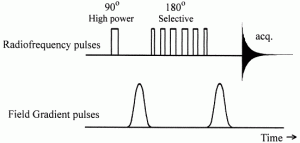
1 Н WATERGATE (GrAdient Tailored Excitation) — это методика для подавления сигналов при помощи специального градиентного возбуждения. Она позволяет подавить, например, сигнал воды в водных растворах веществ. В отличие от методики преднасыщения, в которой воздействие осуществляется длительным маломощным импульсом, эта методика основана на методе градиентного спинового эха.
Импульсная последовательность показана на рисунке:
[Garry S.H. Lee, Michael A. Wilson, Brent R. Young, Organic Geochemistry, V. 28 (9–10), 1998, 549.]
По своей сути — это импульсная последовательность спинового эха Хана PGSE с короткой задержкой «τ», в которой обычный 180° импульс заменен селективным 180° импульсом, инвертирующим все резонансные линии кроме линий растворителя. 180° импульс не влияет на когерентность спинов ядер растворителя созданную 90° импульсом, и поэтому она разрушается под действием набегающей расфазировки от двух градиентных импульсов. Для остальных линий расфазировка от двух градиентных импульсов компенсируется.
Применение селективного 180° импульса может вызвать значительные возмущения фазы в спектре. Простым удвоением последовательности
можно избежать этого эффекта (здесь g1,2 – градиентные импульсы, S – селективный 180° импульс).
Результаты подавления видны на рисунке:
WEFT (Water Eliminated Fourier Transform) – это специфическая методика для подавления нежелательных сигналов. Когда растворитель и растворенное вещество имеют различные времена спин-решеточной релаксации, подавление линий от растворителя может быть достигнуто при использовании последовательности «инверсия-восстановление» с задержкой между 180° и 90° импульсом равной τ = ln(2)T1 Solvent . Такая задержка соответствует нулевой точке на кривой восстановления макроскопической намагниченности для резонансных линий растворителя. Эффективное подавление линий растворителя без воздействия на линии растворенного вещества может быть достигнуто при условии того, что время релаксации для первого намного больше чем для второго T1 Solvent >> T1 Solute .
4. HXCORR
Спектры ядер X с развязкой от протонов, где X – ядро из диапазона 31 P- 15 N или 19 F. Предоставляют информацию о химических сдвигах для ядер X.
5. 13C <1H>INVGATE
Спектры ядер X с развязкой от протонов, где X – ядро из диапазона 31 P- 15 N или 19 F. Предоставляют информацию о химических сдвигах и интегральных интенсивностях сигналов для ядер X.
Спектры ядер X с развязкой от протонов, но без усиления сигналов за счет ядерного эффекта Оверхаузера. В этом случае интегральные интенсивности сигналов пропорциональны количеству соответствующих ядер Х.
6. X
Спектры ядер X без развязки от протонов, где X – ядро из диапазона 31 P- 15 N или 19 F. Предоставляют информацию о химических сдвигах и значениях констант спин-спинового взаимодействия JXH для ядер X.
Данная методика позволяет получить спектр Х ядра без развязки от протонов, но с интенсивностью сигналов, увеличенной за счет ядерного эффекта Оверхаузера.
7. 13С DEPT, APT
Позволяют различить сигналы четвертичных атомов углерода, CH, CH2 и CH3 групп.
Эксперимент DEPT (Distortionless Enhancement by Polarization Transfer) позволяет различить сигналы четвертичных, метиновых, метиленовых и метильных атомов углерода в спектре 13С.
В зависимости от мультиплетности сигналы могут иметь положительную или отрицательную интенсивность. Наиболее часто используемой разновидностью эксперимента DEPT является DEPT135, в котором сигналы метиленовых атомов углерода — имеют отрицательную интенсивность, метиновых и метильных — положительную, а сигналы атомов углерода, непосредственно не связанных с протонами, не проявляются. В спектре DEPT90 проявляются только сигналы метиновых атомов углерода, а в спектре DEPT45 четвертичные атомы углерода не проявляются, а сигналы остальных — положительны.
Эксперимент DEPT, как правило, используется совместно с экспериментом 13 С с полным подавлением констант спин-спинового взаимодействия ( 13 С < 1 Н>эксперимент). Из анализа спектров 13 С с подавлением, DEPT135 и DEPT90 можно сделать выводы о мультиплетности всех атомов углерода в молекуле.
В результате переноса поляризации с протонов на атомы углерода в ходе эксперимента DEPT чувствительность этого метода оказывается примерно в четыре раза выше чувствительности стандартного эксперимента 13 С с полным подавлением, а также эксперимента APT (Attached Proton Test).
Эксперимент DEPT менее критичен к точности выбора значения прямой константы С-Н, используемой для вычисления одной из задержек в импульсной последовательности, чем эксперимент INEPT. Эта особенность удобна при анализе структур, содержащих атомы углерода различной природы, константы С-Н которых, соответственно, варьируются в широких пределах.
Аналог методики DEPT, но в отличии от неё позволяет наблюдать сигналы четвертичных атомов углерода (а)
8. 13С INADEQUATE
Предоставляют информацию о значениях констант спин-спинового взаимодействия JCC. Из-за низкой чувствительности требуется высокая концентрации образца для немеченных соединений.
Позволяет получить информацию о строении углеродного скелета молекулы на основании значений констант спин-спинового взаимодействия между соседними атомами углерода. Чрезвычайно низкая чувствительность данного метода требует очень высоких концентраций образцов и длительного времени эксперимента.
9. DOSY
Позволяет выделить спектры индивидуальных соединений из смесей, но только в случае достаточного различия в коэффициентах диффузии.
D эксперименты ЯМР. Ядерный эффект Оверхаузера. Быстрые методы регистрации спектров ЯМР. Перенос насыщения
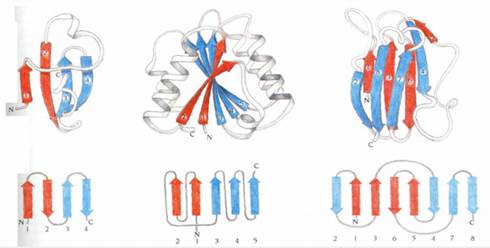
Доменная структура белков. Диаграммы топологии.
Длинные полипептидные цепи (длиной около 200 аминокислотных остатков или больше) обычно имеют доменную пространственную структуру. Доменом называют часть пептидной цепи, образующей как бы самостоятельную глобулу, причем на одной пептидной цепи может быть два или больше доменов.
Что такое домен?
• Домен – это часть полипептидной цепи (или вся цепочка) , которая сворачивается независимо в стабильную третичную структуру
• Доменами в белках называют области в третичной структуре, которым свойственна определенная автономия структурной организации. Нередко, хотя и не всегда, структурная автономия домена дополняется функциональной. Домены составляют подуровень структурной организации белка на пути от вторичной к третичной структуре.
Три основных класса структур белков: 1. α домен 2. β домен 3. α/β домен
Соседние участки в аминокислотной последовательности очень часто также оказываются близкорасположенными друг к другу в пространстве. Триозфосфат изомераза состоит из четырех β-α-β-α участков, которые также повторяются в аминокислотной последовательности (а) и трехмерной структуре (б)
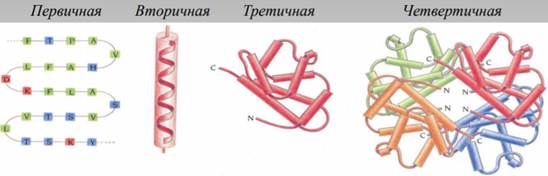
Третичная структура (или трёхмерная структура[1]) — пространственное строение (включая конформацию) всей молекулы белка или другой макромолекулы, состоящей из единственной цепи.
Третичной структурой белка называется способ укладки полипептидной цепи в пространстве. По форме третичной структуры белки делятся в основном на глобулярные и фибриллярные. Глобулярные белки чаще всего имеют эллипсовидную форму, а фибриллярные (нитевидные) белки — вытянутую (форма палочки, веретена).
Однако конфигурация третичной структуры белков еще не дает основания думать, что фибриллярные белки имеют только β-структуру, а глобулярные α-спиральные. Есть фибриллярные белки, имеющие спиральную, а не слоисто-складчатую вторичную структуру. Например, α-кератин и парамиозин (белок запирательной мышцы моллюсков), тропомиозины (белки скелетных мышц) относятся к фибриллярным белкам (имеют палочковидную форму), а вторичная структура у них — α-спираль; напротив, в глобулярных белках может быть большое количество β-структур.
Спирализация линейной полипептидной цепи уменьшает ее размеры примерно в 4 раза; а укладка в третичную структуру делает ее в десятки раз более компактной, чем исходная цепь.
Диаграммы топологии.
удобный инструмент классификации белков
| Элементы вторичной структуры соединяются неупорядоченными участкам Две α спирали соединены короткой петлей с определенным геометрическим расположением спираль-петля-спираль (а) или спираль-поворот-спираль (б). |   |
| Участок в виде β-шпильки Предположительный путь сворачивания шпильки в виде Греческого ключа. β нити 2 и 3 сворачиваются таким образом, что нить 2 антипараллельно располагается напротив нити 1. |  |
| Участок β-α-β содержит две параллельные β-нити β-α-β участок имеет два варианта расположения. Первый вариант это спираль расположенная над β-листом. Данный тип структуры присутствует почти во всех белках и называется правосторонним (а). Левосторонний вариант – когда спираль расположена под β-листом. Этот вариант встречается очень редко и обнаружен в единственной структуре субтилизина, где играет определенную специальную функцию. |  |
D эксперименты ЯМР. Ядерный эффект Оверхаузера. Быстрые методы регистрации спектров ЯМР. Перенос насыщения
Приложение ЯМР спектроскопии к исследованию белков
Большинство последних инноваций в ЯМР спектроскопии сделаны в так называемой ЯМР спектроскопии белков, которая становится очень важной техникой в современной биологии и медицине. Общей задачей является получение 3-мерной структуры белка в высоком разрешении, подобно изображениям, получаемым в рентгеновской кристаллографии. Из-за присутствия большего числа атомов в белковой молекулe в сравнении с простым органическим соединением, базовый 1H спектр переполнен перекрывающимися сигналами, поэтому прямой анализ спектра становится невозможным. Поэтому были разработаны многомерные техники, чтобы решить эту проблему.
Чтобы улучшить результаты этих экспериментов, применяют метод меченых атомов, используя 13С или 15N. Таким образом становится возможным получить 3D-спектр белкового образца, что стало прорывом в современной фармацевтике. В последнее время получают распространение методики(имеющие как преимущества, так и недостатки) получения 4D-спектров и спектров большей размерности, основанные на методах нелинейного семплирования с последующим восстановлением сигнала спада свободной индукции с помощью специальных математических методик.
1. Отнесение сигналов внутри спиновой системы каждого аминокислотного остатка – 3D HSQC-TOCSY
2. Попарное сочленение двух аминокислотных остатков по белковой цепи (последовательное отнесение) – 3D HSQC-NOESY
Химические сдвиги 1H, 13C, 15N, 19F, 31P
Интегральные интенсивности сигналов
Скорости обмена подвижных протонов на дейтерий
Константы спин-спинового взаимодействия (через химическую связь)
Ядерные эффекты Оверхаузера (взаимодейств. через пространство)
Ширины линий, времена релаксации ядер, кросс-релаксация
Константы диполь-дипольного взаимодействия
| Название эксперимента | Наблюдаемые атомы в 3D спектре |
| HNCA | C α i – N i — HN i C α i-1 – N i — HN i |
| HNCO | C’ i-1 – N i — HN i |
| HN(CO)CA | Cα i-1 – N i — HN i |
| HCACO | C’ i — Cα i — Hα i |
| CBCA(CO)NH HBHA(CO)NH | Сα , β i-1 – N i – HN i H α , β i-1 – N i – HN i |
| CBCANH | Сα , β i-1 – N i – HN i Сα , β i – N i – HN i |
| HNHB | Hβ i – N i — HN i |
| HNHA | Hα i – N i — HN i |
| 1 H, 15 N TOCSY-HSQC | Hα i – N i — HN i |
| HCCH-TOCSY | H α i – C α i – C i β , γ , δ , ε — H i β , γ , δ , ε H β i – C β i – C γ , δ , ε i — H γ , δ , ε i H γ i – C γ i – C δ , ε i — H δ , ε i |
Эффект Оверхаузера — увеличение поляризации ядерной магнитной системы и, как следствие, ядерного магнитного резонанса при насыщении электронного парамагнитного резонанса. Предсказан в 1953 г. А. Оверхаузером для взаимодействия спиновых систем электронов проводимости и ядер в металлах Ядерным эффектом Оверхаузера (ЯЭО) называется явление резкого изменения интенсивности сигнала ЯМР при взаимодействии спинов разных ядер, например X и Y. Увеличение интенсивности сигнала ядер X при резонансном облучении ядер Y тем сильнее, чем больше вклад магнитного диполь-дипольного взаимодействия ядер X и Y в релаксацию ядер X. Максимально возможное повышение интенсивности сигнала X в условиях полной развязки от ядер Y вычисляется по формуле:
<\displaystyle <\frac 
http://megaobuchalka.ru/17/29311.html