Анодные и катодные реакции
При электрохимической коррозии протекают две сопряженные реакции: окисление металла и восстановление компонентов среды.
Анодная реакция, как правило, представляет собою окисление поверхностных атомов металла с образованием катионов, которые выходят в электролит и могут реагировать с его компонентами:
Катодная реакция –восстановление компонентов электролита. Поскольку коррозионная система полностью поляризована, то протекающие катодные реакции называют реакциями деполяризации катода.
В водных растворах обычно протекают реакции с водородной (а)или кислородной (б) деполяризацией катода:
Возможность протекания реакции определяется как водородным показателем среды (pH), так и наличием растворенного кислорода. Реакции с кислородной деполяризацией катода обычно протекают в тонкой пленке воды на поверхности металла, например, в условиях атмосферной коррозии.
Окисление атомов металла с выходом катионов в электролит и восстановление ионов или молекул среды на поверхности металла являются первичными процессами коррозии. Образовавшиеся при этом ионы Me n + , OH — и растворенные в электролите вещества могут вступать в химические реакции, представляющие собой вторичные процессы. Обычно вторичные процессы приводят к образованию труднорастворимых продуктов коррозии, чаще всего гидроксидов, основных и средних солей. Например:
Рассмотрим некоторые случаи электрохимической коррозии металлов.
Коррозия гетерогенных сплавов. Гетерогенный сплав – поликристалл металла, состоящий из монокристаллов, обладающих различными физико-химическими свойствами, то есть состоит из нескольких фаз. При их контакте с электролитом образуется совокупность микрогальванических коррозионных элементов.
Пример. Коррозия стального изделия в растворе соляной кислоты. Сталь – гетерогенный сплав, содержащий в своем составе микрокристаллы железа (Fe) и карбида железа (Fe3C) (рис.9.7).
Рис. 9‑7 Коррозия стали в кислоте
Поскольку электродный потенциал карбида железа больше, чем потенциал железа, то в коррозионном гальваническом элементе Fe½H + ½Fe3C катодом будет карбид железа, а анодом железо. Учитывая, что 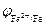
анод (Fe): Fe 0 ® Fe 2+ + 2ē
Вторичные реакции протекать не будут, поскольку нерастворимых соединений не образуется. В этом случае говорят об электрохимическом растворении стали:
Fe 0 + 2H + ® Fe 2+ + H2.
Коррозия металла при неравномерной аэрации электролита. При условии неодинакового доступа кислорода к различным участкам коррозионной системы возникает концентрационный коррозионный элемент.
Пример. Коррозия меди под каплей воды на воздухе. Электродный потенциал металла будет больше на тех участках, которые контактируют с электролитом с большей концентрацией растворенного в нем кислорода. В случае капли воды концентрация кислорода будет больше на краях ( 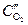
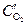
Рис. 9‑8 Коррозия меди под каплей воды
Медь на анодном участке будет окисляться, а на катодном участке протекать реакция с кислородной деполяризацией:
анод (Cu( 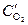
катод (Cu( 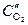
Вторичной реакцией будет реакция образования нерастворимого дигидроксида меди:
Примечание. В воздухе присутствует углекислый газ, который вместе с кислородом растворен в воде. Поэтому в продуктах коррозии будет присутствовать основной карбонат меди:
Коррозия металла в напряженном состоянии. Под действием механических напряжений в металле, контактирующем с электролитом, изменяется электродный потенциал. Потенциал растянутого слоя металла уменьшается, а сжатого увеличивается. Это приводит к образованию коррозионного гальванического элемента, в котором растянутые слои металла будут анодом, а сжатые – катодом.
Пример. Коррозия находящейся в воде детали из дюралюмина (сплав на основе алюминия) в напряженном состоянии (рис.9.9).
Внешние слои дюралюмина в упругодеформированной пластине растянуты и при возникновении коррозионного гальванического элемента будут анодом, внутренние слои сжаты и являются катодом:
анод (Alрастянут): Al 0 ® Al 3+ + 3ē
Вторичной реакцией будет реакция образования нерастворимого тригидроксида алюминия:

Рис. 9‑9 Коррозия детали в напряженном состоянии
Контактная коррозия металлов. Если два соприкасающихся разнородных металла контактируют с электролитом, то образуется макрогальванический коррозионный элемент.
Пример. Атмосферная коррозия оцинкованного железа при нарушении покрытия.
Стандартные электродные потенциалы металлов равны: 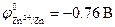
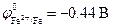
анод (Zn): Zn 0 ® Zn 2+ + 2ē
Основной вторичной реакцией является образование нерастворимого дигидроксида цинка:
Рис. 9‑10 Коррозия оцинкованного железа при нарушении покрытия
Составление электронных уравнений анодного и катодного процессов происходящих при коррозии
Решение задач на коррозию металлов
Задание 287.
Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний — никель. Какие продукты коррозии образуются в первом и во втором случаях?
Решение:
Магний имеет более электроотрицательный стандартный электродный потенциал (-2,36 В), чем никель (-0,24 В), поэтому он является анодом, никель – катодом.
Анодный процесс – окисление металла: Mе 0 — 2 
и катодный процесс – восстановление ионов водорода (водородная деполяризация) или молекул кислорода (кислородная деполяризация). Поэтому при коррозии пары Mg — Ni с водородной деполяризацией происходит следующие процессы:
Анодный процесс: Mg 0 — 2 
Катодный процесс: в кислой среде: 2Н + + 2 
Продуктом коррозии будет газообразный водород соединение магния с кислотным остатком (соль).
При коррозии пары Mg — Ni в атмосферных условиях на катоде происходит кислородная деполяризация, а на аноде – окисление магния:
Анодный процесс: Mg 0 — 2 
Катодный процесс: в нейтральной среде: 1/2O2 + H2O + 2 
в нейтральной или в щелочной среде: 1/2O 2 + H 2 O + 2 
Так как ионы Mg 2+ с гидроксид-ионами ОН — образуют нерастворимый гидроксид, то продуктом коррозии будет Mg(OH)2.
Задание 288.
В раствор хлороводородной (соляной) кислоты поместили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов.
Решение:
а) При помещении цинковой пластинки в раствор хлороводородной (соляной) кислоты происходит реакция замещения:
Через некоторое время цинковая пластинка в растворе разбавленной соляной кислоте пассивируется оксидной плёнкой, образующейся при взаимодействии цинка с кислородом растворённым в воде по схеме: Zn + 1/2 O2 = ZnO, поэтому коррозия цинка вскоре замедлится.
б) При помещении цинковой пластинки, частично покрытой медью, в раствор соляной кислоты образуется гальваническая пара Zn — Cu, в которой цинк будет анодом, а медь – катодом. Происходит это так, потому что цинк имеет более электроотрицательный электродный потенциал (-0,763 В), чем медь (+0-,34 В).
Анодный процесс: Zn 0 — 2 
Катодный процесс: в кислой среде: 2Н + + 2 
Ионы цинка Zn 2+ с ионами хлора Cl — будут давать соль ZnCl2 – сильный электролит, а водород будет интенсивно выделяться в виде пузырьков газа. Этот процесс будет бурно протекать до тех пор пока не закончится приход ионов водорода Н + соляной кислоты или пока полностью не растворится цинковая пластинка. Ионно-молекулярное уравнение коррозии:
Zn 0 + 2H + = Zn 2+ + H2О↑
Молекулярная форма уравнения:
Задание 289.
Почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов происходящих при коррозии технического железа во влажном воздухе и в кислой среде.
Решение:
Химически чистое железо более стойко к коррозии, потому что с кислородом образует на поверхности оксидную плёнку, которая препятствует дальнейшему разрушению металла. Техническое железо содержит примеси различных металлов и неметаллов, которые образуют различные гальванические пары железо — примесь. Железо, имея отрицательный стандартный электродный потенциал (-0,44 В) со многими примесями, потенциал которых значительно положительнее, является анодом, а примеси – катодом:
Анодный процесс: Fe 0 -2 
Катодный процесс: в кислой среде: 2Н + + 2 
в нейтральной или в щелочной среде: 1/2O2 + H2O + 2 
Так как ионы Fe 2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом атмосферной коррозии железа будет Fe(OH)2. При контакте с кислородом воздуха Fe(OH)2 быстро окисляется до метагидроксида железа FeO(OH), приобретая характерный для него бурый цвет:
Коррозия металлов и защита от коррозии
4. КОРРОЗИЯ МЕТАЛЛОВ И ЗАЩИТА
4.1. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ.
АНОДНЫЕ И КАТОДНЫЕ ПРОЦЕССЫ
В природе всегда создаются условия для коррозии металлов и сплавов. Ущерб от коррозии выражается в виде безвозвратных потерь металла, а также в виде экономических потерь и выходе из строя металлических конструкций. Поэтому защита металлов и сплавов от влияния коррозии была и остается насущной проблемой промышленности. Этим обстоятельством продиктована необходимость данного курса.
Коррозией металлов и сплавов называется процесс самопроизвольного их разрушения под действием окружающей среды. Коррозионное взаимодействие может быть химическим, электрохимическим или биохимическим. Изменение энергии Гиббса при коррозии DGкор 7 серебро не подвергается коррозии. Однако при рН 8, т. е. в щелочной и слабощелочной среде, железо окисляется только кислородом, т. к. 
http://buzani.ru/zadachi/khimiya-shimanovich/952-elektronnye-uravneniya-anodnogo-i-katodnogo-protsessov-zadachi-287-289
http://pandia.ru/text/80/280/19222.php