Тепловой эффект. Уравнение Кирхгофа
Вы будете перенаправлены на Автор24
Что такое тепловой эффект
Тепловым эффектом E процесса называют сумму количества теплоты, которое отдала система ($Q’$) в этом процессе и теплового эквивалента работы ($\tilde$), элемент которой равен:
\[\widetilde<\delta A>=\delta A-pdV\ \left(1\right),\]
где $\delta A$- элементарная полная работа системы, $pdV$ — работа расширения.
Можно записать, что $E=-Q$, где $Q$ — количество теплоты, подведенное к системе, тогда в соответствии с первым началом термодинамики, получим:
где $\triangle U=U_2-U_1$ — изменение внутренней энергии системы, $p$ — давление, $V$ — объем.
Понятие теплового эффекта часто применяется в термохимии. Тепловым эффектом химической реакции является количество тепла, которое выделяется в ходе этой реакции. Если тепло выделяется, то реакция называется экзотермической, если поглощается — эндотермической. Принято считать, что в экзотермической реакции $E>0$, в эндотермической — $E
Предположим, что химическая реакция протекает при $V=const$. В таком случае тепловой эффект реакции $E_V$ рассчитывается как:
В том случае, если реакция проходит при постоянном давлении, то выражение для теплового эффекта (3) удобнее записать, используя тепловую функцию (энтальпию — H):
В таком случае тепловой эффект реакции при $p=const$ равен:
Уравнения (4) и (5) показывают нам, что тепловой эффект реакции при изохорном и изобарном процессах не зависит от хода (промежуточных стадий) реакции, а определяется начальным и конечным состояниями системы. Это формулировка закона Гесса — первый закон термохимии. Если начальные и конечные продукты реакции — твердые или жидкие, то $E_p$ и $E_V$ почти не отличаются друг от друга. Это происходит из-за неизменности объема системы. В реакциях с газообразными составляющими в виду существенной переменности объема тепловые эффекты $E_p$ и $E_V$ существенно отличаются, чаще всего рассматривают тепловой эффект при постоянном давлении. При заданной температуре тепловой эффект реакции $E_p$ практически (а в идеальном газе совсем) не зависит от внешнего давления (которое поддерживают постоянным). Тепловой эффект определённый при t=250C и p=760 мм рт.ст. считается стандартным.
Из закона Гесса вытекают следствия, которые упрощают расчет химических реакций, в системе при $p=const$ или $V=const$:
- тепловой эффект реакции разложения химического соединения численно равен и противоположен по знаку тепловому эффекту реакции синтеза этого соединения из продуктов разложения;
- разность тепловых эффектов двух реакций, приводящих из разных состояний к одинаковым конечным состояниям, равна тепловому эффекту реакции перехода из одного начального состояния в другое;
- разность тепловых эффектов двух реакций, приводящих из одного исходного состояния к разным конечным состояниям, равна тепловому эффекту реакции перехода из одного конечного состояния в другое.
Закон Гесса позволяет оперировать термохимическими уравнениями, как алгебраическими. Зависимость количества теплоты, выделяющейся в реакции (E) от теплового эффекта реакции (Eo) и количества вещества (nb) одного из участников реакции (вещества b — исходного вещества или продукта реакции), выражается уравнением:
Здесь $\ <\nu >_b$— количество вещества b, задаваемое коэффициентом перед формулой вещества b в термохимическом уравнении.
Уравнение Кирхгофа
Большинство термохимических данных в справочниках приведено при температуре 298К. Для расчета тепловых эффектов при других температурах используют уравнения Кирхгофа. Уравнения Кирхгофа записываются для изохорного $(E_V)$ и изобарного $<(E>_p)$ тепловых эффектов. В дифференциальной форме они имеют вид:
В уравнениях (10) и (9) $C_V$, $C_p$- теплоемкости вещества при соответствующих процессах (изобарном и изохорном).
В интегральной форме уравнение Кирхгофа для энтальпии имеет вид:
где $\triangle C_p=\sum\limits_j<<\nu >_jC_p(B_j>)-\sum\limits_i<<\nu >_iC_p(A_i>)$ — разность изобарных теплоемкостей продуктов реакции и исходных веществ. Уравнением (11) в химии пользуются чаще всего.
Задание: Напишите выражение для расчета изменения стандартной энтальпии реакции.
Основой для решения поставленной задачи является закон Гесса.
Закон Гесса позволяет оперировать термохимическими уравнениями, как алгебраическими. Поэтому мы можем записать:
\[\triangle H=\sum\limits_j<<\nu >_j>H\left(B_j\right)-\sum\limits_i<<\nu >_i>H\left(A_i\right)\ \left(1.1\right),\]
где $B_j$ — продукты реакции, $A_i$- исходные вещества. Так как в задаче требуется записать формулу для расчета стандартной энтальпии. Необходимо отметить, что все энтальпии, которые записаны в уравнении (1.1), берутся при температуре T=298 K. Иногда это пишут непосредственно в формуле.
Задание: По приведенным ниже химическим уравнениям вычислите тепловой эффект реакции (E) образования 1 моль $
- $2Fe+O_2=2FeO,\ H\left(298K,\ 1\right)=-529,6\ кДж$
- $4FeO+O_2=2
_2O_3,\ H\left(298K,\ 2\right)=-585,2\ кДж$
Таким образом, необходимо рассчитать тепловой эффект образования 1 моль оксида железа ($
Получается, что из двух реакций, приведенных в условиях задачи, необходимо сформировать реакцию (2.1). Для этого разделим коэффициенты в реакции (2) на 2 и сложим с химическим уравнением (1), таким образом, получим:
Проведем сокращения, получим уравнение реакции:
Мы получили уравнение (2.1)
Так как приведенная выше последовательность манипуляций с химическими уравнениями 1 и 2 из условий задачи привела нас к требуемому уравнению (2.1), то проведя аналогичную схему действий с тепловыми эффектами, мы получим тепловой эффект реакции (2.1). Мы помним, что все процессы протекают в стандартных условиях, то есть при T=298K. Таким образом, получаем:
где цифры в скобках обозначают номер химической реакции. Проведем расчет:
\[E\left(3\right)=-529,6+0,5\cdot \left(-585,2\right)=-822,2\ \left(кДж\right).\]
Ответ: Тепловой эффект реакции -822, 2 кДж.
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 26 11 2021
Закон Кирхгофа
Закон Кирхгофа – правило, открытое известным немецким (прусским) учёным.
Открытия Густава Кирхгофа
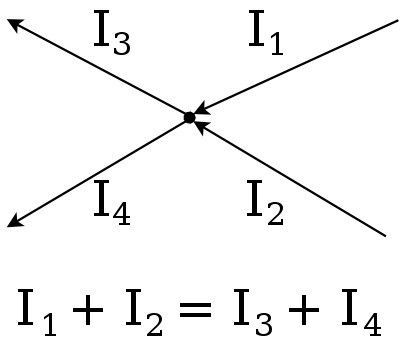
Чаще под законами Кирхгофа подразумеваются закономерности, сформулированные для замкнутых контуров и узлов электрических цепей. В русскоязычной литературе их предпочитают называть правилами. Закона два. Первый оперирует с токами, второй с напряжениями. Составленная при помощи формул система уравнений позволяет найти параметры сети, удовлетворяющей требованиям применимости к ней данных вычислений. Правила сформулированы в 1845 году, это не единственное открытие Кирхгофа.
В термодинамике известен другой принцип. Гласит, что соотношение излучательной способности тела и поглощательной постоянно для любых материалов вне зависимости от их природы и определяется двумя внешними параметрами:
- Частотой волны.
- Температурой окружающей среды.
Тесно связан с предыдущим открытием факт из жизни великого учёного. В 17 веке начала развиваться спектроскопия, Кирхгоф не преминул оставить в науке собственный след, открыв три закона:
- Спектр излучения твёрдого тела непрерывный. Кирхгоф ввёл понятие абсолютно-чёрного тела, ставшее сегодня ключевым в изучении вопросов передачи энергии на расстояние.
- Разреженный газ излучает в выделенных волнах спектра, с длинами, зависящими от состояния квантовых переходов электронов вещества. На указанной основе работают лазеры.
- Горячее твёрдое тело, окружённое охлаждённым газом имеет непрерывный спектр излучения за вычетом отдельных частот, поглощённых обволакивающим облаком. Длины волн зависят от квантовых переходов витающего вокруг объекта вещества.
Учёный добрался до термохимии и показал, что тепловой эффект реакции зависит от изменения теплоёмкости системы (до и после процесса). Постулат причислен к основным в разделе науки. В гидродинамике уравнения Кирхгофа описываю движения твёрдого тела в идеальной жидкости.
Законы Киргофа для электрических цепей
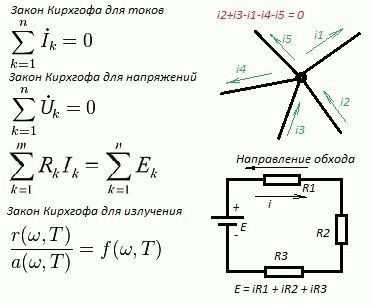
- Первый закон Киргофа гласит, что алгебраическая сумма токов в узле цепи равна нулю. Исходящие токи берутся при вычислениях с отрицательным знаком, входящие – с положительным. Хотя в русскоязычной литературе говорится, что допустимо наоборот. Суть неизменна.
- Второй закон Киргофа формулируется для замкнутых контуров. Утверждает, что сумма падений напряжений при обходе по кругу равна всем встречающимся на пути ЭДС. Причём контуры любой цепи нужно обходить в едином направлении: по или против часовой стрелки.
Первое уравнение не нуждается в пояснении. Порой сложно понять, в каком направлении течёт ток, с отрицательным или положительным знаком требуется подставить в формулу. Рекомендуется помнить: количество уравнений на единицу меньше, нежели узлов. Если присутствуют сомнения по точке, допустимо исключить её из рассмотрения. В прочих ситуациях анализируется знак разницы потенциалов на концах проблемного участка. Для этого складываются или вычитаются действующие здесь источники питания (в задачках по физике – батарейки).
По общепринятым нормам более длинная черта в графическом обозначении аккумулятора считается положительным полюсом. Ток вытекает отсюда по правилам, принятым в физике, хотя на практике все происходит наоборот – движение образовано отрицательно заряженными электронами. Если ЭДС действуют на участке в разных направлениях, они вычитаются, а направление тока задаётся наибольшей.
Что касается второго закона, знак вхождения в формулу падения напряжения на установленном участке определяется направлением протекания тока. ЭДС берутся с противоположным знаком, либо стоят по другую сторону равенства. Как указано выше, ячейки нужно обходить в одном направлении. Не смущайтесь, что в формулах над напряжением и током стоит точка. Это знак комплексного числа.
Обратите внимание – дана упрощённая запись второго закона. Здесь все ЭДС берутся с обратным реально присутствующему на рисунке знаком. Известна иная форма записи, где падения напряжения отделены от ЭДС знаком равенства. Тогда знаки менять не нужно. Последняя форма записи даётся в школьном курсе физики и приведена на рисунке чуть ниже общей.
Закон Кирхгофа для термодинамики
Кирхгоф показал, что соотношение излучательной и поглощательной способности твёрдого тела не зависит от вещества, но считается функцией частоты и температуры при термодинамическом равновесии. Особенно интересной абстракцией в этом плане стало абсолютно-чёрное тело. Это объект, поглощающий падающее на него излучение. Для него формула, представленная на рисунке упрощается. Излучающая способность абсолютно-чёрного тела описывает функцию формулы для прочих тел. Эта ипостась имеет максимум, определяемый законом смещения Вина и амплитуды, определяемую первым законом Вина (частным случаем считается формула Планка).
Отношение излучательной и поглощательной способности любого тела находится по формулам для любых температур и частот. При помощи спектрометра возможно оценить испускаемые волны. Это позволяют теоретически предсказать поглощательную способность любого предмета. На практике подобные исследования приводят к созданию объектов типа самолёт-невидимка, с трудом видимый локаторами.
Из закона сохранения энергии следует, что полное излучение равняется поглощению в термодинамическом равновесии. Значит, по всему спектру их соотношение равняется единице. До признания закона Кирхгофа уже установлено, что – чем лучше тело поглощает энергию, тем оно больше излучает. Обратите внимание, спектральные плотности поглощения и излучения имеют разную форму. В этом и заключается гениальное прозрение Кирхгофа. Взаимодействие определяется законом Вина и на графике выглядит подобно горе с вершиной, смещённой влево относительно центра фигуры.
Это позволяет понять, где находится максимум излучения (на макушке). Во всех участках графика, где линия находится ниже единицы, тело преимущественно поглощает энергию. Благодаря законам возможно предсказать температуру звёзд, к примеру, по цвету, а каждый кузнец знает, что деталь в горне дошла до кондиции лишь по характерному оттенку свечения. Это практические проявления законов Вина и Кирхгофа.
Вторым интересным наблюдением становится температура. Из графиков плотности излучения видно, чем показатель больше, тем активнее идёт излучение. В частности, звезды не поглощают энергию за малым исключением, но преимущественно излучают. У холодных планет преобладает противоположный процесс. Тело излучает, если его температура выше окружающей среды. В остальных ситуациях преобладает поглощение энергии.
Аналогия закона Кирхгофа
Работы Кирхгофа в области спектроскопии
Кирхгоф и Бунзен активно изучали спектры излучения химических элементов, используя изобретения Фраунгофера. При помощи призмы или дифракционной решётки свет раскладывался на спектральные составляющие, и учёные наблюдали эффект. Так установлены индивидуальные частоты ряда элементов таблицы Менделеева. Указанные учёные заложили основы спектроскопии. В 1860 году опубликованы исследования восьми элементов и их уникальных спектров, среди прочих:
Кирхгоф и Бунзен показали, что можно проводить химический анализ веществ при помощи спектроскопии и открыли элементы, прежде неизвестные в науке (цезий – в Древнем Риме «голубой» по спектру свечения и рубидий – в Древнем Риме «темно-красный»). Установили связь между спектрами излучения и поглощения, на основании характеристик солнечного света показали избранные свойства нашего светила (наличие железа, калия, кальция, магния, никеля, хрома и натрия в атмосфере звезды, отсутствие лития). Опыты требовалось проводить в период близости Солнца к зениту: когда звезда клонилась к горизонту, увеличивался итоговый эффект вклада атмосферы Земли. Как результат работы, на свет появился закон Кирхгофа для термодинамики.
Применяя устройства, разлагающие спектр на составляющие, учёные открыли ряд прочих законов, упомянутых выше. Учёный применял бунзеновскую горелку (Бунзен), в пламя вводил хлористый натрий или хлористый литий. В результате при помощи дифракционной решётки наблюдал дискретный спектр, причём установлено, что поглощение идёт на прежних частотах. Выводы Кирхгофа:
- Раскалённое газообразное тело, образованное в пламени горелки испускает дискретный спектр излучения.
- Установлено, что в солнечном излучении отсутствуют частоты элемента натрия. Учёный сложил дневной свет с пламенем бунзеновой горелки, дефект изгладился. Излучение натрия в лаборатории дополнило спектр Солнца.
- Если потом для опыта бралась спиртовая горелка, тёмные полосы становились чернее. Следовал вывод, что при относительно низкой температуре газообразного тела в пламени горелки оно начинает поглощать. Так установлено, что в более холодной относительно ядра солнечной атмосфере имеется натрий.
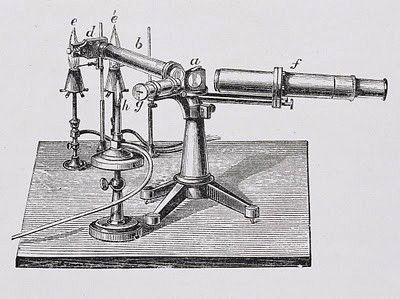
Опыт с горелкой
Лучшей горелкой для опытов учёный считал газовую. Поскольку светимость её пламени низка и не мешает регистрировать спектр газообразного тела. Соли для опытов брались максимально чистыми, производилось многократное осаждение. Для наблюдения использовался чёрный ящик, в стенки устройства под острым углом вставлялись две подзорные трубы:
- через первую наблюдатель лицезрел зачернённую заднюю стенку;
- через вторую свет концентрировался на выбранном участке.
Вращающаяся призма помогала зафиксировать напротив глаз наблюдателя нужный сегмент спектра. Понятно, что указанная методика годится исключительно для видимого излучения и не затрагивает инфракрасный и ультрафиолетовый диапазоны.
Другие работы
Кирхгоф массу времени посвятил разным отраслям науки. К примеру, нашёл ошибку в постановке граничных условий для решения дифференциальных уравнений по колебаниям мембран, представленных на суд публики в 1811 году Софи Жермен. Не нужно думать, что словосочетание закон Кирхгофа узко ограничено двумя правилами, причём одно прямо приводит к сформулированному ранее закону Ома.
Учёный представлен для получения звания члена-корреспондента Берлинской Академии наук в отделении математики, корреспондента Петербургской Академии наук. Если в первом случае заявители в основном указывали на дар в решении задач механики, наши соотечественники (Ленц и Якоби) немало отметили заслуги Кирхгофа в спектральном анализе.
Учёный преподавал, обладал феноменальной памятью, назубок читал длинные лекции без отступлений от формального текста. Чувство скрупулёзности помогало безукоризненно собирать материалы, и лишь недостаток технической оснастки помешал, вероятно, сделать новые открытия. К примеру, учёный отмечал, что одна из линий спектра кальция совпадает с железом, но не сумел достоверно сказать, кажущееся ли совпадение. Теперь известно, что длины волн отличаются на 5-6 ангстремов, но тогда на глаз сказать оказалось невозможно с полной уверенностью.
Тепловой эффект. Уравнение Кирхгофа
Тепловой эффект E процесса – это сумма количества теплоты, которую отдала система Q ‘ в этом процессе, и теплового эквивалента работы A
, элемент которой равняется:
= δ A — p d V ( 1 ) , где δ A считается элементарной полной работой системы, p d V – работой расширения.
Тогда получим, что:
Разрешается записать в виде E = — Q с Q , обозначающей количество теплоты, подведенное к системе. Согласно первому началу термодинамики:
E = — ∆ U — ∫ 1 2 p d V ( 3 ) , где ∆ U = U 2 — U 1 является изменением внутренней энергии системы, p – давлением, V – объемом.
Тепловой эффект применяется в термохимии. Тепловым эффектом химической реакции считается количество тепла, выделяемое в ходе данной реакции. При выделении теплоты реакция получила название экзотермической, при поглощении – эндотермической. Считается, что уравнение экзотермической реакции характеризуется E > 0 , а эндотермической –
Допустим, имеется химическая реакция, протекающая при V = c o n s t . Это говорит о тепловом эффекте реакции E V , который необходимо рассчитывать по формуле:
E V = U 1 — U 2 ( 4 ) .
Если прохождение этой реакции обусловлено наличием постоянного давления, то выражение ( 3 ) с использованием тепловой функции запишется:
H = U + p V ( 5 ) , E = H 1 — H 2 + ∫ 1 2 V d p ( 6 ) , то случай говорит о наличии теплового эффекта реакции с p = c o n s t :
E p = H 1 — H 2 ( 7 ) .
По уравнениям ( 4 ) , ( 5 ) видно прохождение теплового эффекта при изохорном и изобарном процессах в не зависимости от ее хода реакции (промежуточных стадий). Он определяется начальным и конечным состоянием системы. Данная формулировка получила название закона Гесса – первого закона термохимии. При твердых или жидких начальных и конечных продуктах реакции значения E p и E V практически аналогичны. Это происходит по причине неизменности системы. Реакции, имеющие газообразные составляющие, в виду существенной переменности объема тепловые эффекты E p и E V значительно отличаются, а тепловой эффект рассматривается при постоянном давлении. Наличие заданной температуры теплового эффекта E p почти не зависит от внешнего давления, которое является постоянным для данного процесса. Тепловой эффект, который определяется при t = 25 ° C и p = 760 м м р т . с т . называют стандартным.
Из закона Гесса вытекают следствия, упрощающие расчет химических реакций, в системах с p = c o n s t или V = c o n s t :
- Тепловой эффект реакции разложения химического соединения численно равен и противоположен по знаку тепловому эффекту реакции синтеза этого соединения из продуктов разложения.
- Разность тепловых эффектов двух реакций, приводящих из разных состояний к одинаковым конечным состояниям, равняется тепловому эффекту реакции перехода из одного начального состояния в другое.
- Разность тепловых эффектов двух реакций, приводящих из одного исходного состояния к разным конечным состояниям, равна тепловому эффекту реакции перехода из одного конечного состояния в другое.
Закон Гесса позволяет использовать термохимические уравнения в качестве алгебраических. Зависимость количества теплоты, которая выделяется в реакции E от теплового эффекта реакции E o , и количества вещества n b одного из участников реакции( вещества b в качестве исходного вещества или продукта реакции), выражается при помощи уравнения:
E = n b v b E 0 ( 8 ) , где v b — является количеством вещества b , задаваемое коэффициентом перед формулой вещества b в химическом уравнении.
Уравнение Кирхгофа
Большинство термохимических данных в справочниках приведено при температуре 298 К . Чтобы рассчитать тепловые эффекты, обладающие другими температурами, применяют уравнения Кирхгофа. Они записываются для изохорного E V и изобарного E p тепловых эффектов. Дифференциальная форма приобретает вид:
∂ E V ∂ T V = ∂ U 1 ∂ T V — ∂ U 2 ∂ T V = C V 1 — C V 2 = — ∆ C v ( 9 ) , ∂ E p ∂ T p = ∂ H 1 ∂ T p — ∂ H 2 ∂ T p = C p 1 — C p 2 = — ∆ C p ( 10 ) .
В ( 10 ) , ( 9 ) имеется C V , C p , являющиеся теплоемкостями веществ при соответствующих процессах.
Уравнение Кирхгофа для энтальпии изображается в интегральной форме вида:
H T 2 = H T 1 + ∫ T 1 T 2 ∆ C p T d T ( 11 ) , где ∆ C p = ∑ i v j C p B j — ∑ v i C p A i i считается разностью изобарных теплоемкостей продуктов реакции и исходных веществ. Зачастую выражение ( 11 ) применяют в химии.
Примеры задач на вычислыние теплового эффекта
Записать выражение для расчета изменения стандартной энтальпии реакции.
Для решения задания необходимо взять за основу закон Гесса.
Именно он способствует оперированию термохимическими уравнениями как алгебраическими. Получаем, что запись принимает вид:
∆ H = ∑ j v j H B j — ∑ i v i H A i ( 1 . 1 ) , с B j , являющейся продуктами реакции, A i – исходными веществами. В задании требуют записать формулу для расчета стандартной энтальпии. Отметим, что все энтальпии, записанные уравнениями ( 1 . 1 ) , выбираются при температуре T = 298 К . Реже это фиксируется в самой формуле.
Даны химические уравнения. Произвести вычисление теплового эффекта реакции E образования 1 моль F e 2 O 3 при стандартных условиях из F e и O 2 .
1 . 2 F e + O 2 = 2 F e O , H 298 К , 1 = — 529 , 6 к Д ж ; 2 . 4 F e O + O 2 = 2 F e 2 O 3 , H ( 298 К , 2 ) = — 585 , 2 к Д ж .
По условию видно, что следует рассчитать тепловой эффект образования 1 моль оксида железа F e 2 O 3 реакции вида:
3 . 2 F e + 1 , 5 O 2 = F e 2 O 3 ( 2 . 1 ) .
Из двух данных реакций, следует сформировать реакцию ( 2 . 1 ) . Далее нужно разделить коэффициенты в ( 2 ) на 2 и произвести сложение с ( 1 ) . Отсюда:
2 F e + O 2 + 2 F e O + 0 , 5 O 2 = 2 F e O + F e 2 O 3 ( 2 . 2 ) .
Проведем преобразование (сокращение):
2 F e + 1 , 5 O 2 = F e 2 O 3 .
Было получено уравнение ( 2 . 1 ) :
Выше перечисленная последовательность действий с уравнениями привела к необходимому ( 2 . 1 ) . При проведении аналогичной схемы действий с тепловыми эффектами, будет результат эффекта реакции ( 2 . 1 ) . Протекание всех процессов обусловлено стандартными условиями, то есть при T = 298 К . Следовательно формула примет вид:
E 3 = H ( 1 ) + 0 , 5 H ( 2 ) ( 2 . 3 ) , где находящиеся в скобках цифры обозначают номер химической реакции. Рассчитаем и получим:
E 3 = — 529 , 6 + 0 , 5 · — 585 , 2 = — 822 , 2 ( к Д ж ) .
Ответ: тепловой эффект реакции равняется — 822 , 2 к Д ж .
http://vashtehnik.ru/enciklopediya/zakon-kirxgofa.html
http://zaochnik.com/spravochnik/fizika/termodinamika/teplovoj-effekt/