Решение типовых задач
Найдите степень диссоциации сероводородной кислоты по первой ступени в 0,1М растворе, если константа диссоциации для этой ступени равна 1,1×10 7 . Определите концентрацию ионов Н + , образовавшихся в растворе этой кислоты после ее диссоциации по первой ступени.
Диссоциация сероводородной кислоты по первой ступени протекает по следующей схеме: H2S ® H + + HS — .
1. Определение степени диссоциации.
Константа диссоциации (КД) и степень диссоциации (a) слабого электролита связаны между собой соотношением (закон разбавления Оствальда)
где С – концентрация электролита, моль/л.
В случае очень слабых электролитов (a + ( 

Определить ионную силу раствора, содержащего 0,5 моль СаСl2 и 0,1 моль НСl. Определить коэффициент активности иона кальция.
Сильные электролиты закону действующих масс не подчиняются, в реакциях ионы сильных электролитов проявляют себя так, будто их концентрация меньше действительной концентрации, определяемой аналитически. Это объясняется наличием в растворах сильных электролитов межионных сил.
Для учета влияние межионных сил на концентрацию введен термин «активность». Активность обозначается буквой «а» и имеет ту же размерность, что и концентрация. Отношение активности к концентрации называется коэффициентом активности (f); f = a/c f £ 1.
В реальных растворах а
где С – молярные концентрации отдельных ионов, присутствующих в растворе; Z 2 – их заряды, взятые в квадрат.
Недиссоциированные молекулы, как не имеющие зарядов, в формулу подсчета ионной силы раствора не включаются.
Коэффициент активности иона может быть вычислен по приближенной формуле:
1. Определяем ионную силу раствора.
В растворе содержится 0,5 моль иона кальция, 0,1 моль катиона водорода, (0,5×2 + 0,1) моль ионов хлора.
Заряд ионов кальция – (+2); ионов хлора – (-1); ионов водорода – (+1).Подставляем все эти значения в формулу для определения ионной силы раствора. m = ½(0,5×2 2 + 0,1×1 2 + 1,1×(-1) 2 ) = (2 + 0,1 + 1,1)/2 = 3,2/2 = 1,6.
2. Определяем коэффициент активности иона кальция.

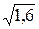
Вычислите молярную концентрацию эквивалента (эквивалентную концентрацию), молярную концентрацию и моляльность 30% раствора хлорида натрия с плотностью r = 1,03 г/см 3 .
Принимаем, что объем раствора (V) равен 1л.
1. Определяем массу раствора (m) по формуле m = V×r.
.m = 1000×1,03 = 1030 г.
2. Определяем массу растворенного вещества (m1).
.m1 = w×m ¤100 =(30×1030)/100 = 309 г.
3. Определяем молярную концентрацию раствора (С).
Молярная масса NaCl равна 58,5 г/моль.

4. Определяем эквивалентную концентрацию раствора.
Молярная масса эквивалента NaCl равна 58,5/1 = 58,5 г/моль.

Определяем моляльность раствора.
Напишите уравнения гидролиза солей: Na2SO4 K2SO3, Zn(NO3)2. Какие вещества могут уменьшить гидролиз соли №2? Какие вещества могут усилить гидролиз соли №3?
1. Соль Na2SO4 не гидролизуется, так как образована катионом сильного основания и анионом сильной кислоты.
2. Соль K2SO3 гидролизуется по аниону. Схема гидролиза следующая.
А. Диссоциация соли:
Б. Сокращенное ионное уравнение:
В. Полное ионное уравнение:
2K + + SO3 2- + HOH =2K + + HSO3 — + OH —
Г. Молекулярное уравнение гидролиза:
Среда раствора в результате гидролиза – щелочная.
Для уменьшения гидролиза этой соли следует прибавить щелочь. Это приведет к смещению уравнения гидролиза в сторону исходных веществ.
2. Соль Zn(NO3)2 гидролизуется по катиону. Схема гидролиза следующая.
А. Диссоциация соли:
Б. Сокращенное ионное уравнение:
Zn 2+ + HOH = Zn(OH) + + H +
В. Полное ионное уравнение:
2NO3 — + Zn 2+ + HOH = 2NO3 — + Zn(OH) + + H +
Г. Молекулярное уравнение гидролиза:
Среда раствора в результате гидролиза – кислая.
Для увеличения гидролиза этой соли следует прибавить щелочь. Это приведет к смещению уравнения гидролиза в сторону продуктов реакции.
6.2. Варианты заданий
Задание 12. По данным таблицы рассчитать степень диссоциации и концентрацию ионов в растворе слабого электролита.
| № вар. | Слабый электролит | С, моль/л | Константа диссоциации* | Определить концентрацию иона |
| NH4OH | 0,01 | 1,77×10 -5 | ОН — | |
| NH4OH | 0,05 | 1,77×10 -5 | ОН — | |
| NH4OH | 0,01 | 1,77×10 -5 | NH4 + | |
| NH4OH | 0,05 | 1,77×10 -5 | NH4 + | |
| HNO2 | 0,1 | 5,1×10 — 4 | NO2 — | |
| HNO2 | 0,2 | 5,1×10 — 4 | NO2 — | |
| H3BO3 | 0,1 | 5,83×10 — 10 (I) | H2BO3 — | |
| H3BO3 | 0,1 | 1,8×10 — 13 (II) | HBO3 2- | |
| H3BO3 | 0,1 | 1,6×10 — 14 (III) | BO3 3- | |
| H3BO3 | 0,2 | 5,83×10 — 10 (I) | H2BO3 — | |
| H3BO3 | 0,2 | 1,8×10 — 13 (II) | HBO3 2- | |
| H3BO3 | 0,2 | 1,6×10 — 14 (III) | BO3 3- | |
| HCOOH | 0,3 | 1,772×10 — 14 | COOH — | |
| Продолжение задания 12 | ||||
| HCOOH | 0,4 | 1,772×10 — 14 | H + | |
| H2SO3 | 0,02 | 1,3×10 — 2 (I) | H + | |
| H2SO3 | 0,02 | 0,63×10 — 7 (II) | H + | |
| H2SO3 | 0,02 | 1,3×10 — 2 (I) | HSO3 — |
Примечание. Римские цифры в скобках обозначают ступень диссоциации. Каждой ступени соответствует своя степень диссоциации.
Задание 13. По данным таблицы вычислите молярную концентрацию эквивалента (эквивалентную концентрацию), молярную концентрацию и моляльность раствора, зная его массовую долю и плотность.
| № вар. | Растворенное вещество | Массовая доля, % | Плотность раствора | № | Растворенное вещество | Массовая доля, % | Плотность раствора, г/см 3 |
| HCl | 1,050 | H2SO4 | 1,180 | ||||
| HCl | 1,075 | KOH | 1,083 | ||||
| HCl | 1,100 | ||||||
| HCl | 1,125 | ||||||
| HNO3 | 1,060 | ||||||
| HNO3 | 1,085 | ||||||
| HNO3 | 1,120 | ||||||
| HNO3 | 1,150 | ||||||
| NaOH | 1,116 | ||||||
| NaOH | 1,171 | ||||||
| NaOH | 1,231 | ||||||
| NaOH | 1,274 | ||||||
| H2SO4 | 1,070 | ||||||
| H2SO4 | 1,105 | ||||||
| H2SO4 | 1,145 |
Задание 14. Напишите уравнения гидролиза (ионные и молекулярные) и укажите среду водных растворов солей, приведенных в таблице. Какие вещества могут уменьшить гидролиз соли №2? Какие вещества могут усилить гидролиз соли №3?
• Составьте уравнения ступенчатой электролитической диссоциации сероводородной кислоты. Приведите значения константы ионизации кислоты по первой и второй ступеням • Гидролиз по аниону S2-






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
• Составьте уравнения ступенчатой электролитической диссоциации сероводородной кислоты. Приведите значения константы ионизации кислоты по первой и второй ступеням
• Гидролиз по аниону S 2- может протекать в соответствии со следую щичи уравнениями:
первая ступень: S 2- + HOH ↔ HS — + OH —
вторая ступень: HS — + HOH ↔ H 2 S + OH —
Приведите выражения константы гидролиза по этим ступеням. Рассчитайте константы гидролиза, используя ионное произведение воды и константы ионизации сероводородной кислоты. Сравните глубину протекания гидролиза первой и второй ступеням. Какой ступенью практически ограничивается гидролиз по S 2- ?
• Какая среда (кислая, нейтральная, щелочная) в растворах сульфида натрия. Подтвердите ответ уравнениями гидролиза.
• Составьте уравнения гидролиза А1С13 и BCl 3 . Какой из процессов обратим и почему?
Какие продукты образуются при сливании AlCl 3 и Na 2 S ?
Вычислите молярную концентрацию ионов водорода в растворе щелочи с рН 12,1
Решение :
Сероводород – слабая кислота, ступенчато диссоциирует:
Составим выражения константы гидролиза сульфид ионов:
первая ступень: S 2- + HOH ↔ HS — + OH —
вторая ступень: HS — + HOH ↔ H 2 S + OH —
Константы диссоциации кислот и оснований неорганических (Таблица)
Справочная таблица константы диссоциации кислот и оснований по общей и неорганической химии содержит следующую информацию: название и формула гидрооксида и кислоты и соответствующие им константы диссоциации . Таблица содержит справочный материал, необходимый для решения задач по общей и неорганической химии. Предназначено для школьников и студентов.
К — константа диссоциации кислот и оснований
pK — величина, которая определяется как отрицательный десятичный логарифм константы диссоциации (часто используется вместо константы).
http://natalibrilenova.ru/-sostavte-uravneniya-stupenchatoj-elektroliticheskoj-dissotsiatsii-serovodorodnoj-kislotyi-privedite-znacheniya-konstantyi-ionizatsii-kislotyi-po-pervoj-i-vtoroj-stupenyam—gidroliz-po-anionu-s2-/
http://infotables.ru/khimiya/277-konstanty-dissotsiatsii-kislot-i-osnovanij-neorganicheskikh-tablitsa


