Уравнение константы скорости реакции первого порядка
Константа скорости химической реакции. Энергия активации
И.М. Эммануэль, Д.Г. Кнорре.
Источник:И.М. Эммануэль, Д.Г. Кнорре. Курс химической кинетики, изд. «Высшая школа», 1979, с.73-76.
При заданных внешних условиях (температура, давление, среда, в которой происходит процесс) скорость химического превращения является функцией только концентраций компонентов реакционной смеси. Уравнение, описывающее зависимость скорости химического процесса от концентрации компонентов реакционной смеси, называется кинетическим уравнением химического процесса.
Очень часто в химической кинетике приходится иметь дело с процессами, скорость которых оказывается пропорциональной произведению концентраций реагирующих веществ в соответствующих степенях.
Если зависимость скорости реакции от концентрации реагирующих веществ записывается в виде

то величины ni (i = I, 2, . I) принято называть порядком реакции по веществу Аi.
Сумму порядков реакции по всем реагирующим веществам называют порядком реакции. Множитель и в кинетическом уравнении (1), показывающий, с какой скоростью идет химический процесс при концентрациях реагирующих веществ, равных единице, называется константой скорости химического процесса. Наряду со скоростью константа скорости химического процесса является основной величиной в химической кинетике.
Степенная зависимость скорости реакции от концентраций реагирующих веществ (1) практически всегда выполняется для скорости отдельных стадий химического процесса. При этом как порядок по отдельному компоненту, так и суммарный порядок реакции являются целыми положительными числами. Для отдельной стадии порядок реакции никогда не превышает трех. Поэтому особо важное значение в химической кинетике имеют реакции первого, второго и третьего порядка.
Константы скорости реакций различного порядка имеют разную размерность. Поскольку размерность скорости реакции независимо от кинетического уравнении этой реакции есть [С] [t] -1 , то из (1) следует, что размерность константы скорости для реакции первого порядка [t] -1 , второго порядка [С] -1 [t] -1 , третьего порядка [С] -2 [t] -2 .
В соответствии с этим единицами измерения констант скорости являются:
- для реакции первого порядка: с -1
- для реакции второго порядка: м 3 /молекула · с (м 3 · с -1 ) или М -1 · с -1 [л/(моль · с)]
- для реакции третьего порядка: м 6 /молекула 2 · с (м 6 · с -1 ) или М -2 · с -1 [л 2 /(моль · с)]
При использовании молярных единиц для выражения концентрации при расчетах в системе единиц СИ следует помнить, что это эквивалентно использованию единиц кмоль/м 3 , и поэтому все остальные величины, относимые к определенному количеству вещества (универсальная газовая постоянная, число Авогадро), должны также браться в расчете на 1 киломоль.
Следует подчеркнуть, что константы скорости реакций разных порядков являются разными физическими величинами и сопоставление их абсолютных значений лишено какого бы то ни было смысла. При переходе от одной единицы измерения концентрации к другой константа скорости реакции первого порядка не изменяется, константа скорости реакции второго порядка изменяется в 6,02 · 1026 раз, а константа скорости реакции третьего порядка — в 3,6 · 1053 раз.
Константа скорости химической реакции, как правило, резко растет с повышением температуры. Зависимость константы скорости реакции от температуры в большом числе случаев может быть описана уравнением Аррениуса

где Т — абсолютная температура; k0 и Е — постоянные параметры.
Поскольку концентрация реагирующих веществ практически не зависит от температуры, то такое же соотношение получается и для скорости процесса

где
Относительное увеличение скорости реакции с температурой характеризуется логарифмической производной υ по Т:

Таким образом, чем больше Е, тем быстрее растет скорость реакции с температурой. Для простых реакций параметр Е показывает, какой минимальной энергией (в расчете на один моль) должны обладать реагирующие частицы, чтобы они могли вступить в химическую реакцию. Частицы, энергия которых больше или равна Е, называются активными, а параметр Е в связи с этим называют энергией активации.
Для сложных реакций, состоящих из нескольких стадий, параметр Е в уравнении (2), как правило, не имеет такого простого физического смысла и является некоторой функцией энергии активации отдельных стадий. Тем не менее и в этом случае параметр. Е принято называть энергией активации, хотя правильнее было бы называть его эффективной или эмпирической энергией активации.
Параметр k0 называется предэкспоненциальным множителем.
Параметры Е и k0 могут быть определены из зависимости константы скорости реакции от температуры с помощью уравнения (2), записанного в виде

Скорость химической реакции
Говорить об осуществимости процесса можно по изменению энергии Гибсса системы. Но данная величина не отражает настоящую возможность протекания, механизм и скорость химической реакции.
Понятие скорости химической реакции
Для полноценного представления химической реакции, надо иметь знания о том, какие существуют временные закономерности при ее осуществлении, т.е. скорость химической реакции и ее детальный механизм.
Определение скорости химической реакции:
Скорость химической реакции — это изменение концентрации реагирующих веществ в единицу времени
Скорость и механизм реакции изучает химическая кинетика – наука о химическом процессе.
С точки зрения химической кинетики, реакции можно классифицировать на простые и сложные.
Простые реакции – процессы, протекающие без образования промежуточных соединений. По количеству частиц, принимающих в ней участие, они делятся на мономолекулярные, бимолекулярные, тримолекулярные. Соударение большего чем 3 числа частиц маловероятно, поэтому тримолекулярные реакции достаточно редки, а четырехмолекулярные — неизвестны.
Сложные реакции – процессы, состоящие из нескольких элементарных реакций.
Любой процесс протекает с присущей ему скоростью, которую можно определить по изменениям, происходящим за некий отрезок времени.
Среднюю скорость химической реакции выражают изменением количества вещества n израсходованного или полученного вещества в единице объема V за единицу времени t.
Если вещество расходуется, то ставим знак «-», если накапливается – «+»
При постоянном объеме:
Единица измерения скорости реакции — моль/л·с
В целом, υ — величина постоянная и не зависит от того, за каким участвующим в реакции веществом, мы следим.
Зависимость концентрации реагента или продукта от времени протекания реакции представляют в виде кинетической кривой, которая имеет вид:
Вычислять υ из экспериментальных данных удобнее, если указанные выше выражения преобразовать в следующее выражение:
| υ = — ΔC/Δt [моль/л·с] | |
Закон действующих масс. Порядок и константа скорости реакции
Одна из формулировок закона действующих масс звучит следующим образом:
Скорость элементарной гомогенной химической реакции прямо пропорциональна произведению концентраций реагентов.
Т.е. скорость прямой химической реакции зависит от концентраций исходных веществ.
Если исследуемый процесс представить в виде:
а А + b В = продукты
то скорость химической реакции можно выразить кинетическим уравнением:
а и b – стехиометрические коэффициенты простой реакции,
k – константа скорости реакции.
Химический смысл величины константы скорости реакции k — это скорость реакции при единичных концентрациях.
То есть, если концентрации веществ А и В равны 1, то υ = k.
Надо учитывать, что в сложных химических процессах коэффициенты а и b не совпадают со стехиометрическими.
Закон действующих масс выполняется при соблюдении ряда условий:
- Реакция активируется термично, т.е. энергией теплового движения молекул.
- Концентрация реагентов распределена равномерно.
- Свойства и условия среды в ходе процесса не меняются.
- Свойства среды не должны влиять на k.
К сложным процессам закон действия масс применить нельзя!
Это можно объяснить тем, что сложный процесс состоит из нескольких элементарных стадий, и его скорость будет определяться не суммарной скоростью всех стадий, лишь одной самой медленной стадией, которая называется лимитирующей.
Каждая реакция имеет свой порядок. Определяют частный (парциальный) порядок по реагенту и общий (полный) порядок.
Например, в выражении скорости химической реакции для процесса
а А + b В = продукты
a – порядок по реагенту А
Для простых процессов порядок реакции указывает на количество реагирующих частиц (совпадает со стехиометрическими коэффициентами) и принимает целочисленные значения.
Для сложных процессов порядок реакции не совпадает со стехиометрическими коэффициентами и может быть любым.
Факторы, влияющие на скорость химической реакции
Определим факторы, влияющие на скорость химической реакции υ:
1. Зависимость скорости реакции от концентрации реагирующих веществ
определяется законом действующих масс:
Очевидно, что с увеличением концентраций реагирующих веществ, скорость реакции υ увеличивается, т.к. увеличивается число соударений между участвующими в химическом процессе веществами.
Причем, важно учитывать порядок реакции:
если это n = 1 по некоторому реагенту, то ее скорость прямо пропорциональна концентрации этого вещества.
Если по какому-либо реагенту n = 2, то удвоение его концентрации приведет к росту скорости реакции в 2 2 = 4 раза.
А увеличение концентрации в 3 раза ускорит реакцию в 3 2 = 9 раз.
2. Зависимость скорости реакции от давления
Справедлива для веществ в газообразном состоянии и определяется уравнением Клапейрона – Менделеева , которое связывает концентрацию и давление:
Таким образом, изменение концентрации в системе, а следовательно и скорости реакции имеет прямую зависимость от изменения давления.
Например, для реакции первого порядка, увеличение давления в 2 раза вызовет рост концентрации вещества в 2 раза, что непременно изменит скорость реакции υ – она станет в 2 раза больше.
3. Зависимость скорости реакции от площади поверхности
Для гетерогенных реакций скорость реакции зависит от площади соприкосновения частиц:
где S — площадь соприкосновения частиц, мм 2 ,
Δn — изменение количества веществ, принимающих участие в реакции (исходных веществ или продуктов реакции), моль;
Δt — промежуток времени, с;
Единица измерения скорости гетерогенной реакции, моль/м 2 ⋅с.
Таким образом, вещества реагируют быстрее, если площадь поверхности, на которой может происходить взаимодействие веществ больше.
Растворяя вещество, мы уменьшаем его размеры до размеров молекулы, увеличивая тем самым площадь поверхности.
Поэтому химические процессы между веществами, находящимися в растворенном, жидком или газообразном состоянии имеют большую скорость, чем взаимодействия между твердыми веществами.
4. Зависимость скорости реакции от природы вещества .
В этом случае, большое значение имеет строение электронной оболочки атома, тип химической связи и ее прочность в молекулах, структура вещества, прочность его кристаллической решетки.
Например, натрий будет активнее взаимодействовать с водой, чем олово. Поэтому и скорость взаимодействия натрия с водой выше скорости взаимодействия олова с водой.
5. Зависимость скорости реакции от температуры
определяется правилом Вант-Гоффа и уравнением Аррениуса
Повышая температуру, мы сообщаем молекулам дополнительную энергию (увеличивая, тем самым, энергию активации), которая способствует протеканию реакции.
Поэтому, при повышении температуры скорость химической реакции увеличивается.
Сванте Аррениус в 1889 году, изучая зависимость скорости реакции υ от температуры, установил, что большинство химических процессов подчиняются уравнению:
где k — константа скорости реакции
Еа -энергия активации – минимальная (критическая) энергия, необходимая для осуществления реакции, единица измерения Дж/моль
Т — абсолютная температура
R – газовая постоянная, R = 8,314 Дж/моль·град
A — предэкспоненциальный множитель (частотный фактор), единица измерения совпадает с k. Эта константа выражает вероятность того, что при столкновении молекулы будут ориентированы так, чтобы взаимодействие было возможно.
Если известна константа скорости k при одной температуре Т1, а требуется найти константу скорости k при некой другой температуре Т2, то это легко сделать, если взять логарифм уравнения Аррениуса при Т1 и Т2:
Вычитая второе равенство из первого, получаем:
Уравнение Аррениуса при определении скорости химической реакции (в случае, если υ описывается степенным уравнением) , принимает вид:
Если принять, что концентрации веществ А и В постоянны и прологарифмировать данное выражение, то получим следующее выражение:
Правило Вант-Гоффа
Также удобно пользоваться эмпирическим правилом, которое сформулировал Якоб Вант-Гофф:
увеличение температуры на каждые 10 градусов, приводит к росту скорости реакции в 2 – 4 раза.
Правило Вант-Гоффа имеет математическое выражение:
γ — температурный коэффициент реакции, значения которого лежат в интервале от 2 до 4.
Приведем пример применения правила Вант-Гоффа.
υT1/υT2 = 3 2 = 9. Это означает, что υ возросла в 9 раз.
6. Зависимость скорости реакции от присутствия катализатора
Катализ – это любое изменение скорости реакции под действием катализатора. Он может быть положительным и отрицательным. Суть катализа – генерирование активного субстрата или реагента с участием катализаторов.
Катализатор представляет собой вещество, которое селективно ускоряет химическую реакцию, вступая при этом в промежуточную стадию, но регенирируясь к ее концу (к моменту образования конечных продуктов). Например, в биохимической среде в качестве катализаторов выступают ферменты.
Если такое вещество замедляет химическую реакцию, то оно называется ингибитором.
Влияние катализатора на скорость реакции основывается на том, что он изменяет энергию активации Еа. Понижение энергии активации под действием катализатора схематично представлено на рисунке ниже:
Видно, что веществам А и В требуется большое количество энергии, чтобы образовать конечные продукты. Но в присутствии катализатора для получения конечных продуктов требуется гораздо меньше энергии, т.к. идет понижение полной энергии активации, и тем самым, увеличение скорости реакции.
Обращаю ваше внимание на то, что энергии как начальных, так и конечных веществ остаются одинаковыми в обеих реакциях.
Уравнение константы скорости реакции первого порядка
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
2.1 СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
2.1.1 Кинетическое уравнение химической реакции. Порядок реакции.
Одной из задач, стоящих перед химической кинетикой, является определение состава реакционной смеси (т.е. концентраций всех реагентов) в любой момент времени, для чего необходимо знать зависимость скорости реакции от концентраций. В общем случае, чем больше концентрации реагирующих веществ, тем больше скорость химической реакции. В основе химической кинетики лежит т. н. основной постулат химической кинетики :
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
Т. е. для реакции
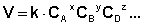
Коэффициент пропорциональности k есть константа скорости химической реакции . Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л.
Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Очевидно, что для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (в уравнении (II.4) соответственно x, y и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (x + y + z) представляет собой общий порядок реакции . Следует подчеркнуть, что порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени.
В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Рассмотрим зависимость концентрации реагирующих веществ от времени для необратимых (односторонних) реакций нулевого, первого и второго порядков.
2.1.2 Реакции нулевого порядка
Для реакций нулевого порядка кинетическое уравнение имеет следующий вид:
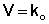
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ; это характерно для многих гетерогенных (идущих на поверхности раздела фаз) реакций в том случае, когда скорость диффузии реагентов к поверхности меньше скорости их химического превращения.
2.1.3 Реакции первого порядка
Рассмотрим зависимость от времени концентрации исходного вещества А для случая реакции первого порядка А ––> В. Реакции первого порядка характеризуются кинетическим уравнением вида (II.6). Подставим в него выражение (II.2):
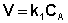
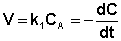
После интегрирования выражения (II.7) получаем:
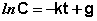
Константу интегрирования g определим из начальных условий: в момент времени t = 0 концентрация С равна начальной концентрации Со. Отсюда следует, что g = ln Со. Получаем:
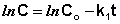
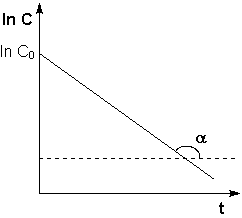
Рис. 2.3 Зависимость логарифма концентрации от времени для реакций
первого порядка
Т.о., логарифм концентрации для реакции первого порядка линейно зависит от времени (рис. 2.3) и константа скорости численно равна тангенсу угла наклона прямой к оси времени.
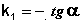
Из уравнения (II.9) легко получить выражение для константы скорости односторонней реакции первого порядка:
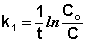
Еще одной кинетической характеристикой реакции является период полупревращения t1/2 – время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной. Выразим t1/2 для реакции первого порядка, учитывая, что С = ½Со:
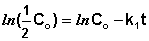
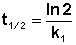
Как видно из полученного выражения, период полупревращения реакции первого порядка не зависит от начальной концентрации исходного вещества.
2.1.4 Реакции второго порядка
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
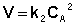
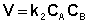
Рассмотрим простейший случай, когда кинетическое уравнение имеет вид (II.14) или, что то же самое, в уравнении вида (II.15) концентрации исходных веществ одинаковы; уравнение (II.14) в этом случае можно переписать следующим образом:
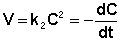
После разделения переменных и интегрирования получаем:
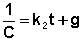
Постоянную интегрирования g, как и в предыдущем случае, определим из начальных условий. Получим:
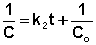
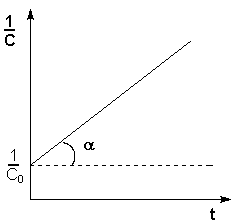
Т.о., для реакций второго порядка, имеющих кинетическое уравнение вида (II.14), характерна линейная зависимость обратной концентрации от времени (рис. 2.4) и константа скорости равна тангенсу угла наклона прямой к оси времени:
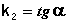
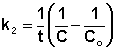
Рис. 2.4 Зависимость обратной концентрации от времени для реакций
второго порядка
Если начальные концентрации реагирующих веществ Cо,А и Cо,В различны, то константу скорости реакции находят интегрированием уравнения (II.21), в котором CА и CВ – концентрации реагирующих веществ в момент времени t от начала реакции:
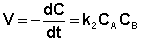
В этом случае для константы скорости получаем выражение
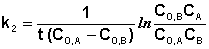
Порядок химической реакции есть формально-кинетическое понятие, физический смысл которого для элементарных (одностадийных) реакций заключается в следующем: порядок реакции равен числу одновременно изменяющихся концентраций. В случае элементарных реакций порядок реакции может быть равен сумме коэффициентов в стехиометрическом уравнении реакции; однако в общем случае порядок реакции определяется только из экспериментальных данных и зависит от условий проведения реакции. Рассмотрим в качестве примера элементарную реакцию гидролиза этилового эфира уксусной кислоты (этилацетата), кинетика которой изучается в лабораторном практикуме по физической химии:
Если проводить эту реакцию при близких концентрациях этилацетата и воды, то общий порядок реакции равен двум и кинетическое уравнение имеет следующий вид:
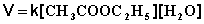
При проведении этой же реакции в условиях большого избытка одного из реагентов (воды или этилацетата) концентрация вещества, находящегося в избытке, практически не изменяется и может быть включена в константу скорости; кинетическое уравнение для двух возможных случаев принимает следующий вид:
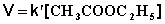
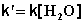
2) Избыток этилацетата:
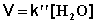
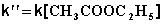
В этих случаях мы имеем дело с т.н. реакцией псевдопервого порядка . Проведение реакции при большом избытке одного из исходных веществ используется для определения частных порядков реакции.
Copyright © С. И. Левченков, 1996 — 2005.
http://zadachi-po-khimii.ru/obshaya-himiya/skorost-ximicheskoj-reakcii.html
http://physchem.chimfak.sfedu.ru/Source/PCC/Kinetics_2.htm