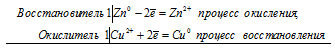Процессы коррозии различных металлов. Интенсивность коррозии
Решение задач по химии на коррозию металлов
Задание 296
Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионно-молекулярные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
Решение:
Если цинковую или медную пластинки опустить в раствор сульфата меди, то в обоих случаях будет наблюдаться выпадение осадка меди. Происходит вытеснение меди цинком и железом, потому что стандартные электродные потенциалы цинка (-0,763 В) и железа (-0,44 В) значительно электроотрицательнее, чем потенциал меди (+0,34 В). Поэтому цинк и железо будут окисляться, а ионы меди Cu 2+ — восстанавливаться до металлической меди:
а) Электрохимические процессы при реакции цинка и сульфата меди
Zn 0 + Сu 2+ = Zn 2+ + Cu 0
б) Электрохимические процессы при реакции железа и сульфата меди
Fe 0 + Сu 2+ = Fe 2+ + Cu 0
Если соединить цинковую и железную пластинки, опущенные в раствор сульфата меди (II) проводником, то будет наблюдаться растворение цинковой пластинки и осаждение меди на железной пластинке. Объясняется это тем, что цинк имеет более электроотрицательный стандартный электродный потенциал, чем железо, поэтому цинк будет окисляться. На железной пластинке будут восстанавливаться ионы меди, так как стандартный электродный потенциал меди имеет большее численное значение, чем потенциал железа.
Анодный процесс: Zn 0 -2 
Катодный процесс: Cu 2+ + 2 
Задание 297
Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов.
Решение:
Стандартные электродные потенциалы железа и цинка равны соответственно -0,44 В и -0,763 В. Потенциал, отвечающий электродному процесс:
2Н + + 2 
В нейтральной среде, равен приблизительно -0,41 В. Следовательно, ионы водорода, находящиеся в воде и в нейтральных водных средах, могут окислять только те металлы, потенциал которых меньше, чем -0,41 В, — это могут быть железо и цинк. Однако, эти металлы в нейтральных растворах, содержащих растворённый кислород, образуют защитную оксидную плёнку, препятствующую дальнейшему разрушению металла. Поэтому железо и цинк не могут быть окислены ионами водорода в нейтральных средах. Атмосферная коррозия – коррозия во влажном воздухе при комнатной температуре. Поверхность металла, находящегося во влажном воздухе, бывает покрыта плёнкой воды, содержащей различные газы, и в первую очередь – кислород. Скорость атмосферной коррозии зависит от рН среды. При понижении рН среды концентрация ионов водорода Н+ возрастает, что приводит к увеличению скорости коррозии металла, увеличивается восстановительный процесс на аноде:
2Н + + 2 
При повышении рН раствора уменьшается концентрация ионов водорода Н + и, соответственно, увеличивается концентрация ионов ОН-, что, согласно принципу Ле Шателье, смещает равновесие в системах: 2Н + + 2 

Электрохимические процессы, протекающие при контакте железа и цинка при контакте с водой с поглощением кислорода (атмосферная коррозия):
Анод: Zn 0 -2 
Катод: 1/2O2 + H2O + 2 
Анод: Zn 0 -2 
Катод: 1/2O2 + H2O + 2 
Задание 298
В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка проходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
Решение:
а) Если цинковую пластинку опустить в раствор электролита, содержащего растворенный кислород, то будет наблюдаться коррозия цинка, характеризующаяся окислением его до ионов Zn 2+ :
Zn 0 -2 
Чрез некоторое время скорость реакции заметно замедляется, потому что чистый цинк окисляется кислородом, растворённым в воде, с образованием оксидной плёнки, которая, покрывая пластинку тонким слоем, пассивирует её. При этом протекает реакция:
Zn + 1/2 O2 = Zn 0
б) Если в раствор электролита опустить цинковую пластинку частично покрытую медью, процесс коррозии будет происходить значительно интенсивнее, так как образуется гальваническая пара Zn — Cu. Цинк имеет более электроотрицательный электродный потенциал (-0,763 В), чем медь (0,34 В), поэтому цинк является анодом, а медь – катодом.
Анодный процесс: Zn 0 -2 
Катодный процесс: в кислой среде: 2Н + + 2 

В нейтральной среде или в щелочной ионы цинка Zn 2+ с гидроксид-ионами ОН- образуют нерастворимое основание, то продуктом коррозии будет Zn(OH)2. В кислой среде ионы цинка Zn 2+ с ионами кислотного остатка будут образовывать соль и при этом выделяется газообразный водород. Происходит интенсивное разрушение цинковой пластинки частично покрытой медью.
Уравнение коррозионных процессов серебра и железа
8.2 ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Причиной электрохимической коррозии * является возникновение на поверхности металла короткозамкнутых гальванических элементов *.
В тонком слое влаги, обычно покрывающем металл, растворяются кислород, углекислый, сернистый и другие газы, присутствующие в атмосферном воздухе. Это создает условия соприкосновения металла с электролитом *. Различные участки поверхности любого металла обладают разными потенциалами. Причинами этого могут быть наличие примесей в металле, различная обработка отдельных его участков, неодинаковые условия (окружающая среда), в которых находятся различные участки поверхности металла. При этом участки поверхности металла с более электроотрицательным потенциалом становятся анодами и растворяются.
Электрохимическая коррозия может развиваться в результате контакта различных металлов. В этом случае будет возникать не микр о- , а макрогальванопара , и коррозия называется контактной (см. детальную классификацию видов коррозии). Сочетания металлов, сильно отличающихся значениями электродных потенциалов *, в технике недопустимы (например, алюминий – медь). В случае коррозии, возникающей при контакте какого-либо металла со сплавом, последний имеет потенциал, соответствующий наиболее активному металлу, входящему в состав сплава. Например, при контакте латуни (сплав цинка и меди) с железом корродировать будет латунь за счет наличия в ней цинка.
Представим схематично работу короткозамкнутого гальванического элемента, возникающего на поверхности металла, подверженного коррозии в электролите * (рисунок 8.1). Анодный участок имеет более электроотрицательный потенциал, поэтому на нем идет процесс окисления металла. Образовавшиеся в процессе окислен ия ио ны переходят в электролит, а часть освободившихся при этом электронов может перемещаться к катодному участку (на рисунке 8.1 показано стрелками). Процесс коррозии будет продолжаться в том случае, если электроны, перешедшие на катодный участок, будут с него удаляться. Иначе произойдет поляризация электродов *, и работа коррозионного гальванического элемента прекратится.
Рисунок 8.1 – Схема электрохимической коррозии. Д – деполяризатор
Процесс отвода электронов с катодных участков называется деполяризацией. Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами. На практике чаще всего приходится встречаться с двумя типами деполяризации: водородной и кислородной. Тип деполяризации (катодный процесс) зависит от реакции среды раствора электролита.
В кислой среде электрохимическая коррозия протекает с водородной деполяризацией. Рассмотрим коррозию железной пластинки с примесями меди во влажной хлористоводородной атмосфере Имеется в виду атмосфера с примесью газообразного HCl. . В этом случае железо будет анодом ( E ° = –0,44В), а медь – катодом ( E ° =+0,34В). На анодном участке будет происходить процесс окисления железа, а на катодном – процесс деполяризац ии ио нами водорода, которые присутствуют в электролите:
А: Fe – 2e → Fe 2+ – окисление
К: 2 H + + 2e → H2 ↑ – восстановление
Схема возникающего короткозамкнутого гальванического элемента выглядит следующим образом:
A (–) Fe | HCl | Cu (+) К
В нейтральной среде коррозия протекает с кислородной деполяризацией, т.е. роль деполяризатора выполняет кислород, растворенный в воде. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде, почве и в незагрязненной промышленными газами атмосфере. Если коррозии во влажном воздухе подвергается железо с примесями меди, то электродные процессы можно записать в виде:
(А) Fe – 2e → Fe 2+ – окисление
(К) 2 H2O + O2 + 4e → 4 OH – – восстановление
У поверхности металла в электролите протекают следующие реакции:
Fe 2+ + 2 OH – → Fe( OH)2
Основная масса черных металлов разрушается вследствие процесса ржавления, в основе которого лежат вышеуказанные реакции.
Коррозия металла в результате неравномерного доступа кислорода . Случаи электрохимической коррозии, возникающей вследствие неравномерной аэрации кислородом различных участков металла, очень часто встречаются в промышленности и в подземных сооружениях. Примером может служить коррозия стальной сваи, закопанной в речное дно (рис 8.2).
Рисунок 8.2 – Коррозия в результате неравномерного доступа кислорода. Б – техническое сооружение; А – анодный участок; К – катодный участок.
Часть конструкции, находящаяся в воде, омывается растворенным в ней кислородом и, в случае возникновения условий для электрохимической коррозии, будет выполнять роль катода. Другая же часть конструкции, находящаяся в почве, будет анодом и подвергнется разрушению.
Составьте уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого серебром, во влажном воздухе и в кислой среде?
Химия | 10 — 11 классы
Составьте уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого серебром, во влажном воздухе и в кислой среде.
Определите тип покрытия — анодное или катодное?
Какие продукты образуются в результате?
Fe + 2H( + ) → Fe(2 + ) + H2↑
В нейтральной среде (влажный воздух) :
Fe(0) — 2e → Fe(2 + ) | x2
2H2O + O2 + 4e → 4OH( — )
2Fe + 2H2O + O2 → 2Fe + 4OH( — ) (2Fe(OH)2↓)
Но Fe(OH)2 на воздухе быстро окисляется, поэтому получается :
4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3↓.
Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе?
Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе.
На какой из этих пластинок быстрее образуется ржавчина?
Составьте электронные уравнения анодного и катодного процессов коррозии этих пластинок.
Каков состав продуктов коррозии железа?
Железное изделие покрыли кадмием, составить электронное уравнение анодного и катодного процессов атмосферной коррозии при нарушении покрытия в нейтральной среде?
Железное изделие покрыли кадмием, составить электронное уравнение анодного и катодного процессов атмосферной коррозии при нарушении покрытия в нейтральной среде.
Приведите анодный и катодный процессы коррозии железа с одним из протекторов во влажной среде с доступом кислорода?
Приведите анодный и катодный процессы коррозии железа с одним из протекторов во влажной среде с доступом кислорода.
Как протекает атмосферная коррозия железа, покрытого слоем никеля, если покрытие нарушено?
Как протекает атмосферная коррозия железа, покрытого слоем никеля, если покрытие нарушено?
Составьте электронные уравнения катодного и анодного процессов.
Каков состав продуктов коррозии.
Железо покрыто тонким слоем олова?
Железо покрыто тонким слоем олова.
Какой из металлов будет подвергаться коррозии в случае частичного разрушения покрытия?
Составьте схему образующегося гальванического элемента и приведите уравнения анодного и катодного процессов, если коррозия происходит в кислотной среде.
Железное издание покрыли марганцем?
Железное издание покрыли марганцем.
Какое это покрытие — анодное или катодное?
Составте электронные уравнения анодного и катодного процессов и сумарной реакции процесса коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте.
Какие продукты коррозии образуются в первом и во втором случаях?
Стальной сосуд (основа железо), покрытый серебром, имеет глубокие царапины?
Стальной сосуд (основа железо), покрытый серебром, имеет глубокие царапины.
Напишите электронные уравнения процессов на аноде и катоде при коррозии сосуда в растворе соляной кислоты.
Какой металл растворяется при коррозии?
Какое то покрытие анодное или катодное?
Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары Mg — Pb?
Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары Mg — Pb.
Изделие из меди покрыто хромом?
Изделие из меди покрыто хромом.
Какое это покрытие – анодное или катодное?
Приведите уравнения анодного и катодного процессов при коррозии сплава Fe — Sn во влажном воздухе и в кислой среде?
Приведите уравнения анодного и катодного процессов при коррозии сплава Fe — Sn во влажном воздухе и в кислой среде.
Определите продукты коррозии.
На этой странице находится вопрос Составьте уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого серебром, во влажном воздухе и в кислой среде?. Здесь же – ответы на него, и похожие вопросы в категории Химия, которые можно найти с помощью простой в использовании поисковой системы. Уровень сложности вопроса соответствует уровню подготовки учащихся 10 — 11 классов. В комментариях, оставленных ниже, ознакомьтесь с вариантами ответов посетителей страницы. С ними можно обсудить тему вопроса в режиме on-line. Если ни один из предложенных ответов не устраивает, сформулируйте новый вопрос в поисковой строке, расположенной вверху, и нажмите кнопку.
А — 6 Б — 4 В — 3 Г — 1 N — 2энерго. Уровня He — 1 энерго уровень Si — 3эн уровня Ti — 4 эн уровня Zn — 5 эн уровня.
C + 2H2 = CH4⇒CH4 + Br2 = CH3Br + HBr⇒CH3Br + CH3Br + Na = C2H6⇒C2H6 + Br2 = C2H5Br + HBr⇒C2H5Br + C2H5Br + 2Na = C4H10 + 2NaBr⇒C4H10 + O2 = 2CH3COOH 2CH4(крекинг) = С2Н2 + 3Н2 С2Н6(крекинг) = C2H4 + H2 C2H4(кркеинг) = C2H2 + H2 2C4H10 + 13O2 = 8CO2 ..
Окей. Смотри вкладыш.
Решение задачи находится на фото.
2СH4 — > CH = — CH + 3H2 ( t = 1500) CH = — CH + H2 — > CH2 = CH2 (t, kat) CH2 = CH2 + H2 — > CH3 — CH3 (t, kat) 2C2H6 + 7O2 — >4CO2 + 6H2O 250 г Х г C6H5NO2 + 3H2 — > C6H5NH2 + 2H2O n = 1 моль n = 1 моль М = 123 г / моль М = 93 г / моль m = 123 г m ..
C6H5NO2 + 6H = C6H5NH2 + 2H2O n(C6H5NO2) = m(C6H5NO2) / M(C6H5NO2) = 250гр / 123г / моль = примерно = = 2, 03 моль n(C6H5NO2) = n(C6H5NH2) = примерно = 2, 03 моль m(C6H5NH2) = n(C6H5NH2) x M(C6H5NH2) = 2, 03 моль х 93гр / моль = примерно = 189 гр Отв..
1) Растворить 2) Отфильтровать 3) Выпарить.
http://www.chem-astu.ru/chair/study/genchem/r8_2.htm
http://himia.my-dict.ru/q/2392391_sostavte-uravnenia-anodnogo-i-katodnogo-processov/