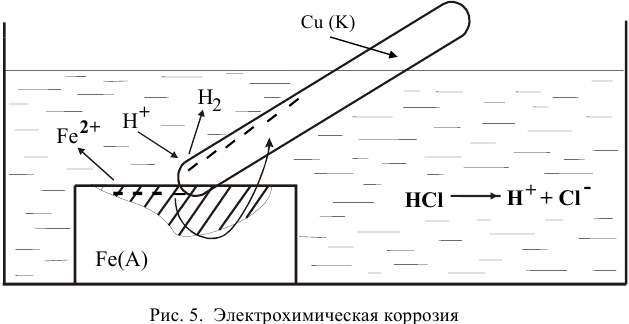
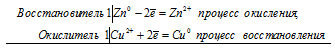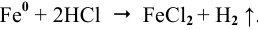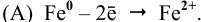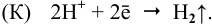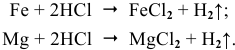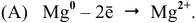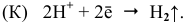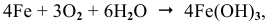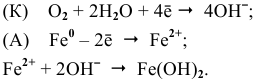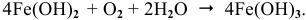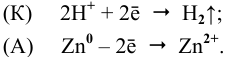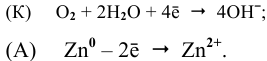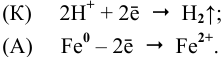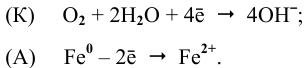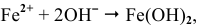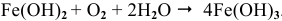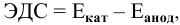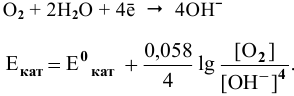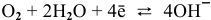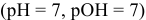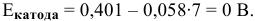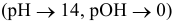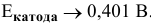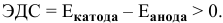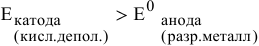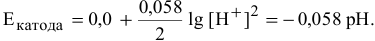Процессы коррозии различных металлов. Интенсивность коррозии
Решение задач по химии на коррозию металлов
Задание 296
Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионно-молекулярные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
Решение:
Если цинковую или медную пластинки опустить в раствор сульфата меди, то в обоих случаях будет наблюдаться выпадение осадка меди. Происходит вытеснение меди цинком и железом, потому что стандартные электродные потенциалы цинка (-0,763 В) и железа (-0,44 В) значительно электроотрицательнее, чем потенциал меди (+0,34 В). Поэтому цинк и железо будут окисляться, а ионы меди Cu 2+ — восстанавливаться до металлической меди:
а) Электрохимические процессы при реакции цинка и сульфата меди
Zn 0 + Сu 2+ = Zn 2+ + Cu 0
б) Электрохимические процессы при реакции железа и сульфата меди
Fe 0 + Сu 2+ = Fe 2+ + Cu 0
Если соединить цинковую и железную пластинки, опущенные в раствор сульфата меди (II) проводником, то будет наблюдаться растворение цинковой пластинки и осаждение меди на железной пластинке. Объясняется это тем, что цинк имеет более электроотрицательный стандартный электродный потенциал, чем железо, поэтому цинк будет окисляться. На железной пластинке будут восстанавливаться ионы меди, так как стандартный электродный потенциал меди имеет большее численное значение, чем потенциал железа.
Анодный процесс: Zn 0 -2 
Катодный процесс: Cu 2+ + 2 
Задание 297
Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов.
Решение:
Стандартные электродные потенциалы железа и цинка равны соответственно -0,44 В и -0,763 В. Потенциал, отвечающий электродному процесс:
2Н + + 2 
В нейтральной среде, равен приблизительно -0,41 В. Следовательно, ионы водорода, находящиеся в воде и в нейтральных водных средах, могут окислять только те металлы, потенциал которых меньше, чем -0,41 В, — это могут быть железо и цинк. Однако, эти металлы в нейтральных растворах, содержащих растворённый кислород, образуют защитную оксидную плёнку, препятствующую дальнейшему разрушению металла. Поэтому железо и цинк не могут быть окислены ионами водорода в нейтральных средах. Атмосферная коррозия – коррозия во влажном воздухе при комнатной температуре. Поверхность металла, находящегося во влажном воздухе, бывает покрыта плёнкой воды, содержащей различные газы, и в первую очередь – кислород. Скорость атмосферной коррозии зависит от рН среды. При понижении рН среды концентрация ионов водорода Н+ возрастает, что приводит к увеличению скорости коррозии металла, увеличивается восстановительный процесс на аноде:
2Н + + 2 
При повышении рН раствора уменьшается концентрация ионов водорода Н + и, соответственно, увеличивается концентрация ионов ОН-, что, согласно принципу Ле Шателье, смещает равновесие в системах: 2Н + + 2 

Электрохимические процессы, протекающие при контакте железа и цинка при контакте с водой с поглощением кислорода (атмосферная коррозия):
Анод: Zn 0 -2 
Катод: 1/2O2 + H2O + 2 
Анод: Zn 0 -2 
Катод: 1/2O2 + H2O + 2 
Задание 298
В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка проходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
Решение:
а) Если цинковую пластинку опустить в раствор электролита, содержащего растворенный кислород, то будет наблюдаться коррозия цинка, характеризующаяся окислением его до ионов Zn 2+ :
Zn 0 -2 
Чрез некоторое время скорость реакции заметно замедляется, потому что чистый цинк окисляется кислородом, растворённым в воде, с образованием оксидной плёнки, которая, покрывая пластинку тонким слоем, пассивирует её. При этом протекает реакция:
Zn + 1/2 O2 = Zn 0
б) Если в раствор электролита опустить цинковую пластинку частично покрытую медью, процесс коррозии будет происходить значительно интенсивнее, так как образуется гальваническая пара Zn — Cu. Цинк имеет более электроотрицательный электродный потенциал (-0,763 В), чем медь (0,34 В), поэтому цинк является анодом, а медь – катодом.
Анодный процесс: Zn 0 -2 
Катодный процесс: в кислой среде: 2Н + + 2 

В нейтральной среде или в щелочной ионы цинка Zn 2+ с гидроксид-ионами ОН- образуют нерастворимое основание, то продуктом коррозии будет Zn(OH)2. В кислой среде ионы цинка Zn 2+ с ионами кислотного остатка будут образовывать соль и при этом выделяется газообразный водород. Происходит интенсивное разрушение цинковой пластинки частично покрытой медью.
ПРИМЕРЫ РЕШЕНИЯ ТИПОВЫХ ЗАДАЧ
Задача 1. Склепаны два металла а) Mn – Al и б) Sn – Bi . Укажите, какой из металлов подвергается коррозии в атмосферных условиях:
Решение. а) Al имеет более отрицательное значение стандартного электродного потенциала (Е° (Al 3+ /Al) = -1,663 В), чем марганец.
Схема коррозионного гальванического элемента будет выглядеть следующим образом
Cхема коррозионного процесса: Al – 3 e = Al 3+
б) В этом случае растворяться будет олово (Е° (Sn 2+ /Sn) = -0,136 В), так как имеет более отрицательный стандартный электродный потенциал, чем Bi (Е° (Bi 3+ /Bi) =0,215 В) и, следовательно, является электрохимически более активным.
Cхема коррозионного процесса: Sn – 2e = Sn 2+
Задача 2. Какие из нижеперечисленных металлов выполняют для свинца роль анодного покрытия: Pt, Al, Cu, Hg ?
Решение. Анодное покрытие – это нанесение на защищаемое изделие электрохимически более активного металла. Из перечисленных
металлов электрохимически более активным (по сравнению со свинцом) является алюминий (см. ряд напряжений металлов).
Задача 3. Какие из нижеперечисленных металлов выполняют для свинца роль катодного покрытия: Ti, Mn, Ag, Cr ?
Решение. Катодное покрытие – это нанесение на защищаемое изделие электрохимически менее активного металла. Из перечисленных металлов электрохимически менее активным (по сравнению со свинцом) является серебро (см. ряд напряжений металлов). Ответ: Ag.
Задача 4.Как происходит коррозия цинка, находящегося в контакте с кадмием в кислой среде (HCl). Составьте схему коррозионного гальванического элемента и запишите реакции, протекающие при его работе. Какой металл будет подвергаться коррозии?
Решение. Цинк имеет более отрицательный электродный потенциал (Е° (Zn 2+ /zn) = -0,763 В), чем кадмий (Е° (Cd 2+ /Cd) = — 0,403 В), поэтому он является анодом, а кадмий – катодом.
25
Схема коррозионного гальванического элемента будет выглядеть следующим образом
Cхема коррозионного процесса: Zn — 2ē → Zn 2+
В молекулярном виде токообразующая реакция имеет следующий вид: Zn + 2HCl = ZnCl2 + H2
Задача 5.Как влияет амальгамирование алюминия на скорость его коррозии в атмосферных условиях?
Решение. В обычных условиях алюминий покрыт пленкой гидроксида (или оксида), предохраняющей его от дальнейшего окисления. Если алюминий опустить в раствор соли ртути, то он как более активный металл, будет вытеснять Hg из раствора:
В результате реакции на поверхности алюминия образуется пленка металлической ртути, или, точнее, сплав ртути и алюминия — амальгама. При атмосферных условиях (влажный воздух) на поверхности амальгамы имеется тонкая пленка влаги, в которой растворен кислород. В образовавшейся коррозионной гальванопаре алюминий, как более активный металл, будет заряжаться отрицательно и подвергаться окислению, а ртуть — положительно, и на ней будет идти процесс восстановления кислорода:
Схема коррозионного процесса: 
4Al + 3O2 + 6H2O = 4Al 3+ + 12OH —
Так как скорость восстановления кислорода (не выделение кислорода!) на ртути значительно больше, чем на алюминии, то восстановление О2 идет преимущественно на ртути.
Образующаяся в этом сопряженном процессе рыхлая пленка гидроксида алюминия (4Al 3+ + 12OH — = 4Al(OH)3) не предохраняет его от дальнейшего окисления. Поэтому скорость коррозии амальгамированного алюминия значительно больше, чем чистого.
Задача 6. Цинковая и железная пластины помещены в водный
раствор NaCl (аналог морской воды) и подсоединены к внешнему источнику постоянного тока: цинковая — к (-), а железная к (+) полюсу. Какая из пластин защищена от коррозии? Запишите уравнения коррозионного процесса.
Решение. Так как цинковая пластина подсоединена к отрицательному полюсу источника тока, она будет являться катодом и не будет корродировать, а железная пластина, присоединенная к (+) — анодом. Под действием электрического тока в образованной системе будет протекать электролиз.
Aнод (+): Fe — 2e = Fe 2+
Задача 7.Запишите процессы, протекающие при коррозии трубопроводов при использовании цинковых протекторов.
Решение. Цинковые пластины, подсоединенные к стальному трубопроводу, образуют гальванопару, в которой Zn, как более активный металл, является анодом и окисляется, тогда как на стали идет реакция восстановления кислорода.

Задача 8.Скорость коррозии стали в кислой среде 0,2 г/м 2 ·ч. Общая площадь поверхности стальной конструкции 100 м 2 . Какой силы ток нужно пропустить через стальную конструкцию, чтобы полностью подавить коррозию?
Решение. Общее уменьшение массы стали за 1 час составляет:
m = n · S = 0,2 · 100 = 20 г/ч
По закону Фарадея сила тока, необходимая для подавления коррозии равна I = m · F/t · Э или I = 20 · 96500/3600 ·28 = 19 А.
Задача 9.В каких из перечисленных ниже водных растворах: а) NaCl; б) NH4OH; в) NaOH; г) HCl и H2SO4 никель будет коррозионно устойчив? Ответы обосновать.
Решение: а) В водном растворе NaCl оксидная пленка на поверхности
никеля будет растворятся. Это связано с тем, что ионы Cl — (также как и ионы Br — и I — ), адсорбируясь на поверхности оксидной пленки, вытесняют и замещают кислород, делая ее растворимой и пористой. Это увеличивает скорость анодного процесса и коррозия никеля будет протекать по схеме:
б) Никель в водном растворе NH4OH будет корродировать, так как молекулы NH3, связывая ионы Ni 2+ в слабодиссоциированные комплексные ионы, смещают потенциал никеля (-0,25 В) в более отрицательную сторону до значений -0,49 В, т.е. металл становится активнее:

Для расчета потенциала никеля, связанного в комплексный ион, необходимо воспользоваться уравнением Нернста (1) и значениями константы нестойкости комплекса (2):
E = E o + 2,3 RT/F · ln [Ni 2+ ] (1)
в) В растворе NaOH Ni не корродирует, так как оксидная пленка никеля, покрывающая металл трудно растворима и обладает основными свойствами.
г) Разбавленные растворы HCl и H2SO4 растворяют оксидную пленку, и никель, как имеющий более отрицательный потенциал, чем потенциал выделения водорода, растворяется с водородной деполяризацией по схеме:
Ni + 2H + = Ni 2+ + H2
Задача 10.Какие коррозионные процессы протекают, если стальная конструкция, находящаяся в морской воде (раствор NaCl), подсоединена к отрицательному источнику тока, а к
положительному подсоединен жертвенный кусок железа.
Решение. Этот способ защиты основан на процессе электролиза. В воде всегда есть растворенный кислород, поэтому на стальной конструкции идет процесс восстановления растворенного в воде кислорода, а не воды, так как потенциал восстановления кислорода больше потенциала восстановления воды:
2Н2О + 2е = Н2 + 2ОН — Е о = — 0,41 В
Жертвенный кусок железа, являясь анодом, окисляется Fe – 2e = Fe 2+ и стальная конструкция становится защищенной.
Задача 11.Для контактной пары металлов Sn-Cd определите, с какой деполяризацией протекает коррозия металла из данной пары а) в среде с рН = 4; б) При каких значениях рН прекратится процесс выделения водорода, если раствор будет деаэрирован?
Предложите для данного сплава анодное и катодное покрытие. Изменятся или не изменятся коррозионные процессы при нарушении сплошности покрытий?
Решение. а) Потенциалы водородного и кислородного электродов зависят от рН по уравнениям Ен + ∕н2 = — 0,059 · рН, В и Ео2∕ н2о = 1,23-0,059·рН, В. Следовательно при рН = 4 потенциал водородного электрода равен -0,236 В, а кислородного +0,994 В.
Следовательно, в присутствии кислорода процесс коррозии будет протекать с кислородной деполяризацией, так как в этом случае создается большая ЭДС и, следовательно, большая движущая сила процесса. Кадмий (Е° (Cd 2+ /Cd) = — 0,403 В) как имеющий более отрицательный потенциал будет служить анодом, т.е растворяться (Cd – 2е = Cd 2+ ), а на олове (Е° (Sn 2+ /Sn) = -0,136 В), будет восстанавливаться кислород: O2 + 2H2O +4e = 4OH — .
б) Если из раствора будет удален кислород, то процесс коррозии будет протекать с водородной деполяризацией:
Анод: Cd – 2е = Cd 2+ ; Катод: 2Н + + 2е = Н2
Чтобы определить, при каком значении рН прекратится выделение водорода, необходимо приравнять потенциалы кадмиевого и водородного электродов: -0,403 = — 0,059 · рН; рН = 6,83
Отсюда при рН = 6,83 коррозия кадмия прекращается.
в) Так как анодом является кадмий, то протектором для него будет являться металл, имеющий потенциал отрицательнее кадмиевого электрода. К числу таких металлов следует отнести Zn (Е° (Zn 2+ /zn) = -0,763 В), Cr (-0,903 B), Al (-1,663 B).
г) В качестве катодных покрытий можно использовать металлы, имеющие более положительный потенциал, чем у кадмия: Ni
(Е° (Ni 2+ /Ni) = -0,25 B), Sn (Е° (Sn 2+ /Sn) = -0,136 В), Pb (Е° (Pb 2+ /Pd) = -0,126В). При нарушении сплошности такого покрытия в зависимости от того аэрирован раствор или нет, будет наблюдаться растворение кадмия, как в случаях а) и б).
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте уравнения анодного и катодного процессов.
2. Медь не вытесняет водород из разбавленных кислот. Почему? Однако если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Дайте этому объяснение и составьте уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
3. Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте уравнения анодного и катодного процессов.
4. Если пластинку из чистого цинка опустить в разбавленную кислоту, то начинающееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой
на последней начинается бурное выделение водорода. Дайте этому объяснение, составив уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
5. В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте уравнения анодного и катодного процессов.
6. Железное изделие покрыли никелем. Какое это покрытие – анодное или катодное? Почему? Составьте уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
7. Составьте уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний – никель. Какие продукты коррозии образуются в первом и во втором случаях?
8. В раствор НС1 поместили цинковую пластину и цинковую пластину, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив уравнения соответствующих процессов.
9. Почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в кислой среде.
10. Какое покрытие металла называется анодным, а какое – катодным? Назовите несколько металлов, которые могут служить анодными и катодными покрытиями для железа. Составьте уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью, во влажном воздухе и в кислой среде.
11. Железное изделие покрыли кадмием. Какое это покрытие – анодное или катодное? Почему? Составьте уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
12. Железное изделие покрыли свинцом. Какое это покрытие –
анодное или катодное? Почему? Составьте уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
13. Две железные пластины, частично покрытые оловом и медью, находятся во влажном воздухе. На какой из этих пластин быстрее
образуется ржавчина? Почему? Составьте уравнения анодного и катодного процессов коррозии этих пластин. Каков состав продуктов коррозии железа?
14. Какой металл целесообразней выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля: цинк, магний или хром?
Составьте уравнения анодного и катодного процессов атмосферной коррозии. Какой состав продуктов коррозии?
15. Если опустить в разбавленную серную кислоту пластину из чистого железа, то выделение на ней водорода идет медленно и со временем почти прекращается. Однако если цинковой палочкой прикоснуться к железной пластине, то на последней начинается бурное выделение водорода. Почему? Какой металл при этом растворяется? Составьте уравнения анодного и катодного процессов.
16. Цинковую и железную пластины опустили в раствор сульфата меди. Составьте уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинах, если наружные концы их соединить проводником?
17. Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте уравнения анодного и катодного процессов атмосферной коррозии этих металлов.
18. В раствор электролита, содержащего растворенный кислород, опустили цинковую пластину и цинковую пластину, частично покрытую медью. В каком случае процесс коррозии цинка проходит интенсивнее? Составьте уравнения анодного и катодного процессов.
19. Составьте уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при
коррозии пары алюминий – железо. Какие продукты коррозии образуются в первом и во втором случаях?
20. Как протекает атмосферная коррозия железа, покрытого слоем никеля, если покрытие нарушено? Составьте уравнения анодного и катодного процессов. Каков состав продуктов коррозии? Что изменится если эту систему поместить в соляную кислоту.
21. Серебряную и цинковую пластины опустили в раствор сульфата меди. Составьте уравнения реакций, происходящих на этих пластинах. Какие процессы будут проходить на пластинах, если
наружные концы их соединить проводником?
22. Одно железное изделие покрыли никелем, другое – оловом. Какие это покрытия? Почему? Составьте уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия в кислой среде. В каком случае коррозия будет происходить активнее?
23. Составьте уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары олово-медь. Какие продукты коррозии образуются в первом и во втором случаях?
24. Свинцовую и цинковую пластины опустили в раствор нитрата серебра. Составьте уравнения реакций, происходящих на этих пластинах. Какие процессы будут проходить на пластинах, если наружные концы их соединить проводником?
25. Почему в конструкциях, омываемых водой, не следует одновременно применять детали из железа и алюминиевых сплавов? Приведите схему коррозии в случае небрежной эксплуатации таких деталей. Составьте уравнения анодного и катодного процессов.
26. В каком случае будет быстрее разрушаться цинковое покрытие: а) железного изделия; б) кобальтового изделия? Почему? Напишите уравнения анодного и катодного процессов, происходящих при коррозии в кислой среде.
27. Трущиеся поверхности гребных валов защищают от коррозии, применяя облицовки из бронзы (сплава меди с оловом). Составьте схему коррозии стального вала в морской воде при появлении в облицовке трещин.
28. Приведите примеры катодного и анодного покрытия для кобальта. Составьте уравнения анодных и катодных процессов во влажном воздухе и в растворе соляной кислоты при нарушении целостности покрытия.
29. Медь не вытесняет водород из растворов кислот. Однако если к медной пластине, опущенной в кислоту, прикоснуться цинковой палочкой, то на меди начинается бурное выделение водорода.
Почему? Написать уравнения реакций.
30. Выделение водорода на пластие из чистого железа, опущенной в раствор соляной кислоты, протекает достаточно медленно. Скорость
выделения водорода значительно возрастает, если железо будет находиться в контакте с цинком. Что изменилось? Какой из металлов будет корродировать?
31. Учитывая величину перенапряжения реакции восстановления водорода, объясните, почему амальгамирование цинка резко снижает его коррозию, а контакт с медью — увеличивает? Запишите коррозионные процессы.
32. Почему контакт с никелем усиливает коррозию цинка в кислой среде? На каком металле идет выделение водорода? В контакте с каким металлом, никелем или платиной, цинк корродирует быстрее?
33. Как влияет контакт с никелем, свинцом и медью (раздельно) на скорость коррозии олова в кислых средах? Запишите схемы коррозионных процессов.
34. Никель очень медленно выделяет водород из кислот. Почему скорость выделения водорода на никеле резко возрастает, если он находится в контакте с цинком? Какой металл при этом окисляется? Почему выделение водорода идет преимущественно на никеле?
35. Корродирует ли медь в водных растворах HCl, NH4OH в присутствии кислорода? Запишите реакции. С какой деполяризацией
возможна коррозия меди?
36. Как протекает коррозия меди в атмосферных условиях? Чем вызвано образование зеленого налета на медных изделиях после длительного пребывания на воздухе? Чем можно объяснить образование черного налета на меди после ее нагревания?
37. Почему в обескислороженной воде железо практически не корродирует, а в атмосферных условиях скорость коррозии железа значительна? Запишите возможные схемы коррозионных процессов.
38. Как и почему влияют на скорость коррозии цинка примеси Cu, Pb, Fe? Объяснить и написать соответствующие реакции.
39. Какие процессы протекают при коррозии оцинкованного железа с нарушенным покрытием в водном растворе NaCl и в атмосферных
условиях? Составьте схемы коррозионных гальванических элементов. Какую роль играет присутствие в воде хлорида натрия?
40. Как протекает коррозия луженой меди с нарушенным покрытием в кислой среде и в атмосферных условиях? Какой металл
подвергается коррозии? Составьте схемы коррозионных гальванических элементов и запишите реакции. Что изменится, если олово заменить на серебро?
41. Вода не действует на алюминий даже при повышенной температуре. Почему при попадании в воду NaCl алюминий начинает корродировать? В растворе каких солей NaCl или NH4Cl скорость
коррозии Al выше? Напишите схемы коррозионных процессов.
42. Почему железо, менее активный металл, корродирует в атмосферных условиях быстрее алюминия? Сравните коррозионную устойчивость этих металлов в чистой воде и в водном растворе NaCl.
43. Какие из приведенных сплавов меди являются наиболее коррозионно устойчивыми? латунь: (20% — 80% Cu, остальное Zn); бронза: (90%Cu + 10%Sn); мельхиор: (80% Cu + 20% Ni).
44. В каких средах (рН=0, рН=7, рН=14) цинк более коррозионно устойчив? Запишите уравнения коррозионных процессов. Постройте графическую зависимость скорости коррозии цинка от рН среды?
45. Будет ли железо коррозионно устойчиво в водных растворах NaCl, Cu(NO3)2, NiCl2? Запишите схемы коррозионных процессов.
46. Какой из металлов, Be или Mg, будет более коррозионно стоек при рН>7? Напишите схему коррозионного процесса.
47. Как влияют на скорость коррозии алюминия примеси Cu, Pb, Fe?
48. Какие процессы протекают при коррозии оцинкованного и луженого железа с нарушенным покрытием в водном растворе СаCl2 и в атмосферных условиях? Составьте схемы коррозионных гальванических элементов. Какую роль играет присутствие в воде хлорида кальция?
49. Покрытые алюминием и медью железные пластины с нарушенными покрытиями находятся во влажном воздухе. На какой из пластин появится ржавчина? Составьте схемы коррозионных гальванических элементов и запишите уравнения протекающих реакций.
50. Магнивая пластина в контакте с железной находятся в морской воде. С какой деполяризацией протекает коррозия? Запишите уравнения реакций.
51. Как протекает коррозия освинцованной меди с нарушенным
покрытием и меди в контакте с марганцем в кислой среде и в атмосферных условиях? Какой из металлов подвергается коррозии? Составьте схемы коррозионных гальванических элементов и запишите реакции.
52. Объясните, почему хромовое защитное покрытие на стали может быть пористым, а оловянное должно быть сплошным? Составьте схемы коррозионных процессов для атмосферных условий.
53. Как протекает коррозия покрытого титаном стального изделия с нарушенным покрытием в кислой и в нейтральной средах? Запишите
54. Какой из металлов подвергается коррозии, если оцинкованная и никелированная стальные детали с нарушенным покрытием находится в кислой среде? Составьте схему коррозионного гальванического элемента и запишите реакции.
55. Алюминий и никель в контакте с медью находится в кислой среде. Какой из металлов подвергается коррозии? Какая реакция протекает на защищенном металле?
56. В каком из растворов: сульфата или хлорида меди, кадмий более энергично вытесняет медь? Учитывая, что в результате гидролиза солей среда является слабокислой, составьте схемы коррозионных процессов.
57. Объясните, почему в местах контакта стали с магнием возникает язвенная коррозия алюминия. Запишите коррозионные процессы для атмосферных условий.
58. Железо, покрытое свинцом и кадмием находится во влажном грунте. Как будет протекать коррозия при нарушении целостности покрытий? Катодом или анодом будет железо в образовавшейся гальванопаре?
59. В контакте с каким из металлов, Pb или Fe, цинк более коррозионно нестоек в морской воде? Ответ дайте на основании данных: hО2 Zn >hO2 Pb >hO2 Fe .
60. Алюминивая и железная пластины, находящиеся в водном растворе NaCl, подсоединены к источнику постоянного тока: А1 к (-), а Fe к (+). Какая из пластин защищена от коррозии? Составьте схему коррозионных процессов.
61. Катодный метод защиты паровых котлов от коррозии заключается в том, что одним из электродов является сам котел, а другой электрод помещается внутри котла. Подаваемый через такую систему слабый ток подавляет коррозию. Какой из электродов и почему является катодом? Напишите уравнения протекающих реакций.
62. Железная конструкция, имеющая площадь 850 м 2 и находящаяся в морской воде, теряет 10 кг металла в год. Какова скорость коррозии и какой силы ток надо подать на конструкцию при катодной защите, чтобы полностью подавить коррозию?
63. Кадмий в контакте с серебром находится в кислой среде. Какую силу тока дает образующаяся гальванопара, если за 2 часа ее работы выделилось 0,2 л водорода? Сколько граммов металла при этом окислилось?
64. Железная пластина на воздухе при высокой температуре окисляется с образованием на ее поверхности оксида Fe2O3. За 3 часа масса пластины площадью 1 м 2 увеличилась на 10 г. Рассчитать среднюю скорость коррозии. Чтобы произошло бы с пластиной, если
бы она была помещена в соляную кислоту?
65. Стальной баллон заполнен кислородом с примесью паров воды. Через некоторое время количество кислорода в нем уменьшилось на 0,18 л. Рассчитать, сколько граммов металла при этом прореагировало? Записать схему коррозионного процесса.
66. При коррозии омедненного цинка за 45 с выделилось 0,09 л водорода (н.у.). Сколько граммов цинка при этом окислилось?
67. При стоянке судна у причала для защиты его корпуса от коррозии применяют катодную защиту. Площадь подводной части судна 1000 м 2 . Скорость коррозии без применения катодной защиты 10 -2 г/м 2 в сутки. Какой силы ток надо подать на корпус судна, чтобы полностью подавить коррозию?
68. Срок службы стальных дренажных труб общей площадью 10 5 м 2 ,
Определить скорость травления меди, если в процессе травления за
корродирующих в болотном грунте со скоростью 10 г/м 2 в год, составляет 20 лет. Какова скорость коррозии? Сколько цинка (по массе) необходимо взять для протекторной защиты труб, чтобы срок их службы увеличить в два раза?
69. Найти наименьший вес цинкового протектора, приходящегося на 1м 2 поверхности стального трубопровода, если предельно допустимое количество корродирующего металла составляет 0,6 кг/м 2 год, а срок службы трубопровода должен быть не менее 25 лет.
70. Средняя скорость равномерной коррозии стали в кислой среде 20 г/м 2 час. Определить за какое время толщина пластины площадью
1 дм 2 уменьшится вдвое. Первоначальная толщина пластины равна 3 мм, а плотность стали 7,8 г/см 3 .
71. Как изменяется толщина стальной пластинки за год и каков срок ее службы, если известно, что скорость коррозии равна 10 -6
г/см 2 сутки, а предельно допустимое уменьшение ее в размерах 10 -3 см. Плотность стали 7,8 г/см3 .
72. В стеклянный сосуд, заполненный серной кислотой, опущена пластинка технического цинка, площадь поверхности которой 0,05 м 2 .
Через 5 суток количество выделившегося водорода составило 10 л. Найти сколько цинка растворилось и рассчитать среднюю скорость коррозии в г/м 2 час. Написать уравнения коррозионных процессов.
73. Образец стали поверхностью 1 дм 2 при коррозионных испытаниях в 1 М Н2SO4 потерял в весе 0,1 г за 10 суток. Рассчитать скорость коррозии стали в г/дм 3 час и А/см 2 . Написать уравнения коррозионных процессов.
74. Какое количество цинка должно корродировать в минуту в Н2SO4 при токе коррозии 30 мА? Какова скорость выделения водорода?
75. Шнековый (винтообразный) питатель, изготовленный из стали, имеющий площадь поверхности 10 м 2 , подает увлажненную CuSO4 в реактор, объем 1 м 3 . Максимально допустимое содержание ионов Fe 2+ в реакторе 10 -5 г/л. Рассчитать максимально допустимую скорость коррозии шнека в г/см 2 час и А/см 2 , если время пребывания смеси в реакторе 10 час. Написать уравнения коррозионных процессов.
76. В производстве печатных плат травление меди осуществляется в растворе хлорного железа Cu + 2FeCl3 = CuCl2 + 2FeCl2
2 часа образовалось 10 кг FeCl2 и площадь поверхности меди 10 4 см 2 .
Задачи с решениями на коррозию металлов
Коррозия металлов. Методы защиты металлов от коррозии
Задача 74
Железная пластинка погружается в разбавленный раствор 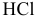
Решение:
При погружении железной пластинки в раствор 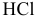
При касании железа медью образуется короткозамкнутый гальванический элемент, состоящий из железного и медного электродов, загруженных в раствор электролита. Медный электрод играет роль катода, так как он имеет более высокий электродный потенциал. На катоде должен протекать процесс восстановления, а на аноде — железной пластине — процесс окисления:
Таким образом, железо продолжает растворяться, причем скорость электрохимического процесса выше, чем скорость обычного окислительно-восстановительного процесса.
На катоде происходит деполяризация, т.е. процесс восстановления каких-либо частиц, называемых деполяризатором, избытком электронов.
В кислой среде роль деполяризатора играют катионы водорода:
Таким образом, водород выделяется с поверхности меди, несмотря на отсутствие взаимодействия 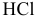
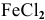
Задача 75
Две пластинки — одна железная, а другая магниевая -погружены раздельно в разбавленную соляную кислоту. Что изменится, если соединить обе пластинки?
Решение:
Обе пластинки, находящиеся раздельно в разбавленной 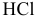
При объединении пластин образуется короткозамкнутый гальванический элемент, и протекает электрохимическая коррозия. Магний, будучи более активным металлом, играет роль анода. На аноде происходит процесс окисления:
На катоде — железной пластинке — будет происходить водородная деполяризация:
Таким образом, при соприкосновении двух пластин наблюдается усиление выделения водорода с поверхности железа, хотя разрушение железа резко уменьшается, а активизируется процесс разрушения магниевой пластины. Выделение водорода с поверхности магния резко сокращается.
Задача 76
Кладут в один стакан, содержащий солевой раствор, кусочек чистого железа, а в другой стакан, содержащий такой же солевой раствор, — кусочек железа, соединенный с кусочком свинца. В оба стакана есть доступ кислороду воздуха. Через несколько дней определяют содержание ионов железа в обоих стаканах. В каком из стаканов концентрация ионов железа будет больше ?
Решение:
Кислород растворяется в водном растворе. Железо, погруженное в солевой раствор, в присутствии растворенного кислорода будет подвергаться коррозии, хотя и медленно, так как оно чистое, а чистые металлы медленно корродируют (обычно присутствие примесей в железе (чугуне) резко увеличивает скорость коррозии).
Процесс коррозии чистого железа может быть представлен следующей схемой:
где 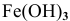
Железо в контакте с менее активным свинцом играет роль анода и подвергается электрохимической коррозии с кислородной деполяризацией на свинцовом катоде:
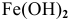
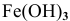
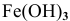
Скорость электрохимической коррозии намного выше скорости химической коррозии, поэтому в стакане, содержащем железо, соединенное со свинцом, концентрация ионов железа 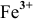
Задача 77
Описать процессы электрохимической коррозии, протекающие на оцинкованном железе при наличии трещин в защитном слое:
а) в кислой среде;
б) в нейтральной среде в присутствии кислорода.
Решение:
Покрытие железа цинком относится к анодным покрытиям, так как металл покрытия более активный, чем защищаемый металл, а значит, в случае протекания электрохимической коррозии он играет роль анода.
В кислой среде на поверхности катода, т.е. на поверхности железа, протекает водородная деполяризация (рис.6):
В нейтральной среде в присутствии кислорода на поверхности катода (железа) протекает кислородная деполяризация (рис.7):
Продукт коррозии, образующийся по реакции
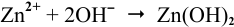
Задача 78
Описать процессы электрохимической коррозии,
протекающей на хромированном железе при наличии трещин в защитном слое:
а) в кислой среде;
б) в нейтральной среде в присутствии кислорода.
Решение:
Покрытие железа хромом относится к катодным покрытиям, так как металл покрытия менее активный, чем защищаемый металл, а значит, в случае протекания электрохимической коррозии он играет роль катода.
Защищаемый металл играет роль анода, т.е. подвергается разрушению.
В кислой среде на поверхности катода, т.е. на поверхности хрома, протекает водородная деполяризация (рис.8):
В нейтральной среде в присутствии кислорода на поверхности катода (хрома) протекает кислородная деполяризация (рис.9):
Продукт коррозии, образующийся по реакции
на воздухе окисляется:
Задача 79
Объяснить, почему в стальном сосуде застойная зона подвергается интенсивной коррозии (нейтральная среда в присутствии кислорода воздуха), тогда как в цинковом сосуде, наоборот, застойная зона подвергается коррозии в незначительной степени.
Решение:
Интенсивность (скорость) электрохимической коррозии зависит от ЭДС образующегося короткозамкнутого элемента: чем больше величина ЭДС, тем интенсивнее электрохимическая коррозия.
Для электрохимической коррозии ЭДС рассчитывается аналогично расчету ЭДС гальванического элемента:
где 
Для электродной полуреакции кислородной деполяризации
В зоне, подверженной воздействию кислорода, электродный потенциал катодных участков будет выше, чем в застойной зоне (концентрация кислорода в растворе находится в числителе). Таким образом, в начальный момент ЭДС микрогальваноэлементов в зоне, подверженной воздействию кислорода, будет выше, чем ЭДС микрогальваноэлементов в застойной зоне, а значит, коррозия анодных участков в зонах, подверженных воздействию кислорода, будет значительной. Эта коррозия в начальный момент приводит к накоплению анионов 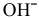
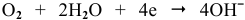
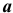
В сосуде из цинка коррозия зон, подверженных воздействию кислорода, всегда будет очень интенсивной, так как щелочная среда не пассивирует цинк, а наоборот, способствует его разрушению:
Поэтому застойная зона меньше подвергается коррозии, чем аэрируемая.
Задача 80
Показать необходимыми расчетами, что платина в контакте с золотом никогда не подвергается электрохимической коррозии, тогда как медь в контакте в золотом подвергается электрохимической коррозии только в присутствии кислорода в щелочной среде.
Решение:
Для процесса кислородной деполяризации
электродный потенциал определяется по формуле Нернста:
В нейтральной среде
В щелочной среде
Для того, чтобы протекала электрохимическая коррозия, необходимо следующее:
Таким образом, электродный потенциал металла (анода) должен быть ниже 0 В в нейтральной среде или ниже 0,401 В в сильно щелочной среде (рН=14). Если находятся в контакте золото и платина, платина играет роль анода, но ее стандартный электродный потенциал 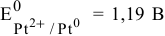
Медь в контакте с золотом может подвергаться электрохимической коррозии с кислородной деполяризацией, особенно в щелочной среде, так как 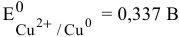
Остается показать отсутствие электрохимической коррозии с водородной деполяризацией для обоих случаев.
Электродный потенциал водородной деполяризации выражается уравнением:
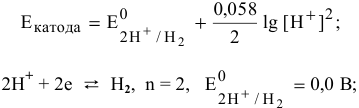
В кислой среде
В слабокислой среде
Таким образом, металлы, имеющие электродный потенциал выше 0 В, в кислой среде не подвергаются электрохимической коррозии с водородной деполяризацией.
Эти задачи взяты со страницы решения задач по неорганической химии:
Возможно эти страницы вам будут полезны:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
http://helpiks.org/4-21172.html
http://lfirmal.com/zadachi-s-resheniyami-na-korroziyu-metallov/