Метан: способы получения и свойства
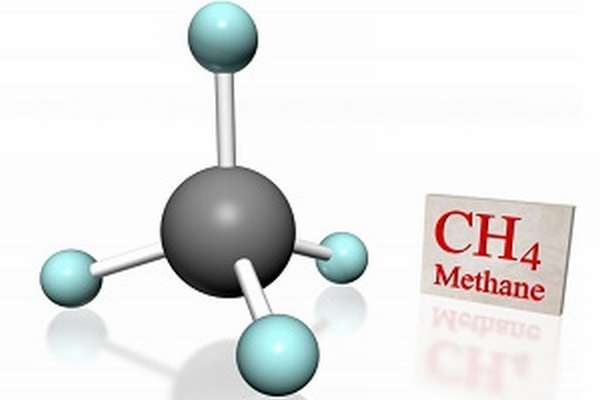
Метан CH4 – это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней.
Гомологический ряд метана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Строение метана
В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp 3 :
При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода |
Изомерия метана
Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Химические свойства метана
Метан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикальные реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
Для метана характерны реакции радикального замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
Бромирование протекает более медленно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
Например. При нитровании метана образуется преимущественно нитрометан:2. Реакции разложения метана (д егидрирование, пиролиз)При медленном и длительном нагревании до 1500 о С метан разлагается до простых веществ: Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен: Пиролиз метана – промышленный способ получения ацетилена. 3. Окисление метанаАлканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.). 3.1. Полное окисление – горениеАлканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты. Уравнение сгорания алканов в общем виде: При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С. Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода: Эта реакция используется для получения сажи. 3.2. Каталитическое окисление
Продукт реакции – так называемый «синтез-газ». Получение метана1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета. Реакция больше подходит для получения симметричных алканов. Получить таким образом метан нельзя. 2. Водный или кислотный гидролиз карбида алюминияЭтот способ получения используется в лаборатории для получения метана. 3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении. R–COONa + NaOH → R–H + Na2CO3 Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты. При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия: 4. Синтез Фишера-ТропшаИз синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды: Это промышленный процесс получения алканов. Синтезом Фишера-Тропша можно получить метан: 5. Получение метана в промышленностиВ промышленности метан получают из нефти, каменного угля, природного и попутного газа . При переработке нефти используют ректификацию, крекинг и другие способы. Метан химические свойства Химические свойства метана ничем не отличаются от свойств, присущих всем веществам класса алканов. В школьном курсе химии метан изучают одним из первых веществ органики, так как он является одним из простейших представителей алканов. В его составе один атом углерода и четыре атома водорода. Формула метана и способы его получения
Общая формула гомологического ряда алканов CnH2n+2. Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества. В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp3: При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу: Это соответствует тетраэдрическому строению молекулы.
Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных. – предельный углеводород, поэтому он не может вступать в реакции присоединения. Для метана характерны реакции: Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов. Поэтому для метана характерны только радикальные реакции. Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой. [править] Химические свойстваПервый член гомологического ряда насыщенных (метановых) углеводородов. Метан представляет собой малоактивное в химическом отношении вещество. При обычных условиях он достаточно устойчив к воздействию кислот, щелочей и окислителей. Так, при пропускании метана через раствор KMnO4, который является достаточно сильным окислителем, он не окисляется, и фиолетовая окраска раствора не исчезает. В реакции присоединения (ассоциации) метан не вступает, поскольку в его молекуле все четыре валентности атома углерода полностью насыщены. Для метана, как и других насыщенных углеводородов, типичны реакции замещения, при которых атомы водорода замещаются атомами других элементов или атомными группами. Характерна для метана также реакция с хлором, которая происходит при обычной температуре под влиянием рассеянного света (при прямом солнечном свете может произойти взрыв). При этом атомы водорода в молекуле метана последовательно замещаются атомами хлора:
Вследствие реакции образуется смесь хлорпроизводных метана. В атмосфере воздуха метан горит бесцветным пламенем с выделением значительного количества тепла: С воздухом метан образует огнеопасную взрывную смесь. При нагревании метана без доступа воздуха до температуры выше 1000 ° C он разлагается на элементы — на углерод (сажу) и водород: Декарбоксилирование солей карбоновых кислот (реакция Дюма)Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении. R–COONa + NaOH →R–H + Na2CO3 Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты. При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия: [править] Распространение в природеМетан является основным компонентом:
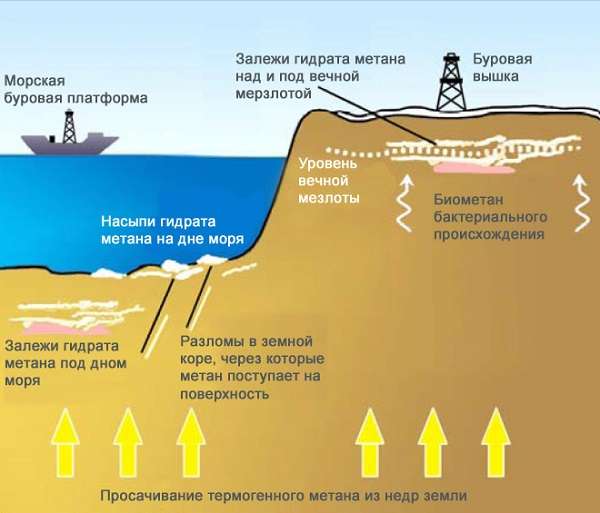
Большое количество метана растворено в водах океанов, морей, озер. Среднее содержание метана в водах Мирового океана составляет около 10−2 см3 / л, общее количество — 14 · 1012 м3. Количество метана, растворенного в пластовых водах, на несколько порядков выше его промышленных запасов. Метан присутствует также в атмосферах Земли, Юпитера, Сатурна, Урана; в газах поверхностного грунта Луны. Основная масса метана лито- и гидросферы Земли образовалась при биохимической и термокаталитической деструкции рассеянного органического вещества, угля и нефтей. Метан образуется при анаэробном разложении органических веществ, в частности целлюлозы (метановое брожение). В природе Земли метан достаточно распространен. Горючие природные газы состоят на 90-97 % из метана. Он образует ряд месторождений, из которых добывается и по газопроводам подается к месту использования. На дне болот и прудов метан образуется в результате разложения остатков растений без доступа воздуха. Поэтому его называют еще болотным газом. Под названием «рудничный газ» метан накапливается в угольных шахтах, в результате выделения из пластов угля и сопутствующих пород, в которых находится в свободном и связанном виде. На действующих шахтах наблюдается выделение метана из угольных пластов в объеме до 70-80 м3/т с. б. м. (т с. б. м. — тонна сухой беззольной массы), что делает экономически целесообразным его самостоятельное или сопутствующее (дегазация) извлечения из угольных месторождений. Рудничный газ очень опасен, так как с воздухом может образовывать взрывчатую смесь. Наиболее взрывоопасные концентрации метана в воздухе — 9-14 %. Основной компонент природных (77-99 %), попутных нефтяных (31-90 %), рудничного и болотного газов. При низких температурах метан образует соединения включения — газовые гидраты, широко распространенные в природе. Газовые гидраты — твердые кристаллические вещества плотностью 880—890 кг/м3, похожие на снег или лед. Гидратообразования происходят в пористой среде осадочного чехла с формированием газогидратных залежей. Формула метана и способы его получения
Метан в больших количествах содержится в атмосфере. Мы не обращаем внимания на нахождение этого газа в воздухе, ведь на нашем организме это никак не отражается, а вот канарейки очень чувствительны к метану. Когда-то они даже помогали шахтерам спускаться под землю. Когда процентное содержание метана изменялась, птицы переставали петь. Это служило сигналом для человека, что он спустился слишком глубоко и нужно подниматься наверх. Образуется метан в результате распада остатков живых организмов. Не случайно с английского methane переводится, как болотный газ, ведь он может быть обнаружен в заболоченных водоемах и каменноугольных шахтах. Основным источником газа в агропромышленном комплексе является рогатый скот. Да, метан они выводят из организма вместе с остальными продуктами жизнедеятельности. Кстати, увеличение числа рогатого скота на планете может привести к разрушению озонового слоя, ведь метан с кислородом образуют взрывоопасную смесь. Метан в промышленности можно получить с помощью нагревания углерода и водорода или синтеза водяного газа, все реакции протекают в присутствии катализатора, чаще всего никеля. В США разработана целая система по добыче метана, она способна извлечь до 80% газа из природного угля. На сегодняшний день мировые запасы метана оцениваются экспертами в 260 триллионов метров кубических! Даже запасы природного газа значительно меньше. В лаборатории метан получают путем взаимодействия карбида алюминия (неорганическое соединение алюминия с углеродом) и воды. Также с помощью гидроксида натрия, вступающего в реакцию с ацетатом натрия, более известного как пищевая добавка Е262. [править] ПрименениеБольшие количества метана используются как удобное и дешевое топливо. Неполное сжигание метана дает сажу, которая идет на изготовление печатной краски и как наполнитель каучука, а при термическом разложении (выше 1000 °C) получают сажу и водород, используемый для синтеза аммиака. Продукт полного хлорирования метана — четырёххлористый углерод CCl4 — является хорошим растворителем жиров и применяется для извлечения жиров из зерен масличных растений. Метан служит также исходным веществом для получения ацетилена, метилового спирта и многих других химических продуктов. Предупреждение взрыва бытового газаЗная, из-за чего чаще всего взрывается газ в квартирах, можно составить перечень действий по предупреждению аварий.
Кроме того, важно прислушиваться к запахам и следить за герметичностью вентилей, кранов, фланцевых соединений. При малейшем подозрении обращаться в газовую службу, осуществляющую поставку горючего.
Поскольку многоквартирные дома ставят жильцов в зависимость друг от друга, иногда приходится следить не только за собственным газовым оборудованием. В случае, если соседи нарушают технику безопасности, необходимо написать заявление в газовую службу. В нем нужно указать точный адрес, причину обращения, фамилии жителей, подписавших заявление, сведения о нарушителях, дату фиксации. Причиной может быть наличие запрещенного оборудования, нарушение правил эксплуатации, запах газа. [править] Метан как рудничный газС воздухом метан образует взрывчатые смеси. При содержании в воздухе до 5-6 % метан горит около источника тепла (температура воспламенения 650—750 ° С), при содержании 5-16 % — взрывается, свыше 16 % — может гореть при притоке кислорода, снижение при этом концентрации метана взрывоопасное. Метан имеет слабое наркотическое действие. ПДК 300 мг/м3. Выделение метана в выработках шахт создает особую опасность при добыче угля. Различают три формы выделения метана в горных выработках: обычное, суфлярное и внезапное. По метанообильности, согласно «Правилам безопасности в угольных шахтах», шахты делятся на 5 категорий. Критерием такого деления является относительная метанообильность, то есть количество метана в кубометрах, выделяемой за сутки на 1 т среднесуточной добычи:
Шахты, разрабатывающие пласты, опасные или угрожающие по внезапным выбросам угля, газа и породы, принадлежат к особой категории — опасных по внезапным выбросам. Перспективным считается добыча метана из угольных пластов. В конце XX века этой проблемой только в США занимались ученые из 40 университетов, задействовано около 100 фирм. В промышленности метан применяют для получения синтез-газа, ацетилена, хлороформа, четыреххлористого углерода, технического углерода и др. Продукты неполного окисления метана являются исходными для изготовления пластмасс, используемых в органическом синтезе. Основные причины взрыва газаЧтобы понять, от чего может взорваться обычный бытовой газ, достаточно обратиться к сводкам газовых служб. «Почетное» первое место по распространенности занимает безграмотное хранение баллонов с пропаном. Дающие утечку старые емкости годами лежат на антресолях, в чуланах, кухонных нишах под окном. Для взрыва скопившегося горючего бывает достаточно одной небольшой искры.
На втором месте расположились ошибки, связанные с небрежной установкой оборудования – падение баллонов или нагревание их расположенными поблизости отопительными приборами довольно часто становится причиной детонации. На третье вышли неисправности магистрального газопровода, утечки из-за ошибок монтажа: негерметичные соединения, износ шлангов, неправильное подключение плит. Сюда же относятся несанкционированные изменения проекта, исключающие эффективную вентиляцию, самостоятельные подключения дополнительного оборудования. Четвертое место отведено невнимательности пользователей, допускающих заливание форсунок плиты жидкостью. Попав на сопло, вода гасит огонь, но не перекрывает выход газа. Скопление взрывчатого вещества при отсутствии проветривания быстро достигает критических значений.
И последнее, пятое место долгие годы удерживает безответственность владельцев старых баллонов. Решив дать емкости новую жизнь, практичные жильцы распиливают, разрезают, различными способами вскрывают резервуар, чтобы приспособить для разных нужд. Это грубая ошибка. Даже кажущийся абсолютно пустым баллон всегда содержит остаточный газ. Поэтому каждое действие, направленное на самостоятельное вскрытие – шаг к катастрофе. Если взрыв уже произошелАлгоритм действий при взрыве идентичен. Если есть возможность, необходимо перекрыть вентили и покинуть помещение. При вызове следует указать на факт взрыва, обратиться за помощью к медикам, пожарным и газовщикам. Звонок можно сделать по единому телефону 112.
В 90 процентах случаев взрыв газа сопровождается пожаром. Поэтому действия при такой аварии идентичны спасению из огня. Для этого необходимо:
В некоторых ситуациях разумнее дождаться спасателей, нежели эвакуироваться самостоятельно. Поэтому важно грамотно оценить риски, не поддаваться панике.
После выхода из дома спасатели советуют отойти от здания как можно дальше, оставаться на безопасной дистанции до тех пор, пока не будут устранены все источники опасности. Об этом жильцов оповещают сотрудники аварийных служб. Порядок действий при угрозе взрываНеправильно вскрытый или упавший баллон не оставит выбора – вещество сдетонирует мгновенно. А при обнаружении утечки почти всегда есть время для нейтрализации газа. Утечка может быть обнаружена четырьмя способами: посредством газоанализаторов, методом намыливания стыков, при появлении запаха, ощущении исходящего холода от соединений. Во всех случаях необходимо:
Звонить спасателям лучше, уже выйдя на улицу. До приезда специалистов желательно следить за входом в дом, чтобы никто не мог проникнуть в загазованные квартиры.
Главное, при обнаружении утечки – быстро и без паники покинуть помещение. Поэтому, если обнаруживаются трудности с поиском кранов или открыванием окон, лучше оставить все как есть и выйти на улицу. источники: http://tvercult.ru/nauka/metan-himicheskie-svoystva http://clinicagernetic.ru/otravlenie/metan-eto.html |