Коллигативные свойства растворов
Любому раствору характерны те или иные физические свойства, к которым относятся и коллигативные свойства растворов. Это такие свойства, на которые не оказывает влияние природа растворенного вещества, а зависят они исключительно от количества частиц этого растворенного вещества.
К коллигативным свойствам растворов относятся:
- Понижение давление паров
- Повышение температуры кипения
- Понижение температуры затвердевания (кристаллизации)
- Осмотическое давление раствора.
Рассмотрим подробнее каждое из перечисленных свойств.
Понижение давления паров
Давление насыщенного пара (т.е. пара, который пребывает в состоянии равновесия с жидкостью) над чистым растворителем называется давлением или упругостью насыщенного пара чистого растворителя.
Если в некотором растворителе растворить нелетучее вещество, то равновесное давление паров растворителя при этом понижается, т.к. присутствие какого – либо вещества, растворенного в этом растворителе, затрудняет переход частиц растворителя в паровую фазу.
Экспериментально доказано, что такое понижение давления паров напрямую зависит от количества растворенного вещества. В 1887 г. Ф.М. Рауль описал количественные закономерности коллигативных свойств растворов.
Первый закон Рауля
Первый закон Рауля заключается в следующем:
Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
p — давление пара над раствором, Па;
p0 — давление пара над чистым растворителем, Па;
χр-ль — мольная доля растворителя.
nв-ва и nр-ля – соответственно количество растворенного вещества и растворителя, моль.
Иногда Первому закону Рауля дают другую формулировку:
относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества:
При этом принимаем, что χв-ва + χр-ль= 1
Изотонический коэффициент Вант-Гоффа
Для растворов электролитов данное уравнение приобретает несколько иной вид, в его состав входит изотонический коэффициент i:
Δp — изменение давления паров раствора по сравнению с чистым растворителем;
i – изотонический коэффициент.
Изотонический коэффициент (или фактор Вант-Гоффа) — это параметр, не имеющий размерности, который характеризует поведение какого – либо вещества в растворе.
То есть, изотонический коэффициент показывает, разницу содержания частиц в растворе электролита по сравнению с раствором неэлектролита такой же концентрации. Он тесно связан связан с процессом диссоциации, точнее, со степенью диссоциации и выражается следующим выражением:
n – количество ионов, на которые диссоциирует вещество.
α – степень диссоциации.
Повышение температуры кипения или понижение температуры затвердевания (кристаллизации). Второй закон Рауля
Равновесное давление паров жидкости имеет тенденцию к увеличению с ростом температуры, жидкость начинает кипеть, при уравнивании давления ее паров и внешнего давления.
При наличии нелетучего вещества, давление паров раствора снижается, и раствор будет закипать при более высокой температуре, по сравнению с температурой кипения чистого растворителя.
Температура замерзания жидкости также определяется той температурой, при которой давления паров жидкой и твердой фаз уравниваются.
Ф.М. Рауль доказал, что повышение температуры кипения, так же как и понижение температуры замерзания разбавленных растворов нелетучих веществ, прямо пропорционально моляльной концентрации раствора и не зависит от природы растворённого вещества. Это правило известно как Второй закон Рауля:
K — криоскопическая константа,
mв-ва — моляльность вещества в растворе.
Растворы электролитов не подчиняются Законам Рауля. Но для учёта всех несоответствий Вант-Гофф предложил ввести в приведённые уравнения поправку в виде изотонического коэффициента i, учитывающего процесс распада на ионы молекул растворённого вещества:
Осмотическое давление раствора
Некоторые материалы имеют способность к полупроницаемости, т.е. им свойственно пропускать частицы определенного вида и не пропускать частицы другого вида.
Перемещение молекул растворителя (но не растворенного, в нем вещества), через полупроницаемую мембрану в раствор с большей концентрацией из более разбавленного представляет собой такое явление как осмос.
Представим два таких раствора, которые разделены полупроницаемой мембраной, как показано на рисунке выше. Растворы стремятся к выравниванию концентраций, поэтому вода будет проникать в раствор, тем самым уменьшая его концентрацию.
Для того, чтобы осмос приостановить, необходимо приложить внешнее давление к раствору. Такое давление, которое требуется приложить, называется осмотическим давлением.
Осмотическое давление и концентрацию раствора неэлектролита позволяет связать уравнение Вант — Гоффа, которое напоминает уравнение идеального газа Клапейрона – Менделеева:
где C — молярная концентрация раствора, моль/м 3 ,
R — универсальная газовая постоянная (8,314 Дж/моль·К);
T — абсолютная температура раствора.
Преобразуем уравнение следующим образом:
C = n/V = m/(M·V)
π = т·R·T / M·V или
Для растворов электролитов осмотическое давление определяется уравнением, в которое входит изотонический коэффициент:
где i — изотонический коэффициент раствора.
Для растворов электролитов i > 1, а для растворов неэлектролитов i = 1.
Если полупроницаемой перегородкой разделены два раствора, имеющие одинаковое осмотическое давление, то перемещение растворителя через перегородку отсутствует. Такие растворы называются изотоническими.
Раствор, с меньшим осмотическим давлением, по сравнению с более концентрированным раствором, называют гипотоническим, а раствор с большей концентрацией – гипертоническим.
Осмотическое давление – определение, уравнение и примеры
Определение осмотического давления
Осмотическое давление можно рассматривать как давление, необходимое для предотвращения распространения воды через барьер осмос, Другими словами, это относится к тому, как сильно вода «проталкивается», чтобы пройти через барьер, чтобы распространиться на другую сторону.
Осмотическое давление определяется растворенное вещество концентрация – вода будет «стараться» диффундировать в область с высокой концентрацией растворенного вещества, такого как соль, чем в область с низкой концентрацией.
В действительности, конечно, осмотическое давление – это не «желание» воды двигаться, а скорее продолжение естественного закона, согласно которому вся материя со временем будет случайным образом распределяться. Когда концентрации веществ различны в двух областях, и области имеют контакт друг с другом, случайное движение частиц заставит вещества диффундировать до решение равномерно по всей области.
Осмос является особенным диффузия воды через полупроницаемую мембрану. Таким образом, в случае осмоса растворенные вещества не могут двигаться, потому что они не могут проходить через мембрану. Однако вода может двигаться, и это происходит – проходя через мембрану в область с более высокой концентрацией растворенного вещества.
Это может привести к изменению общего объема воды на каждой стороне мембраны: на стороне мембраны с большим количеством растворенных веществ может оказаться гораздо больше воды. Это может привести к проблемам для клеток, таким как взрыв (если слишком много воды попадает в клетка ) или становится обезвоженным (если слишком много воды уходит).
Это очень важный фактор в биологии, потому что внутриклеточная среда отличается от внеклеточной среды. Если изменяется внеклеточная среда, это может привести к попаданию воды в наши клетки.
Некоторые организмы, такие как растения, которые используют осмотическое давление для перемещения воды, воспользовались этим принципом. Но это также может угрожать здоровью клеток и организмов, когда во внеклеточной среде слишком много или слишком мало воды по сравнению с внутренней частью клетки.
Уравнение осмотического давления
Осмотическое давление может быть рассчитано с использованием следующего уравнения:
В этом уравнении:
Важно отметить, что π не равно 3.14… в этом уравнении!
Вместо этого здесь «π» – символ, используемый для обозначения осмотического давления. Вы можете думать об этом уравнении как о решении для «π» так же, как о решении для X.
В символе «π» нет ничего особенного, кроме того, что на международном уровне химики согласились обозначать осмотическое давление.
М – молярная концентрация растворенного вещества. Молярная концентрация относится к фактическому количеству атомов, ионов или молекул растворенного вещества.
Это важно, потому что именно количество частиц определяет, как частицы взаимодействуют при осмосе, а не объем или вес.
Сколько моль – единица измерения частиц – весит, или сколько он занимает, будет варьироваться в зависимости от молекулярного веса и плотности растворенного вещества.
R – идеальная газовая постоянная.
Хотя постоянная идеального газа была создана для обозначения газов и их диффузии и поведения, она также применима к жидкостям.
В химии и жидкости, и газы считаются «жидкостями» – частицами, которые могут свободно диффундировать, в отличие от твердых тел, частицы которых удерживаются на месте прочными связями.
Т – температура в градусах Кельвина.
Один градус Кельвина равен одному градусу Цельсия, но между двумя измерительными системами есть важное различие.
Температура является мерой энергии в молекулах. При более высоких температурах молекулы движутся быстрее; при более низких температурах они движутся медленнее. Вот почему температура так важна для этого уравнения: чем быстрее частицы подвергаются случайному молекулярному движению, тем быстрее они будут диффундировать.
В градусах Цельсия «ноль градусов» считается точкой замерзания воды. Это произвольное число, выбранное учеными, потому что замерзание воды является обычным явлением. Температура по Цельсию может быть положительной (выше нуля) или отрицательной (ниже нуля).
Но в Кельвине «ноль градусов» – это температура, при которой не происходит молекулярного движения. На самом деле это абсолютный ноль – невозможно стать холоднее, чем «отсутствие молекулярного движения».
В результате Кельвин используется во многих химических уравнениях, потому что это абсолютная мера тепла. Если вещество находится при 300 градусах Кельвина, вы точно знаете, сколько тепла находится в веществе: всего 300 Кельвинов.
Для ученых это гораздо лучше, чем вычислять, основываясь на градусах Цельсия, и, например, нужно выяснить, сколько тепла в воде при температуре -30 градусов Цельсия.
Забавный факт: абсолютный ноль – ноль Кельвин – это -273,15 градусов по Цельсию. Другой способ сказать, что ноль градусов по Цельсию – точка замерзания воды – происходит в 273,15 Кельвинов.
Примеры осмотического давления
Увядшие растения
Многие растения фактически используют осмотическое давление для поддержания формы своих стеблей и листьев.
Если вы сохранили растения в горшках, вы, вероятно, знаете, что ваши растения могут очень быстро увядать, если их не поливать. Но в течение нескольких минут после полива они могут взбодриться!
Это происходит потому, что стебли и листья многих растений по существу «надуваются» осмотическим давлением – соли в клетках заставляют воду всасываться через осмос, делая клетку упругой и упругой.
Если воды недостаточно, растение будет увядать, потому что его клетки становятся «спущенными». В научном плане они «гипертонический »- что означает« концентрация растворенного вещества слишком высока ».
Растения также могут демонстрировать силу осмотического давления по мере роста.
Возможно, вы видели растения, растущие сквозь асфальт, или корни деревьев, растущие сквозь кирпичи или бетон.
Это также стало возможным благодаря осмотическому давлению: по мере роста растений их клетки поглощают больше воды. Медленное, но неумолимое давление воды, движущейся через растительная клетка Мембраны действительно могут протолкнуть асфальт!
Эффекты обезвоживания – и чрезмерного увлажнения
Мы все знаем об опасности обезвоживания, когда недостаток воды может вызвать опасные последствия для нашего организма. Чего мы не могли бы понять, так это того, что эти эффекты напрямую связаны с осмотическим давлением.
Когда наши тела не имеют достаточного количества воды, вода может фактически выйти из наших клеток в наши кровь, Это может привести к тому, что концентрации солей и других растворенных веществ в наших клетках станут слишком высокими, что повлияет на клеточную функцию.
Когда мы пьем воду, вода попадает в организм через наши кровяные потоки и способна диффундировать обратно в наши клетки через осмос, восстанавливая их правильную функцию.
Возможно и обратное: на самом деле можно умереть, выпив слишком много воды.
Трудно случайно «передозировать» воду, но в экстремальных случаях, таких как соревнования по питью воды, можно выпить столько воды, что слишком много ее диффундирует в ваши клетки. В крайних случаях это может вызвать отек головной мозг.
Быстрая регидратация после тяжелой дегидратации может быть опасной по той же причине. Рекомендуется проводить регидратацию медленно, потому что внезапное заполнение обезвоженных клеток большим количеством воды может привести к их взрыву!
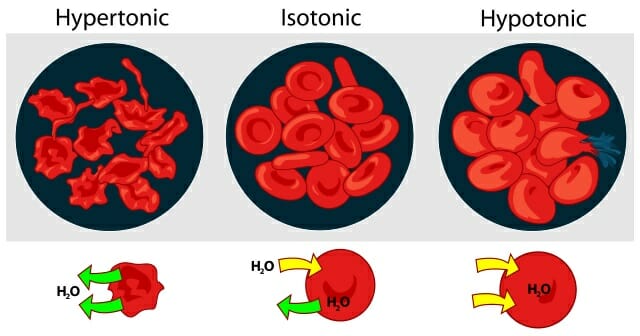
На рисунке ниже показано, как обезвоживание – или чрезмерное увлажнение – может влиять на наши клетки крови, вызывая их усыхание или взрыв:
- диффузия – Процесс, посредством которого жидкости и растворенные вещества равномерно распределяются при случайном молекулярном движении.
- температура – мера средней кинетической энергии частиц в веществе. «У более теплых» веществ больше движения частиц, а у «более холодных» – меньше.
- вода – «универсальный растворитель На которой основана жизнь на Земле. Уникальные свойства воды делают ее идеальным носителем для молекул жизни, таких как сахара, аминокислоты и нуклеиновые кислоты.
викторина
1. Что из следующего НЕ верно для осмоса?A. Это относится конкретно к движению воды через полупроницаемую мембрану.B. Это может произойти только там, где есть мембрана, которая проницаема для воды.C. Это может относиться к любому диффузионному процессу с участием воды.D. Ни один из вышеперечисленных.
Ответ на вопрос № 1
С верно. Осмос относится только к диффузии воды через полупроницаемую мембрану. Другие типы диффузии, такие как диффузия без мембраны, не являются осмосом.
2. Что из следующего НЕ является переменной в уравнении для осмотического давления?A. π – значение 3.14…B. М – молярная концентрация растворенного вещества.C. Р – Закон идеального газа.D. Т – температура раствора в градусах Кельвина.
Ответ на вопрос № 2
верно. Это хитрый! Хотя символ «π» появляется в уравнении для осмотического давления, здесь он НЕ означает значение «3.14…», используемое в геометрии.
Вместо этого он просто используется как символ, представляющий решение вашего уравнения – осмотическое давление вашего решения. Здесь значение «π» является тем, каким оказывается осмотическое давление.
Осмос. Осмотическое давление. Закон Вант-Гоффа. Зависит ли осмотическое давление от природы растворённого вещества?
Осмосом называют преимущественно одностороннее проникновение молекул растворителя(диффузию) через полунепроницаемую мембрану из растворителя в раствор или из раствора с меньшей концентрацией в раствор с большей концентрацией.
Осмотическим давлением называют величину, измеряемую минимальным гидравлическим давлением, которое нужно приложить к раствору, чтобы осмос прекратился.
Осмотическое давление разбавленных растворов неэлектролитов прямо пропорционально молярной концентрации, коэффиценту пропорциональности и абсолютной температуре: π =С(Х)RT,
Где π- осмотич давление,кПа; С(Х)- молярная концентрация, моль/л
С(Х)= n/V, где n-число молей неэлектролита, V- объём раствора; R- универсальная газовая постоянная,равная 8,31кПа*л/(моль*К); T-абсолютная температура, K.
π = n/V * RT или πV= nRT.
Чтобы согласовать количественное описание коллигативных свойств электролитов и законы идеальных растворов, Вант-Гофф ввёл поправочный коэффицент i, называемый изотоническим коэффицентом
Осмотическое давление зависит от концентрации растворенного вещества и температуры. Так, при увеличении концентрации с сахарозы в воде в два раза осмотическое давление возрастает примерно в два раза, при увеличении концентрации c в три раза осмотическое давление возрастает почти во столько же и т. д.
28. Гипо-, гипер- и изотонические растворы. Изотонический коэффицент
Изотонический раствор- жидкость внутренней среды или искусственно приготовленный раствор имеет такое же осмотическое давление, как нормальная плазма крови, подобную жидкую среду или раствор
Гипертонический раствор жидкость с более высоким осмотическим давлением
Гипотонический раствор жидкость с более низким осмотическим давлением
Чтобы согласовать количественное описание коллигативных свойств электролитов и законы идеальных растворов, Вант-Гофф ввёл поправочный коэффицент i, называемый изотоническим коэффицентом
Изотонический коэффициент или коэффициент Вант-Гоффа (i)– это отношение суммы числа ионов и непродиссоциировавших молекул электролита к начальному числу молекул электролита, по его величине вычисляют степень электролитической диссоциации:
Формулы для расчета коллигативных свойств разбавленных растворов электрполитов с учетом изотонического коэффициента имеют вид:
— осмотическое давление Росм = ί См RT;
— 1-й закон Рауля ΔР / Р(z) = ί Сm ;
Нетрудно увидеть, что изотонический коэффициент ί может быть вычислен как отношение ΔР, Δtкp, Δtкип, Росм, найденных экспериментально на опыте, к тем же величинам, вычисленным без учета диссоциации электролита (Δрвыч, Δtкp выч, Δtкип выч; Росм выч):
| 29. Роль осмоса в биологических системах. Плазмолис и лизис. Осмотическое давление обеспечивает переход растворителя через полунепроницаемую мембрану от р-ра менее концентрированного к р-ру более концентрированному, поэтому оно играет важную роль в распределении воды между внутренней средой и клетками организма. Лизис-набухание клеток, разрыв оболочек, вытекание клеточного содержимого, вследствии помещения клеток в гипотонический р-р. Плазмолис-сморщивание клеток, при их помещении в гипертонический р-р. | |
| 30. Что называют буферными растворами? Буферные р-ры-это р-ры рН которых меняется незначительно при разбавлении или при добавлении небольших количеств китслоты или щелочи. | . |
Изотонический раствор- жидкость внутренней среды или искусственно приготовленный раствор имеет такое же осмотическое давление, как нормальная плазма крови, подобную жидкую среду или раствор
Гипертонический раствор жидкость с более высоким осмотическим давлением
Гипотонический раствор жидкость с более низким осмотическим давлением
Чтобы согласовать количественное описание коллигативных свойств электролитов и законы идеальных растворов, Вант-Гофф ввёл поправочный коэффицент i, называемый изотоническим коэффицентом
Изотонический коэффициент или коэффициент Вант-Гоффа (i)– это отношение суммы числа ионов и непродиссоциировавших молекул электролита к начальному числу молекул электролита, по его величине вычисляют степень электролитической диссоциации:
Формулы для расчета коллигативных свойств разбавленных растворов электрполитов с учетом изотонического коэффициента имеют вид:
— осмотическое давление Росм = ί См RT;
— 1-й закон Рауля ΔР / Р(z) = ί Сm ;
Нетрудно увидеть, что изотонический коэффициент ί может быть вычислен как отношение ΔР, Δtкp, Δtкип, Росм, найденных экспериментально на опыте, к тем же величинам, вычисленным без учета диссоциации электролита (Δрвыч, Δtкp выч, Δtкип выч; Росм выч):
36. Объясните, почему большинство буферных систем организма имеет буферную емкость по кислоте больше, чем по основанию.
Потому что в живом организме в результате метаболизма образуются большие количества кислых продуктов. Так, в организме человека за сутки образуется такое количество различных кислот, которое эквивалентно 20-30 л однонормальной сильной кислоты. И для того чтобы поддерживать рH организма, у буферных систем организма буферная емкость по кислоте больше, чем по основанию.
37. Патологические явления: ацидоз и алкалоз
Алкалоз — одна из форм нарушения кислотно- щелочного равновесия организма; характеризуется абсолютным или относительным избытком оснований, т.е. Веществ, присоединяющих ионы водорода(протоны), по отношению к кислотам, отщепляющим их. Алкалоз может быть компенсированным или некомпенсированным в зависимости от значения pH. При компенсированном алкалозе pH крови удерживается в пределах нормальных величин (7,35-7,45), отмечаются лишь сдвиги в буферных системах и физиологических регуляторных механизмах. При некомпенсированном алкалозе pH превышает 7,45, что обычно связано со значительным избытком оснований инедостаточностью физико-химических и физиологических механизмов регуляции кислотно- щелочного равновесия. Ацидоз — сдвиг кислотно-щелочного равновесия в организме в сторону относительного увеличения количества анионов кислот, характеризуется абсолютным или относительным избытком кислот, т.е. веществ, отдающих ионы водорода (протоны), по отношению к основаниям, присоединяющим их. Ацидоз также может быть компенсированным или некомпенсированным в зависимости от значения pH. При компенсированном ацидозе pH крови смещается к нижней границе физиологической нормы (7,35). При более выраженном сдвиге в кислую сторону (pH менее 7,35) ацидоз считается некомпенсированным. Такой сдвиг обусловлен значительным избытком кислот и недостаточностью физико-химических и физиологических механизмов регуляции кислотно- щелочного равновесия.
38. Какое химическое равновесие поддерживают в организме буферные системы?
В организме буферные системы поддерживают кислотно-щелочное равновесие. В организме человека особенно большую роль играют белковый, гидрокарбонатный, гемоглобиновый и фосфатный буферы.
39. Какая буферная система вносит максимальный относительный вклад в поддержание протолитического гомеостаза во внутренней среде эритроцитов? Максимальный относительный вклад в поддержание протолитического гомеостаза во внутренней среде эритроцитов вносит гемоглобиновая буферная система.
40.Какие соединения называются координационными? Приведите примеры.
Комплексные соединения или координационные соединения — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Примеры: [Cu(NH3)4] SO4 — сульфат тетраамминмеди (II) K4[Fe(CN)6] — Гексацианоферра́т(II) ка́лия [Pt(NH3)2Cl2] — транс-Дихлородиамминплатина(II)
41. Классификация координационных соединений
Координационные соединения классифицируют: Катионные комплексы образованы вñ1)По заряду комплекса: результате координации вокруг положительного иона нейтральных молекул (H2O, NH3и др.). [Zn(NH3)4]Cl2 — хлорид тетраамминцинка(II) [Co(NH3)6]Cl2 — хлорид гексаамминкобальта(II) Анионные комплексы: в ролиñ комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются простые или сложные анионы. K2[BeF4] — тетрафторобериллат(II) калия Li[AlH4] — тетрагидридоалюминат(III) лития K3[Fe(CN)6] — гексацианоферрат (III) калия Нейтральные комплексы образуются приñ координации молекул вокруг нейтрального атома, а также при одновременной координации вокруг положительного иона — комплексообразователя отрицательных ионов и молекул. [Ni(CO)4] — тетракарбонилникель [Pt(NH3)2Cl2] — дихлородиамминплатина(II) 2) По числу мест, занимаемых лигандами в координационной сфере Монодентатные лиганды.ñ Полидентатные лиганды.ñБидентатные лиганды.ñ
42. Природа химической связи в комплексных соединениях
Во внутренней сфере комплексного соединения связь между комплексообразователем и лигандами ковалентная, образованная по донорно-акцепторному механизму. Ион или атом- комплексообразователь является акцептором, а лиганды являются донорами электронных пар.
№43) Как расчитывается общая и стуаенчатая константа нестойкости(устойчивости).
Ступенчатые константы нестойкости этих комплексов равняются соответственно &. Высокие значения & Г1 и k2 — l свидетельствуют о том, что при образовании комплексов с медью ( II) этилендиамин выступает как полидентатный лиганд. Произведение ступенчатых констант нестойкости равно общей константе нестойкости, индекс которой показывает, из каких множителей она образовалась.Зная величины ступенчатых констант нестойкости ( в частности константы, отвечающей отщеплению первой молекулы аммиака или амина от комплексного иона), концентрацию комплекса, константу RH как основания и константу Me. Зная функцию закомплексованности, ступенчатые константы нестойкости вычисляются методом Ледена. Так, при рассмотрении ступенчатых констант нестойкости комплексных аммиакатов Ni ( II), Cu ( II) пли Со ( П) видно, что для этих солей сольватацпонное равновесие с отщеплением свободного основания будет выражено гораздо сильнее, чем усиление степени кислотной диссоциации аммиака пли аминов в поле двухвалентных ионов. Так, при рассмотрении ступенчатых констант нестойкости комплексных аммиакатов Ni ( II) Cu ( II) или Со ( П) видно, что для этих солей сольватационное равновесие с отщеплением свободного основания будет выражено гораздо сильнее, чем усиление степени кислотной диссоциации аммиака или аминов в поле двухвалентных ионов.]
Эл 1, Рп-называют ступенчатыми константами нестойкости.
Рп ] ( Рп называют ступенчатыми константами нестойкости.
Значение общей константы нестойкости равно произведению значений всех ступенчатых констант нестойкости. [9]
Последние применительно к диссоциации комплексных ионов называются их ступенчатыми константами нестойкости
А — ион водорода или адденд, Ki — кажущаяся ступенчатая константа нестойкости комплексного соединения МА, которая может считаться в первом приближении величиной постоянной только при постоянной ионной силе раствора. Термодинамические уравнения, описывающие соответствующие процессы, идентичны для обоих процессов. [11По кривой комплексообразования, как было показано Бьеррумом, можно определить ступенчатые константы нестойкости аммиакатов меди с различным числом молекул МНз в координационной сфере и, зная их, рассчитать концентрации комплексов различного состава при любых концентрациях свободного аммиака в растворе. [12]Каждой стадии диссоциации комплекса соответствует ступенчатая константа диссоциации, которую называют ступенчатой константой нестойкости и обозначают йнест. Чем сильнее диссоциирует комплекс, тем большее значение имеет / г ест — Константы нестойкости используют для характеристики устойчивости любой комплексной частицы в растворе независимо от того, какие лиганды она отщепляет. [13]Каждой стадии диссоциации комплекса соответствует ступенчатая константа диссоциации, которую называют ступенчатой константой нестойкости и обозначают йвест. Чем сильнее диссоциирует комплекс, тем большее значение имеет Анест. Константы нестойкости используют для характеристики устойчивости любой комплексной частицы в растворе независимо от того, какие лиганды она отщепляет. [14]
Дата добавления: 2015-12-26 ; просмотров: 4539 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://fissi.ru/osmotic-pressure/
http://helpiks.org/6-29076.html