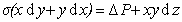Давление Лапласа
Форма поверхности жидкости, налитой в сосуд, определяется тремя факторами: силами взаимодействия между молекулами жидкости, силами взаимодействия между молекулами жидкости и молекулами, входящими в состав стенок сосуда, и действием силы тяжести.
Если достаточно большое количество жидкости налито в широкий сосуд, то жидкость вследствие преобладающего действия силы тяжести в этом случае имеет плоскую горизонтальную поверхность. Однако непосредственно у стенок сосуда поверхность жидкости несколько искривлена. Если молекулы жидкости, соприкасающиеся со стенкой сосуда, взаимодействуют с молекулами твердого тела сильнее, чем между собой, в этом случае жидкость стремится увеличить площадь соприкосновения с твердым телом. При этом поверхность жидкости изгибается вниз и говорят, что она смачивает стенки сосуда, в котором находится.
Если же молекулы жидкости взаимодействуют между собой сильнее, чем с молекулами стенок сосуда, то жидкость стремится сократить площадь соприкосновения с твердым телом, ее поверхность искривляется вверх, имеет место несмачивание жидкостью стенок сосуда.
В узких трубочках, диаметр которых составляет доли миллиметра, искривленные края жидкости охватывают весь поверхностный слой, и вся поверхность жидкости в таких трубочках имеет вид, напоминающий полусферу. Это так называемый мениск.
Это так называемый мениск. Он может быть вогнутым, как на рис. 1а, в случае смачивания, и выпуклым, как на рис. 1б, при несмачивании. Радиус кривизны поверхности жидкости при этом того же порядка, что и радиус трубки. Явления смачивания и несмачивания характеризуются краевым углом θ между смоченной поверхностью твердого тела и мениском в точках их соприкосновения (рис.1а, б).
Наличие сил поверхностного натяжения и кривизны поверхности жидкости в капиллярной трубочке ответственно за дополнительное давление под искривленной поверхностью, называемое давлением Лапласа.
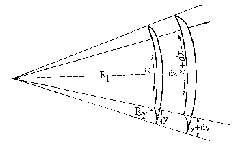
Для вывода формулы, определяющей величину давления Лапласа, рассмотрим случай, когда поверхность жидкости в сосуде принимает форму выпуклого мениска (рис. 2).Пусть F– сила поверхностного натяжения, действующая по касательной к поверхности жидкости, R – радиус кривизны поверхности мениска, r – радиус кривизны сечения мениска горизонтальной плоскостью.
Силу F можно разложить на две составляющие F1 и F2. Очевидно, что при суммировании по периметру мениска все составляющие F1 дадут ноль, и давление Лапласа будет обусловлено суммарным действием составляющих F2. Найдем составляющую F2 и проведем суммирование по контуру, ограничивающему мениск в горизонтальном сечении, имея в виду, что сила поверхностного натяжения F=σΔl , где Δl – элемент длины контура.
1.3.1. Уравнение Лапласа
Рассмотрим сферический пузырек воздуха радиуса r в среде жидкости. Если увеличить размер пузырька, например при введении некоторого количества газа, как это показано на рис. 1.4, то увеличится поверхность пузырька, а затраченная на это увеличение работа может быть выражена как работа на преодоление сил поверхностного натяжения или как работа увеличения объема пузырька на преодоление внутреннего давления в жидкости Pk. Учитывая, что давление в пузырьке должно быть больше давления в жидкости, можем записать
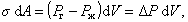
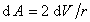
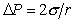
т.е. разность давлений в соседних фазах, разделенных искривленной поверхностью, определяется радиусом кривизны поверхности.
Рис. 1.5. Схема изменения мениска произвольной формы
Рассмотрим расширение некоторой фигуры произвольной кривизны, схема небольшого участка поверхности (мениска) которой приведена на рис. 1.5. Кривизна этой поверхности выражается двумя радиусами R1 и R2. Один из этих радиусов (R1) лежит в плоскости рисунка, а другой (R2)– в перпендикулярной плоскости. Если выбранный участок поверхности достаточно мал, то R1 и R2 можно считать постоянными. Если поверхность сместить на некоторую бесконечно малую величину dz, то площадь изменится на величину
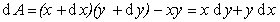
а объем на величину
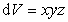
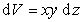
Из подобия треугольников, приведенных на рис. 1.5., следует, что
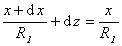
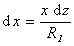
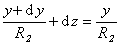
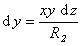
Так как при равновесии системы работа увеличения поверхности будет равна работе увеличения объема, то
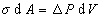
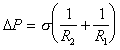
Уравнение (1.1.37) представляет собой основное уравнение теории капиллярных явлений и также как уравнение (1.1.30) носит название «уравнение Лапласа».
Коллоидная химия. Шпаргалка
Данное издание создано в помощь студентам вузов, которые хотят быстро подготовиться к экзаменам и сдать сессию без проблем. Пособие составлено с учетом Государственного образовательного стандарта.
Оглавление
- 1. Возникновение и основные этапы развития коллоидной химии. Предмет и объекты исследований коллоидной химии
- 2. Основные особенности дисперсных систем. Особенности ультрамикрогетерогенного состояния (наносостояния)
- 3. Различные типы классификации дисперсных систем. Лиофильные и лиофобные дисперсные системы
- 4. Дисперсность. Удельная поверхность дисперсных систем, методы ее измерения
- 5. Коллоиды. Примеры коллоидных систем, их распространенность в природе и значение для современной технологии
- 6. Оптические методы исследования дисперсных систем (нефелометрия, турбидиметрия)
- 7. Оптические свойства коллоидов. Статическое рассеяние света. Оптическая анизотропия
- 8. Поглощение света дисперсными системами, уравнение Бугера-Ламберта-Бера. Определение размеров коллоидных частиц
- 9. Поверхностные явления. Роль поверхностных явлений в процессах, протекающих в дисперсных системах
- 10. Поверхность раздела фаз. Свободная поверхностная энергия. Поверхностное натяжение. Адсорбция
- 11. Термодинамическое описание разделяющей поверхности
- 12. Адсорбция. Площадь, приходящаяся на одну молекулу в адсорбционном слое
- 13. Хроматографический адсорбционный анализ
Приведённый ознакомительный фрагмент книги Коллоидная химия. Шпаргалка предоставлен нашим книжным партнёром — компанией ЛитРес.
1. Возникновение и основные этапы развития коллоидной химии. Предмет и объекты исследований коллоидной химии
Возникновение науки коллоидной химии связано с исследованиями английского химика Т. Грэма. После пионерских исследований М. Фарадея (1857 г.), когда впервые были получены устойчивые коллоидные растворы высокодисперсного золота, в 1861 г. Грэм изучал диффузию разных веществ в водных растворах и обнаружил, что некоторые из них (желатин, агар-агар и т. п.) диффундируют в воде намного медленнее, чем, например, соли и кислоты. Также эти вещества при пересыщении растворов не кристаллизовались, а формировали студнеобразную, клейкую массу. Эти вещества Т. Грэм назвал коллоидами (от греч. kolla — «клей», eidos — «вид»). Так появилось название науки — «коллоидная химия». Т. Грэм выдвинул гипотезу о существовании в природе двух противоположных классов химических веществ — кристаллоидов и коллоидов. Эта идея заинтересовала многих ученых, и во второй половине XIX в. началось бурное развитие коллоидной химии. В России в это время коллоидной химии также уделялось большое внимание, во многом под влиянием Д. И. Менделеева. Исследования температурной зависимости поверхностного натяжения органических жидкостей (1861 г.) привели Менделеева к открытию понятия критической температуры веществ. Менделеев высказал также идею о связи между поверхностным натяжением и другими свойствами вещества. В эти годы были открыты многие вещества с коллоидными свойствами, разработаны различные методы очистки и стабилизации коллоидов, созданы методы их исследования. По мере открытия новых коллоидов на смену гипотезе Т. Грэма в первой половине XX в. пришла концепция универсальности коллоидного (дисперсного) состояния вещества: «Коллоидное состояние не является обусловленным особенностями состава вещества. При определенных условиях каждое вещество может находиться в коллоидном состоянии». Эту концепцию сформулировал профессор Санкт-Петербургского горного института П. П. Веймарн в 1906–1910 гг. Он показал, что типичные коллоиды (например, желатин) можно выделить в кристаллическом виде и, напротив, из кристаллоидных веществ можно приготовить коллоидный раствор (например, поваренной соли в бензоле). Произошло смещение приоритетов коллоидной химии. Главным направлением стало изучение дисперсного (коллоидного) состояния веществ. Примерно к 1920-м гг. фундаментальные проблемы коллоидной химии условно разделили на три группы: состав, строение и свойства коллоидных частиц; взаимодействие частиц с дисперсной средой; контактные взаимодействия частиц друг с другом, приводящие к образованию коллоидных структур. В этот период были открыты основные законы коллоидной химии — закон броуновского движения и диффузии коллоидных частиц (А. Эйнштейн), гетерогенной природы коллоидных растворов (Р. Зигмонди), седиментационно-диффузионного равновесия дисперсий в поле силы тяжести (Ж. Перрен) и в центрифуге (Т. Сведберг), светорассеяния (Дж. Рэлей), коагуляции золей электролитами (Г. Шульце и В. Гарди). Появление во второй половине XX в. высокоразрешающих методов изучения строения веществ (ЯМР, электронной и атомно силовой микроскопии, компьютерного моделирования, фотон-корреляционной спектроскопии и др.) позволило перейти к систематическому исследованию строения и свойств коллоидных систем. Современное определение данной науки гласит: коллоидная химия — это учение о свойствах и превращениях веществ в дисперсном и ультрадисперсном состояниях и поверхностных явлениях в дисперсных системах. Объекты исследования коллоидной химии имеют высокоразвитую поверхность и представляют собой различные золи, суспензии, эмульсии, пены, поверхностные пленки, мембраны и пористые тела, наноструктурированные системы (нанотрубки, пленки Ленгмюра-Блоджетт, гибридные органо-неорганические композиционные материалы, нанокомпозиты).
Оглавление
- 1. Возникновение и основные этапы развития коллоидной химии. Предмет и объекты исследований коллоидной химии
- 2. Основные особенности дисперсных систем. Особенности ультрамикрогетерогенного состояния (наносостояния)
- 3. Различные типы классификации дисперсных систем. Лиофильные и лиофобные дисперсные системы
- 4. Дисперсность. Удельная поверхность дисперсных систем, методы ее измерения
- 5. Коллоиды. Примеры коллоидных систем, их распространенность в природе и значение для современной технологии
- 6. Оптические методы исследования дисперсных систем (нефелометрия, турбидиметрия)
- 7. Оптические свойства коллоидов. Статическое рассеяние света. Оптическая анизотропия
- 8. Поглощение света дисперсными системами, уравнение Бугера-Ламберта-Бера. Определение размеров коллоидных частиц
- 9. Поверхностные явления. Роль поверхностных явлений в процессах, протекающих в дисперсных системах
- 10. Поверхность раздела фаз. Свободная поверхностная энергия. Поверхностное натяжение. Адсорбция
- 11. Термодинамическое описание разделяющей поверхности
- 12. Адсорбция. Площадь, приходящаяся на одну молекулу в адсорбционном слое
- 13. Хроматографический адсорбционный анализ
Приведённый ознакомительный фрагмент книги Коллоидная химия. Шпаргалка предоставлен нашим книжным партнёром — компанией ЛитРес.
Смотрите также
Философия. Конспекты + Шпаргалки. Две книги в одной!
Группа авторов, 2012
Гражданское право. Часть первая. Краткий курс
Коллектив авторов, 2016
Психология. Полный курс
Татьяна Петровна Ритерман, 2010
Статистика. Ответы на экзаменационные билеты
Ангелина Витальевна Яковлева, 2009
Бухгалтерское дело. Ответы на экзаменационные вопросы
О. В. Епифанов, 2009
Ценные бумаги. Ответы на экзаменационные билеты
Надежда Новикова, 2009
Уголовный процесс. Шпаргалка
Михаил Белоусов, 2009
Учебное пособие по органической химии. Часть 1. Алифатические соединения
Политология. Вопросы и ответы
А. А. Акмалова, 2008
Теория организации. Ответы на экзаменационные билеты
Сергей Викторович Загородников, 2009
Патентование изобретений в области высоких и нанотехнологий
Экономический анализ деятельности предприятия. Ответы на экзаменационные вопросы
С. С. Степанова, 2009
Ответы на экзаменационные вопросы по арбитражному процессуальному праву
http://xumuk.ru/colloidchem/15.html
http://kartaslov.ru/%D0%BA%D0%BD%D0%B8%D0%B3%D0%B8/%D0%95_%D0%A1_%D0%9C%D1%83%D1%85%D0%B0%D1%87%D0%B5%D0%B2%D0%B0_%D0%9A%D0%BE%D0%BB%D0%BB%D0%BE%D0%B8%D0%B4%D0%BD%D0%B0%D1%8F_%D1%85%D0%B8%D0%BC%D0%B8%D1%8F_%D0%A8%D0%BF%D0%B0%D1%80%D0%B3%D0%B0%D0%BB%D0%BA%D0%B0/1