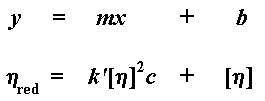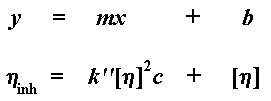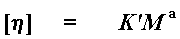Определение молекулярной массы полимера по характеристической вязкости. Уравнение Марка-Куна-Хаувинка.
Ограниченное, неограниченное набухание ВМС (полимеров)
Растворению предшествует набухание ВМС – еще одно уникальное свойство, присущее только им. При контакте ВМС и
растворителя начинается абсорбция. Молекулы растворителя диффундируют внутрь полимера, поглощаются его объемом. Они располагаются между макромолекулами, раздвигают их, что увеличивает подвижность цепей. Усиливается мелкомасштабное движение. Набухание будет продолжаться до тех пор, пока макромолекулы не получат возможность для крупномасштабного движения и тогда произойдет растворение.
При набухании ВМС увеличивается объем и масса образца.
Количественной мерой набухания служит степень набухания a
где m и m 0 – массы набухшего и исходного образца ВМС.
В зависимости от структуры ВМС, свойств растворителя и температуры набухание может быть ограниченным или неограниченным. При ограниченном набухании величина a сначала растет во времени, затем достигает предельного значения и дальше от времени не зависит. Так набухает желатин в холодной воде или резина в бензине.
Неограниченное набухание — это набухание, заканчивающееся растворением: полимер сначала поглощает жидкость, а затем при той же температуре переходит в раствор, образуя однофазную гомогенную систему. Так набухают натуральный и синтетический каучук в углеводородах, нитроцеллюлоза – в ацетоне.
6. По характеру вязкого течения жидкостные дисперсные системы делятся на две группы:
1) бесструктурные системы, частицы которых более или менее свободны и почти не взаимодействуют друг с другом (растворы низкомолекулярных веществ, разбавленные эмульсии, суспензии и золи);
2) структурированные системы — содержат частицы, взаимодействующие друг с другом и с дисперсионной средой (растворы ВМС, концентрированные эмульсии и суспензии). Системы первой группы подчиняются законам Пуазейля и Ньютона: количество жидкости, протекающей через капилляр в единицу времени, изменяется прямо пропорционально давлению, а коэффициент вязкости является величиной постоянной и не зависит от градиента скорости или давления, приложенного к капиллярному вискозиметру.
Вязкость– это внутреннее трение между слоями жидкости или газа, которое возникает когда слои движутся с разными скоростями. Вязкость (η) является результатом межмолекулярного взаимодействия, и она тем выше, чем больше силы молекулярного притяжения. Поэтому вязкость полярных веществ всегда больше, чем неполярных.
Вязкость (η) является результатом межмолекулярного взаимодействия, и она тем выше, чем больше силы молекулярного притяжения. Поэтому вязкость полярных веществ всегда больше, чем неполярных. Зависимость реологических свойств от различных факторов выражают графически в виде реологических кривых (кривых течения): η = f (P) или v = f(P), где v – скорость сдвигового течения жидкости; P — напряжение сдвига (аналог – давление).Для жидкостей характерны два основных типа течения: ламинарное и турбулентное. Ламинарным называют течение жидкости в виде параллельных слоев, не перемешивающихся между собой. Примером ламинарно текущей жидкости может служить спокойная равнинная река. Турбулентное течение – это бурное течение, сопровождающееся образованием завихрений, воронок и взаимным перемешиванием слоев жидкости.
Уравнение Пуазейля и его применение для каппилярной вискозиметрии.
Закон Пуазейля связывает объем протекающей через капилляр жидкости V за время t с вязкостью
где К – константа, зависящая от геометрии капилляра, а Р здесь –давление на конце капилляра. Закон Пуазейля позволяет характеризовать вязкость по времени истечения определенного объема жидкости через капилляр. Это – принцип действия капиллярных вискозиметров.
Определение молекулярной массы полимера по характеристической вязкости. Уравнение Марка-Куна-Хаувинка.
Характерной особенностью растворов полимеров является их высокая вязкость даже при очень больших разбавлениях.
Для вычисления молекулярной массы используют более точное уравнение Марка–Куна–Хаувинка которое учитывает изменение гибкости макромолекул с изменением молекулярной массы. Величина a характеризует форму молекулы полимера в растворе, которая связана с гибкостью цепей, а константа К, как и ранее, постоянна для данного
гомологического ряда. Таким образом, для каждой пары полимер – растворитель характерны свои значения К и a. При увеличении жесткости макромолекул величина a приближается к единице и уравнение Марка–Куна–Хаувинка переходит в уравнение Штаудингера и дальше – в уравнение Эйнштейна.
Лекция №15.
План лекции:
Строение макромолекул
Основным признаком соединений является их высокая молекулярная масса, а, следовательно, и их большой размер молекул.
Свойства таких соединений зависят не только от химического состава, но также от размеров и формы больших молекул, называемых обычно макромолекулами.
Три основных типа молекул ВМС : линейная, плоская (двухмерная) и пространственная (трехмерная).
Свойства линейных макромолекул
К этому типу относится подавляющее большинство природных и искусственно получаемых ВМС. Такая форма отвечает наименьшей потенциальной энергии молекул.
Часто цепи дают ответвления и тогда они называются разветвленными цепями (б). В этом случае макромолекулу геометрически можно отнести к типу двухмерных молекул.
В более редких случаях однородные линейные макромолекулы под влиянием изменения внешних условий (например, температуры и давления) или добавок посторонних веществ могут вступать друг с другом в химическую (валентную) связь, устанавливающуюся в отдельных участках цепи на ее длине в виде “мостов” или “перемычек” (в). Такие молекулы получили название “сшитых” молекул (“сшитых” структур). Так как такое “сшивание” происходит в пространстве, то макромолекулы становятся трехмерными образованиями и превращаются в жесткие системы с характерными для них свойствами (нерастворимостью, отсутствием плавкости, эластичности, пластичности и пр.) Типичными ВМС с трехмерными молекулами являются фенолформальдегидные смолы.
Длина цепочного типа макромолекул при наличии в них десятков тысяч атомов может достигать нескольких тысяч ангстрем.
От формы и строения макромолекул зависят и другие свойства ВМС — осмотическое давление, способность к набуханию, вязкость.
Все молекулярные вещества, вследствие их большого молекулярного веса, нелетучи и не способны перегоняться.
Влияние температуры на структуру ВМС
Межмолекулярные силы, действующие между отдельными атомами и их группами, препятствуют изменению формы макромолекул. Чтобы изменить форму макромолекул, надо преодолеть действие межмолекулярных сил, что сопряжено с затратой определенного количества энергии. С повышением температуры растет энергия макромолекул, причем энергия теплового движения может оказаться больше энергии взаимодействия молекул друг с другом, в результате чего вероятность изменения конфигурации и взаимного расположения молекул увеличивается. Наоборот, при охлаждении полимера перегруппировка макромолекул практически прекращается: в результате, полимер остается по своей неупорядоченной структуре в аморфно- жидком состоянии и при температурах значительно ниже температуры кристаллизации. Таким образом, даже при сильном охлаждении высокополимеры не переходят в упорядоченное (кристаллическое) состояние. В этом ВМС сходны со стеклами и такое состояние высокополимера называется стеклообразным. Процесс застекловывания идет часто в довольно значительном температурном интервале. Та температурная область, в которой происходит такой переход, называется температурой перехода, в частности для явления застекловывания она называется температурой застекловывания.
Выше температуры застекловывания полимер начинает переходить из стеклообразного состояния в высокоэластичное и сохраняет его при дальнейшем нагревании до некоторой температуры, называемой температурой текучести. Выше этой температуры у полимера появляется необратимое и самопроизвольное перемещение макромолекул относительно друг друга (текучесть).
Способность к течению высокомолекулярных веществ при повышении температуры используется в технике для смешения каучуков и пластиков с инградиентами и для формирования изделий из пластмасс прессованием.
Не все аморфные ВМС могут находиться во всех трех указанных состояниях.
Общая характеристика растворов высокомолекулярных соединений
Растворы ВМС термодинамически устойчивы и при соответствующих предосторожностях могут существовать сколько угодно долго. При растворении ВМС всегда образуется гомогенная система, причем, растворение сопровождается уменьшением термодинамического потенциала. Коллоидные растворы, наоборот термодинамически неустойчивы и способны стареть.
Растворение ВМС не требует присутствия в системе стабилизатора. Наконец, растворы ВМС находятся в термодинамическом равновесии и являются обратимыми системами. К таким системам применимо правило фаз Гиббса (в отличие от коллоидных систем).
Следует также учитывать, что равновесное состояние в растворах высокомолекулярных веществ устанавливается медленно.
Для растворов ВМС характерны три группы свойств. Первые две присущи истинным и коллоидным растворам, а третья группа характерна только для растворов ВМС: набухание и студнеобразование.
Характеристика первой и второй группы свойств
Растворам ВМС присуще осмотическое давление, которое вычисляется по формуле:
p = (с/М) R Т + b с 2 (15.1)
с, М — концентрация и молекулярная масса ВМС, b — второй вириальный коэффициент (отражает флуктуацию конформационных линейных структур макромолекул)
Разделим левую и правую части уравнения на концентрацию:
p /с = R Т/М + b с (15.2)
Величина p /с — приведенное осмотическое давление. Для идеальных растворов и большинства коллоидных растворов величина приведенного осмотического давления постоянна и не зависит от концентрации. Для растворов ВМС эта величина зависит от концентрации ВМС (что и отражено в уравнении 15.2).
В координатах “ p /с — с” уравнение 15.2 является уравнением прямой, тангенс угла наклона которой равен коэффициенту b , а отрезок, отсекаемый этой прямой на оси ординат соответствует величине R Т/М.
Таким образом, по значению осмотического давления можно определить молекулярную массу макромолекулы растворенного ВМС.
Вязкость растворов ВМС зависит от концентрации вещества в растворе. В отличие от других растворов незначительная концентрация ВМС порой приводит к значительному увеличению вязкости раствора.
Вязкость растворов ВМС зависит от условий определения, в частности, от давления. Это объясняется тем, что одни и те же макромолекулы могут находиться в различных конформационных состояниях: от линейных до глобул, поэтому вязкость растворов ВМС может быть неодинакова в различных направлениях. Вязкость макромолекул с выпрямленными хаотично расположенными звеньями выше, чем вязкость макромолекул, которые имеют форму клубка.
Если вязкий полимер или его раствор продавить через капилляр, то молекулы будет выпрямляться и располагаться ориентированно, а вязкость будет снижаться.
Вязкость растворов ВМС зависит также от свойств и температуры растворителя.
Для растворов ВМС различают относительную, удельную, приведенную и характеристическую вязкости.
Относительная вязкость — отношение вязкости раствора h р к вязкости растворителя h 0 :
t р время истечения раствора ВМС, t 0 — время истечения растворителя(эти величины определяются с помощью вискозиметра).
Удельная вязкость — показывает, насколько увеличилась вязкость раствора ВМС по сравнению с вязкостью растворителя:
Приведенная вязкость — отношение удельной вязкости к концентрации:
Обычно приведенная вязкость линейно зависит от концентрации (рис.15.2).При экстраполяции прямой до пересечения с осью ординат получают величину / h /, которую называют характеристической вязкостью:
/ h / = l i m h уд /с (15.6)
SHAPE \* MERGEFORMAT
Рис.15.2.Изменение приведенной вязкости в зависимости от концентрации ВМС.
Характеристическую вязкость определяют на основании вискозиметрических измерений, используя значение относительной, удельной и приведенной вязкостей.
Характеристическая вязкость для данной пары веществ является величиной условной, но постоянной, она не зависит от концентрации растворителя и состояния макромолекул, кроме того, она связана с молекулярной массой макромолекул.
/ h / = k М а , l g / h / = l g k + а l g М (15.7)
М — средняя молекулярная масса ВМС, а, k — коэффициенты.
Уравнение 15.7 — уравнение Марка-Куна-Хаувинка.
Для растворов полимеров с короткими и жесткими цепями а = 1 и уравнение 15.7 упрощается:
/ h / = k М, l g / h / = l g k + l g М (15.8)
Коэффициент a зависит от формы молекул. Значение коэффициентов определяют экспериментально, это позволяет по значению характеристической вязкости рассчитать молекулярную массу макромолекул. Зная массу, можно определить средний размер r макромолекул:
Уравнение марка куна в логарифмическом виде
Полимеры, когда вы растворяете их в растворителе, делают нечто, а именно, значительно увеличивают вязкость раствора. Полимеры используются в качестве сгустителей в таких продуктах, как шампуни и даже мороженое. Этот эффект увеличения вязкости раствора может быть использован для оценки молекулярной массы полимеров. Сейчас самое время вам прочитать страницу молекулярная масса полимеров, если вы этого еще не сделали.
Но прежде чем мы перейдем к более подробному обсуждению вопроса о молекулярной массе, давайте сначала зададим себе такой вопрос:
Почему полимеры увеличивают вязкость растворов?
Во-первых, полимеры движутся очень медленно, или по крайней мере, гораздо медленнее, чем маленькие молекулы. Это логично, что чем быстрее будут двигаться молекулы в жидкости, легче будет течь сама жидкость. Поэтому, когда мы растворяем полимер в растворителе, то их медленное движение делает весь раствор в целом более вязким.
Ну ладно, макромолекулы двигаются медленно. Но почему весь раствор становится более вязким? Неужели молекулы полимера заставляют и молекулы растворителя тоже двигаться медленнее? Но как?
Чтобы понять это, стоит подумать о волшебных трехдневных выходных или праздниках. Вы уезжаете на праздники из города или собираетесь отправиться в путешествие на автомобиле с несколькими вашими самыми близкими друзьями — заговорщиками. Вы грузитесь в ваш блестящий скоростной автомобиль с открытым верхом и вырываетесь на шоссе в поисках приключений. Но вскоре после того, как вы вливаетесь в левый самый скоростной ряд вы замечаете, что ваш пульс заметно замедляется. Ветер, который столь бешено трепал вашу непокорную молодую шевелюру стихает до уровня легкого дыхания летнего ветерка по мере того, как падает ваша скорость. Ваш двигатель урчит на низких оборотах, и вам приходится переключаться сначала на четвертую передачу, потом на третью, чтобы не дать двигателю совсем заглохнуть на этой неправдоподобно низкой скорости. «Как же медленно!?» — думаете вы раздраженно, бросая взгляд на ваш спидометр, который теперь показывает жалкие сорок пять миль в час! (примерно семьдесят километров в час — прим. пер.)
И далеко впереди перед длинной цепочкой столь же медленно двигающихся скоростных машин с откидным верхом, все из которых тащатся на третьей скорости, вы замечаете запасное колесо в большом чехле, на котором написано: «Счастливая семья Хэтсонов (Hattsons) из Форестдейла, штат Висконсин (Forestdale, Wisconsin)». К этому чехлу для запасного колеса, оказывается, прикреплен громадный и угрожающий дом на колесах, весь бампер которого заклеен этикетками, отражающими богатую историю его путешествий в райские местечки для отпуска, такие как Гатлинбург, штат Теннесси (Gatlinburg, Tennessee) и Брэнсон, штат Миссури (Branson, Missouri). Этот дом на колесах, набитый счастливыми Хэтсонами, ползет себе потихоньку со скоростью, которая даже улитку заставит покраснеть от стыда. И вам приходится смириться с горьким разочарованием, и вы понимаете, что вы, по всей видимости, малость опоздаете в место своего назначения.
Точно так же происходит и в случае с молекулами полимеров и маленькими молекулами. Этот огромный и страшный дом на колесах, двигаясь медленно в левом скоростном ряду замедляет ВЕСЬ транспорт на шоссе. Точно так же медленно двигающиеся молекулы полимеров мешаются под ногами быстро двигающихся маленьких молекул, когда те пытаются течь. Поэтому и весь раствор начинает двигаться медленнее и становится более вязким.
И что еще хуже, молекулы полимеров не просто перегораживают линию движения маленьких молекул. Они также и замедляют их посредством межмолекулярных сил. Если существует какое-нибудь притягивающее вторичное взаимодействие между молекулами полимера и растворителя, то маленькие молекулы растворителя могут оказаться привязанными к молекулам полимера. Когда это случается, они начинают двигаться более или менее вместе с полимером, и конечно же, им приходится двигаться со свойственными полимеру маленькими скоростями. Чтобы лучше себе представить эту картину, можно подумать о маленьком астероиде, который летел на огромной скорости по космическому пространству, пока не был захвачен гравитационным полем большой планеты и не стал ее спутником. Точно таким же образом маленькая молекула растворителя, подойдя слишком близко к молекуле полимера будет захвачена и станет «спутником» молекулы полимера.
Ну ладно, полимеры делают растворы более вязкими. Ура. Но какое все это имеет отношение к вопросу об измерении молекулярной массы?
Для большинства полимеров существует вполне определенное соотношение между молекулярной массой и вязкостью. Поэтому, стоит измерить вязкость, и мы сможем получить молекулярную массу. И это как раз то, о чем пойдет речь в следующем разделе, об измерении вязкости раствора полимера.
Наконец.
Мы измеряем вязкость раствора полимера
Итак, теперь мы знаем, как измерять время, которое требуется для того, чтобы уровень жидкости упал на заданное расстояние. Это время называется временем истечения. Сейчас я вам расскажу еще о некоторых подробностях. Мы не ограничиваемся одним измерением. Мы измеряем времена истечения для различных концентраций растворов нашего полимера. Мы также измеряем для сравнения время истечения чистого растворителя, в котором полностью отсутствует растворенный полимер.
Итак, что же мы теперь делаем с этими числами? Первое, что мы сделаем, — это дадим каждому из них свое название. Сначала мы назовем время истечения для чистого растворителя t0. А затем мы приступим к некоторой возне с числами. Первое, что мы вычислим — это отношение вязкости растворов полимеров к вязкости чистого растворителя. Мы получим его, поделив время истечения раствора полимера при данной концентрации (которое мы называем t) на t0, время истечения для чистого растворителя. Это даст нам то, что мы называем относительной вязкостью. Для обозначения этой величины мы используем греческую букву h .
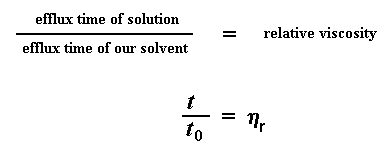
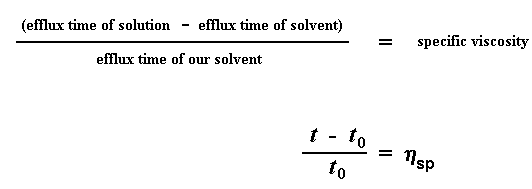
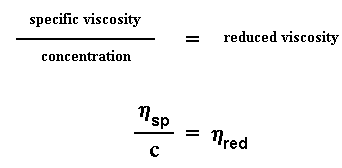
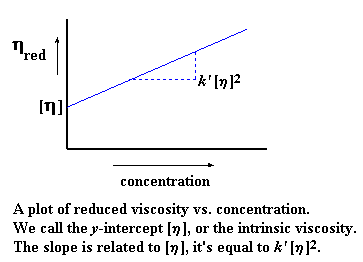
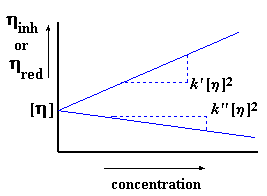
Когда мы строим этот график, то мы обозначаем тангенс угла наклона k’. Мы также экстраполируем этот график до нулевых значений концентрации и называем точку его пересечения с осью y характеристической вязкостью. (Характеристическая вязкость — это воображаемая величина. Поскольку вязкость меняется с концентрацией, то характеристическая вязкость определяется как гипотетическая вязкость при гипотетической «нулевой концентрации».) Подумайте об этом. Если вы еще не забыли основы алгебры из старших классов школы, то вы могли заметить, что таким образом мы получаем уравнение прямой в форме «тангенс угла наклона и смещение». Ну, вы помните, старые добрые y = mx + b, где m — это тангенс угла наклона, а b — это точка пересечения прямой с осью y:
Конечно же, k’ [ h ] 2 — это и есть наше m, характеризующее наклон прямой. А [ h ] — это и есть b, точка пересечения с осью y. Характеристическая вязкость — это очень важная величина, поскольку именно она моментально даст нам значение молекулярной массы.
Но сначала, возможно, вам захочется сходить на перерыв, сделать легкий перекус, попить водички или чего-нибудь в этом роде прямо сейчас.
Вы вернулись? Ну разумеется, иначе бы вы все это сейчас не читали. Прежде чем мы перейдем к вычислению молекулярной массы по характеристической вязкости, я должен еще рассказать вам о другом способе расчета характеристической вязкости. Вы помните нашу старую добрую относительную вязкость? Я же говорил вам, что она нам еще пригодится! Именно ее-то мы сейчас и используем. Давайте возьмем натуральный логарифм относительной вязкости и поделим ее на величину концентрации раствора, для которого проводилось измерение. Это дает нам логарифмическую вязкость.
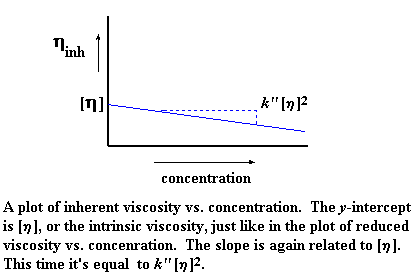
Точно так же, как и в случае приведенной вязкости, существует свое значение логарифмической вязкости для каждого измеренного значения концентрации. Поэтому давайте построим график логарифмической вязкости по оси y, а по оси x отложим концентрацию раствора. Тогда мы получим график примерно такого вида:
Как и прежде, [ h ] — это точка пересечения нашего графика с осью y, но угол наклона на этот раз у нас другой. На этот раз он равен k» [ h ] 2 . Да, и на этот раз наш график задается тангенсом угла наклона и смещением по оси y. Хотите на него взглянуть? Вот он:
Мы обычно вычисляем нашу характеристическую вязкость, используя оба этих метода. Если их результаты совпадают, то мы знаем, что мы все сделали правильно. Мы обычно помещаем обе прямые на один рисунок, получая таким образом график, на котором две прямые встречаются в общей точке пересечения с осью y:
Другим способом определить, что все в порядке, является проверка равенства k’ — k» = 1/2.
Мы проделали уже огромную кучу операций с различными цифрами, но так пока и не получили значение молекулярной массы. Хоть когда-нибудь мы его получим?
Оно называется уравнением Марка-Куна-Хаувинка (Mark-Houwink). M — это то, что мы называем вискозиметрической средней молекулярной массой (наконец-то!), а K’ и a — это константы Марка-Куна-Хаувинка. Для каждого сочетания полимер — растворитель существует свой особый набор констант Марка-Куна-Хаувинка. Поэтому вам следует знать, с каким сочетанием полимер-растворитель вы имеете дело, чтобы точно определить молекулярную массу. Это также означает, что вы не можете таким методом получить точное значение молекулярной массы для полимера, который вы только что изобрели и для которого неизвестен набор констант Марка-Куна-Хаувинка. Но тем не менее этот метод может дать вам качественную оценку того, велика молекулярная масса или мала. Уже сам факт наличия характеристической вязкости может сказать вам о многом. Иногда это единственный способ сказать, является ли на самом деле полученное вами вещество полимером или нет.
Одно последнее замечание: для проведения такого рода экспериментов вам надо использовать сильно разбавленные растворы. Если раствор слишком концентрированный, то молекулы полимера могут сблизиться друг с другом настолько, что начнут взаимодействовать между собой. Это взаимодействие приводит к тому, что вязкость раствора начинает возрастать таким образом, который плохо описывается нашими уравнениями, поэтому получение точных данных становится невозможным. Вот почему этот метод называется вискозиметрией в разбавленных растворах.
http://www.trotted.narod.ru/collchem/lec-15.htm
http://www.pslc.ws/russian/vis.htm