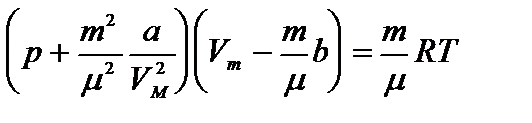Уравнение майера для газа ван дер ваальса
Предпринималось много попыток для учета отклонений свойств реальных газов от свойств идеального газа путем введения различных поправок в уравнение состояния идеального газа. Наибольшее распространение вследствие простоты и физической наглядности получило уравнение Ван-дер-Ваальса (1873).
Первая поправка в уравнении состояния идеального газа рассматривает собственный объем, занимаемый молекулами реального газа. В уравнении Дюпре (1864)
постоянная b учитывает собственный мольный объем молекул.
При понижении температуры межмолекулярное взаимодействие в реальных газах приводит к конденсации (образование жидкости). Межмолекулярное притяжение эквивалентно существованию в газе некоторого внутреннего давления 

(p + 
Ван-дер-Ваальс в 1873 г. дал функциональную интерпретацию внутреннего давления. Согласно модели Ван-дер-Ваальса, силы притяжения между молекулами (силы Ван-дер-Ваальса) обратно пропорциональны шестой степени расстояния между ними, или второй степени объема, занимаемого газом. Считается также, что силы притяжения суммируются с внешним давлением. С учетом этих соображений уравнение состояния идеального газа преобразуется в уравнение Ван-дер-Ваальса:
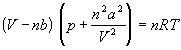
или для одного моля
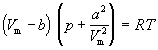
Значения постоянных Ван-дер-Ваальса a и b, которые зависят от природы газа, но не зависят от температуры, приведены в таблице 1.3.
Таблица 1.3. Постоянные Ван-дер-Ваальса для различных газов
| Газ | a, л 2 *бар* моль -2 | b,см 3 * моль -1 | Газ | a, л 2 * бар* моль -2 | b, см 3 * моль -1 |
| He | 0,03457 | 23,70 | NO | 1,358 | 27,89 |
| Ne | 0,2135 | 17,09 | NO2 | 5,354 | 44,24 |
| Ar | 1,363 | 32,19 | H2O | 5,536 | 30,49 |
| Kr | 2,349 | 39,78 | H2S | 4,490 | 42,87 |
| Xe | 4,250 | 51,05 | NH3 | 4,225 | 37,07 |
| H2 | 0,2476 | 26,61 | SO2 | 6,803 | 56,36 |
| N2 | 1,408 | 39,13 | CH4 | 2,283 | 42,78 |
| O2 | 1,378 | 31,83 | C2H4 | 4,530 | 5,714 |
| Cl2 | 6,579 | 56,22 | C2H6 | 5,562 | 63,80 |
| CO | 1,505 | 39,85 | C3H8 | 8,779 | 84,45 |
| CO2 | 3,640 | 42,67 | C6H6 | 18,24 | 115,4 |
Уравнение (1.6) можно переписать так, чтобы выразить в явном виде давление
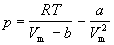
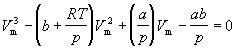
Уравнение (1.8) содержит объем в третьей степени и, следовательно, имеет или три действительных корня, или один действительный и два мнимых. При высоких температурах уравнение (1.8) имеет один действительный корень, и по мере повышения температуры кривые, вычисленные по уравнению Ван-дер-Ваальса, приближаются к гиперболам, соответствующим уравнению состояния идеального газа.
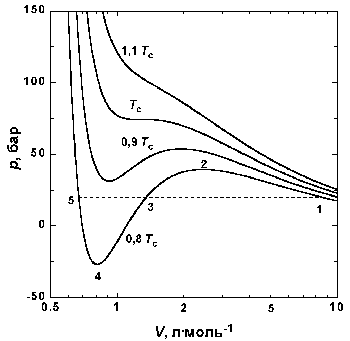 |
| Рис.1.4 Изотермы Ван-дер-Ваальса для СО2 |
На рис. 1.4 (стр. 7) приведены изотермы, вычисленные по уравнению Ван-дер-Ваальса для диоксида углерода (значения констант a и b взяты из табл. 1.3). Из рисунка видно, что при температурах ниже критической (31,04 °С) вместо горизонтальных прямых, соответствующих равновесию жидкости и пара, получаются волнообразные кривые 12345 с тремя действительными корнями, из которых только два, 1 и 5, физически осуществимы. Третий корень (точка 3) физически не реален, поскольку находится на участке кривой 234, противоречащем условию стабильности термодинамической системы 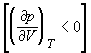
Согласно правилу Максвелла (the Maxwell construction), которое имеет теоретическое обоснование, для того, чтобы расчетная кривая соответствовала экспериментальной равновесной изотерме, нужно вместо кривой 12345 провести горизонтальную прямую 15 так, чтобы площади 1231 и 3453 были равны. Тогда ордината прямой 15 будет равна давлению насыщенного пара, а абсциссы точек 1 и 5 – мольным объемам пара и жидкости при данной температуре.
По мере повышения температуры все три корня сближаются, и при критической температуре Tc все три корня становятся равными. В критической точке изотерма Ван-дер-Ваальса имеет точку перегиба [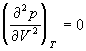
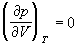
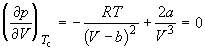
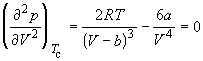
Совместное решение этих уравнений дает:
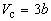
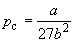
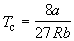
что позволяет определять константы уравнения Ван-дер-Ваальса из критических параметров газа. Соответственно, согласно уравнению Ван-дер-Ваальса, критический фактор сжимаемости Zc для всех газов должен быть равен
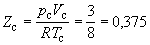
Из таблицы 1.2 видно, что хотя значение Zc для реальных газов приблизительно постоянно (0,27 – 0,30 для неполярных молекул), оно все же заметно меньше вытекающего из уравнения Ван-дер-Ваальса. Для полярных молекул наблюдается еще большее расхождение.
Принципиальное значение уравнения Ван-дер-Ваальса определяется следующими обстоятельствами:
1) уравнение было получено из модельных представлений о свойствах реальных газов и жидкостей, а не явилось результатом эмпирического подбора функции f(p,V,T), описывающей свойства реальных газов;
2) уравнение долго рассматривалось как некоторый общий вид уравнения состояния реальных газов, на основе которого было построено много других уравнений состояния (см. ниже);
3) с помощью уравнения Ван-дер-Ваальса впервые удалось описать явление перехода газа в жидкость и проанализировать критические явления. В этом отношении уравнение Ван-дер-Ваальса имеет преимущество даже перед более точными уравнениями в вириальной форме (см. 1.1, 1.2).
Причиной недостаточной точности уравнения Ван-дер-Ваальс считал ассоциацию молекул в газовой фазе, которую не удается описать, учитывая зависимость параметров a и b от объема и температуры, без использования дополнительных постоянных. После 1873 г. сам Ван-дер-Ваальс предложил еще шесть вариантов своего уравнения, последнее из которых относится к 1911 г. и содержит пять эмпирических постоянных. Две модификации уравнения (1.5) предложил Клаузиус, и обе они связаны с усложнением вида постоянной b. Больцман получил три уравнения этого типа, изменяя выражения для постоянной a. Всего известно более сотни подобных уравнений, отличающихся числом эмпирических постоянных, степенью точности и областью применимости. Выяснилось, что ни одно из уравнений состояния, содержащих менее 5 индивидуальных постоянных, не оказалось достаточно точным для описания реальных газов в широком диапазоне p, V, T, и все эти уравнения оказались непригодными в области конденсации газов. Из простых уравнений с двумя индивидуальными параметрами неплохие результаты дают уравнения Дитеричи и Бертло (см. табл. 1.4).


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Реальные газы. Уравнение Ван-дер-Ваальса. Критическое состояние.
Реальным называется газ, между молекулами которого действуют силы межмолекулярного взаимодействия, состоящие из сил притяжения и сил отталкивания.
Для получения уравнения состояния реального газа необходимо учесть собственный объем молекул и энергию взаимодействия молекул на расстоянии. Наличие собственного объема молекул приводит к уменьшению объема, предоставленного молекулам, на некоторую величину. Силы притяжения между молекулами газа вызывают уменьшение давления молекул газа на стенки сосуда на некоторую величину рi.
Это уравнение может получено путем соответствующего изменения уравнения Менделеева-Клапейрона путем внесения в него поправок.
Уравнение состояния реального газа (уравнение Ван-дер-Ваальса) для одного моля имеет вид:
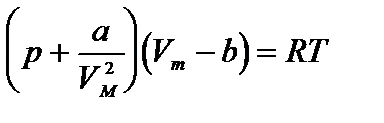
где р — давление, оказываемое на стенки сосуда, VМ – объем одного моля газа, а и b — постоянные Ван-дер-Ваальса, имеющие для разных газов различные значения, определяемые опытным путем. Поправка 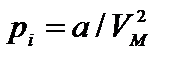
b= 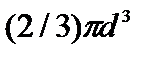
Уравнение Ван-дер-Ваальса для произвольной массы газа имеет вид:
Уравнение Ван-дер-Ваальса позволяет построить теоретические изотермы реального газа и сравнить их с изотермами идеального газа и экспериментальными изотермами реального газа.
Уравнение Ван-дер-Ваальса после нескольких преобразований можно записать в виде:
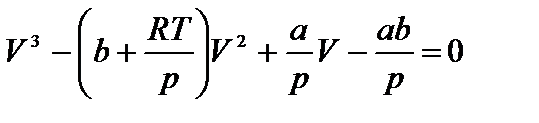
Это уравнение третьей степени относительно V. Кубическое уравнение может иметь либо три вещественных корня, либо один вещественный и два мнимых.
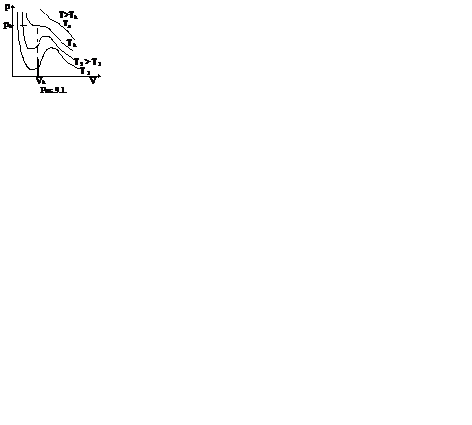
Первому случаю соответствуют изотермы при низких температурах – кривые для Т1 и Т2 (рис.9.1.) Второму случаю изотермы при высоких температурах (одно значение объема V отвечает одному значению давления р), то есть любая изотерма начиная от изотермы для Тк.
Совпадение изотерм идеального и реального газа наблюдается при малых давлениях и больших объемах (так как при этих условиях газ можно считать идеальным). Для семейства изотерм Ван-дер-Ваальса характерно так называемой критической изотермы (при температуре Тк) имеющий точку перегиба при некотором давлении рк и объеме Vк; при Т>Тк все изотермы идут монотонно, при Т
Уравнение Ван-дер-Ваальса описывает не только свойства газов и паров, но и жидкостей. Анализ изотерм реального газа показывает, что превращение реального газа в жидкость возможно только при температурах, меньших критической, и при соответствующих давлениях.
Дата добавления: 2015-04-01 ; просмотров: 18359 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
1. Уравнение состояния газа Ван-дер Ваальса
Главная > Документ
| Информация о документе | |
| Дата добавления: | |
| Размер: | |
| Доступные форматы для скачивания: |
1. Уравнение состояния газа Ван-дер Ваальса
1. Реальный газ отличается от идеального.
Уравнение состояния идеального газа – приближенно:
1) М.В.Ломоносов еще в XVIII в. указывал, что давление, обусловленное ударами о стенку хаотически движущихся молекул, не будет подчиняться закону Бойля 

2) как мы знаем из теоремы Нернста, и при низких температурах 

3) существуют и другие количественные и качественные нарушения уравнения Клайперона-Менделеева 
Основной причиной наблюдаемых отличий реальных газов от идеальных является наличие сил взаимодействия между молекулами реальных газов .
Силы взаимодействия можно классифицировать следующим образом:
а) химические или валентные, если возникло новое соединение;
б) кулоновские силы притяжения и отталкивания, если газ ионизирован
(плазма — квазинейтральный ионизированный газ);
в) молекулярные силы 
Именно они нас и будут интересовать. Это силы притяжения между молекулами на “больших” расстояниях 
( 
Если в отсутствии внешних полей центры положительных и отрицательных зарядов не совпадают, то такие молекулы называются полярными.
Если электронная оболочка симметрична и центры положительных и отрицательных
зарядов в молекуле совпадают, то мы имеем дело с неполярными молекулами.
Под действием электрического поля
а) неполярные молекулы поляризуются за счет деформации электронной оболочки;
б
Вокруг каждой поляризованной молекулы возникает быстро убывающее с радиусом электрическое поле 
Если в поле 
П




Энергия взаимодействия 





Аппроксимация (от лат. approximo–приближаюсь) –приближенное выражение какого-либо математическкого объекта через другие более простые.
Потенциал Леннарда-Джонса используется в теории газов и дает хорошее совпадение с экспериментом для реальных газов.
2. Модель: В простейшей теории используется ещё более грубая пунктирная аппроксимация,
соответствующая следующей модели:
1) Газ состоит из твердых упругих шариков диаметром 
2) Молекулы-шарики притягиваются на расстоянии 


3. Учёт притяжения.
Из-за взаимного притяжения между молекулами газ как бы сжимается эффективно большим давлением, чем давление 
Величина этой положительной добавки к 
молекул, содержащихся в единице объема каждого из взаимодействующих объемов 





4. Учет отталкивания.
Учтем силы отталкивания в рамках предложенной модели, предполагая существование объема недоступного для движения молекул вследствие конечности их размера 
П


Если у нас 1 моль, то объем, доступный движению молекул, 

5. Уравнение Ван-дер-Ваальса.
Тогда подправим уравнение состояния одного моля идеального газа, написав
уравнение состояния для 1 моля газа Ван-дер-Ваальса:

где 

Если у нас не один моль, а 

Еще раз о смысле каждой скобки, 



6. Качественные вопросы
1) Изобразим изохору реального газа в координатах
То есть для реального газа увеличение температуры при постоянном объеме вызывает более резкий рост давления, чем для идеального газа:



2) Изобразим изобару в координатах
T При


2. Внутренняя энергия газа Ван-дер-Ваальса
1. Внутренняя энергия В-д-В газа


При расширении работа, совершаемая силами притяжения молекул газа, равна убыли его потенциальной энергии, связанной с притяжением молекул:

2. Задача об убранной перегородке для реального газа .
а) Для идеального газа:

б) Для Ван-дер-Ваальсовского газа:
То есть с увеличением объема
3. Эффект Джоуля-Томпсона
В

Отв. Для идеального газа температура не изменится, а для реального газа будет наблюдаться эффект Джоуля- Томпсона.
а) Если 


Газ охлаждается, так как при расширении внутренняя энергия расходуется на работу против сил молекулярного притяжения. Этот эффект используется для ожижения газов и получения низких температур.
б) При 
Отрицательный эффект Джоуля-Томпсона реализуется для 


Для общего развития: 
где 
3. Теплоемкость газа Ван-дер Ваальса
Здесь 
Проведем расчет теплоемкости для одного моля реального газа при различных процессах:
1) Изохорический 


2) Адиабатический 

3)
4)
Найдем 


т.о. 
4. Уравнение адиабаты для газа Ван-дер- Ваальса


5. Энтропия газа Ван-дер Ваальса
1)

2) Как измениться энтропия газа в задаче об убранной перегородке:
То есть
6. Уравнение политропы В-д-В газа
Уравнение адиабаты для В-д-В газа:
Для идеального газа уравнение адиабаты:
По аналогии естественно предположить, что для В-д-В газа уравнение политропы будет иметь вид:



или уравнения политропы В-д-В газа, здесь 
7. Изотермы Ван-дер-Ваальса

М
в) Изотермы, построенные в координатах (P,V), дают наиболее содержательные результаты.
Найдем особые точки изотермы, вычислив 
Найдем корни этого уравнения:



Т.о. чем 


В точке К с параметрами 

К понятию критического состояния можно придти путем анализа экспериментальной изотермы без рассмотрения какого-либо теоретического уравнения состояния. Уравнение В-д-В является лишь модельным, и не все состояния, совместимые с уравнением В-д-В, могут быть реализованы. Реализованы могут быть только устойчивые состояния.
Одно из необходимых условий термодинамической устойчивости однородного вещества:
Оно означает, что при изотермическом увеличении давления 


Участки AC и BD соответствуют разным фазовым состояниям вещества.
8. Экспериментальные изотермы реального газа
В изучение этого вопроса значительный вклад внесли следующие исследователи: Ван Марум (1750-1837), Фарадей (1791-1867), Эндрюс (1813-1885).
Опред. В термодинамике фазой называется совокупность однородных, одинаковых по
свойствам частей системы .
Различают следующие фазы: газообразная, жидкая, различные кристаллические
Разные фазы могут существовать в равновесии друг с другом.
Переход вещества из одной фазы в другую называется фазовым переходом.
Существуют фазовые переходы:
жидкость 
газ 
жидкость 
Фазовый переход I рода сопровождается выделением/поглощением тепла.
твердая фаза 
резистивное состояние 
обычная жидкость 
При фазовых переходах II рода нет выделения/поглощения тепла .
Р

На участке EF жидкость и газ находятся в термодинамическом равновесии (т.д.р.)
Условия термодинамического равновесия фаз :
Таким образом мы распространили уравнение Ван-дер Вальса на область жидкого состояния, где оно вообще-то не применимо.
Газ, находящийся в равновесии с жидкостью, называется насыщенным паром .
Вопр.: Какая разница между паром и газом?
Отв. Пар – это газ, который может быть превращен в жидкость изотермически .
Пар – это газ с температурой ниже критической.
В значительной степени двойственная терминология обусловлена исторически: те газы, которые могли быть превращены в жидкость, называли парами, а те, которые ожижить не удавалось, — газами. Когда все газы сжижили, то необходимость в различии названий отпала.
В 

Из т.1 
Из т.2
Из т.3
На самом деле 
следовательно, вещество внизу ампулы должно заметно уплотняться вследствие
гравитации, поэтому благодаря сильному изменению плотности вещества с высотой,
в ампуле иметь критическую плотность может только бесконечно тонкой слой вещества.
В нем и происходит исчезновение мениска. В этом заключается суть метода мениска для
измерения критической температуры 
В критической точке вещество обладает необычными свойствами:
1) бесконечной сжимаемостью;
2)
3
Метастабильные участки AE и BF могут существовать:
BF соответствует пересыщенному пару, который может быть получен при резком адиабатическом расширении.
EA соответствует перегретой жидкости, она может быть получена резким уменьшением давления. Это – физически однородная жидкость, в которой нет растворенного газа.
Горизонтальный участок изотермы EF определяется правилом Максвелла: 
Рассмотрим цикл 

Вопр.: Рассмотрим два цикла 



Отв.: 1) Для цикла 


2) Для цикла 


состояние не может перейти в однофазное. В обратную сторону перход возможен, но при этом 
К




9. Уравнение Клайперона-Клаузиуса. Диаграмма состояния
1234 – цикл Карно с изотермическим реальным газом.

Тангенс угла наклона кривой испарения и
сублимации всегда больше нуля,
следовательно, угол наклона соответствующих кривых меньше 
Для плавления это может быть не так (
Диаграмма фазовых переходов
Три фазы одного и того же вещества могут существовать в равновесии только в
одной точке, то есть при единственных значениях 
Р
Параметры критичного состояния для 


10. Другие уравнения реальных газов




Уравнение Ван-дер Вальса имеет преимущества вследствие легко объяснимого физического смысла параметров. Его-то и надо уметь пояснять.
http://helpiks.org/3-368.html
http://gigabaza.ru/doc/100413.html