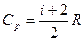Уравнение майера для молярных теплоемкостей
| Теплоёмкость идеального газа. Уравнение Майера |   |
Теплоёмкость тела характеризуется количеством теплоты, необходимой для нагревания этого тела на один градус:
Однако, теплоёмкость – величина неопределённая, поэтому пользуются понятиями удельной и молярной теплоёмкости. Удельная теплоёмкость (Суд) есть количество теплоты, необходимое для нагревания единицы массы вещества на 1 градус [Cуд] = Дж/К. Для газов удобно пользоваться молярной теплоемкостью Cμ— количество теплоты, необходимое для нагревания 1 моля газа на 1 градус:
Из п. 1.2 известно, что молярная масса – масса одного моля:
Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при нагревании. Если газ нагревать при постоянном объёме, то всё подводимое тепло идёт на нагревание газа, то есть изменение его внутренней энергии. Теплоёмкость при этом обозначается СV. СР – теплоемкость при постоянном давлении. Если нагревать газ при постоянном давлении Р в сосуде с поршнем, то поршень поднимется на некоторую высоту h, то есть газ совершит работу (рис. 4.2). Итак, проводимое тепло и теплоёмкость зависят от того, каким путём осуществляется передача тепла. Значит, Q и С не являются функциями состояния. Величины СР и СV оказываются связанными простыми соотношениями. Найдём их. Пусть мы нагреваем один моль идеального газа при постоянном объёме(dA = 0). Тогда первое начало термодинамики запишем в виде:
Теплоемкость при постоянном объёме будет равна:
Из (4.2.4) следует, что
Для произвольной идеальной массы газа:
При изобарическом процессе, кроме увеличения внутренней энергии, происходит совершение работы газом:
Из этого следует, что физический смысл универсальной газовой постоянной в том, что R – численно равна работе, совершаемой одним молем газа при нагревании на один градус в изобарическом процессе. Используя это соотношение, Роберт Майер в 1842 г. вычислил механический эквивалент теплоты: 1 кал = 4,19 Дж. Полезно знать формулу Майера для удельных теплоёмкостей: Уравнение МайераУравнение Майера связывает теплоемкости идеального газа в двух изопроцессах, тогда перейдем к самому его определению. Теплоемкость. Уравнение МайераПереданное телу количество теплоты для его нагревания на 1 К получило название теплоемкости тела данной системы. Обозначение принимается буквой » С » : Значение теплоемкости единицы молярной массы тела: c μ = C v ( 2 ) . Выражение называется молярной теплоемкостью. Теплоемкость не считается функцией состояния, так как является характеристикой бесконечно близких состояний системы или выражается в качестве функции бесконечно малого процесса, совершаемого в системе. В количественном выражении это означает, что из ( 1 ) , применяя первое начало термодинамики, дифференциальная форма получится: C = δ Q d T = d U + p d V d T ( 3 ) . Уравнение Майера для идеального газаОпределение термодинамической системы производится при помощи трех параметров p , V , T . Существующее между ними отношение получило название уравнения состояния. Для идеального газа используется уравнение Менделеева-Клапейрона. Данная связь запишется в виде: p = p ( T , V ) или T = T ( p , V ) , V = V ( p , T ) . При выборе независимых переменных в качестве V и T внутренняя энергия системы выражается в виде функции U = U ( T , V ) . Получим, что значение полного дифференциала от внутренней энергии примет вид: d U = ∂ U ∂ T V d T + ∂ U ∂ V T d V ( 4 ) . Произведем подстановку из ( 4 ) в ( 3 ) , тогда c = ∂ U ∂ T V d T + ∂ U ∂ V T d V + p d V d T = ∂ U ∂ T V + p + ∂ U ∂ V T d V d T ( 5 ) . Исходя из формулы ( 5 ) , теплоемкость находится в зависимости от процесса. Если он изохорный, то Значение теплоемкости изохорного процесса запишется как: C V = ∂ U ∂ T V ( 6 ) . При изобарном теплоемкость выражается через формулу: C p = ∂ U ∂ T V + p + ∂ U ∂ V T ∂ V ∂ T p = C V + p + ∂ U ∂ V T ∂ V ∂ T p ( 7 ) . Перейдем к рассмотрению исследуемой системе идеального газа. Запись малого приращения энергии идеального газа: d U = i 2 v R d T ( 8 ) . d U d V T = 0 ( 9 ) . Состояние идеального газа описывается при помощи уравнения Менделеева-Клапейрона: ∂ V ∂ T p = v R p ( 11 ) . Произведем подстановку в ( 7 ) из ( 10 ) и ( 11 ) : C p = C V + p + 0 v R p = C V + v R ( 12 ) . Выражение ( 12 ) называют выведенным соотношением Майера. Или для молярных теплоемкостей: C μ p = C μ V + R ( 13 ) . Найти удельную теплоемкость смеси 16 г кислорода и 10 г гелия в процессе с постоянным давлением. Если Q считается количеством тепла, получаемым смесью газов в процессе, то Q = c p m ∆ T ( 1 . 1 ) , где m является массой смеси, c p – удельной теплоемкостью смеси при неизменном давлении. Q O 2 — это количество тепла, получаемое кислородом: Q O 2 = c p O 2 m O 2 ∆ T ( 1 . 2 ) , m O 2 выражается массой кислорода, c p O 2 – теплоемкостью кислорода с постоянным давлением. Для гелия аналогично: Q H e = c p H e m H e ∆ T ( 1 . 3 ) . Кроме этого рассмотрим: Q = c p m ∆ T = Q O 2 + Q H e = c p O 2 m O 2 ∆ T + c p H e m H e ∆ T ( 1 . 4 ) . Нахождение массы смеси производится по закону сохранения массы: m = m O 2 + m H e ( 1 . 5 ) . Произведем выражение теплоемкости c p из ( 1 . 4 ) , учитывая ( 1 . 5 ) . Тогда имеем: c p = c p O 2 m O 2 + c p H e m H e m O 2 + m H e ( 1 . 6 ) . Существует связь между молярной теплоемкостью и удельной: c μ = c · μ → c = c μ μ ( 1 . 7 ) . Если c μ V = i 2 R , то по уравнению Роберта Майера c μ p = c μ V + R : c μ p = i + 2 2 R ( 1 . 8 ) ; i H e = 3 , i O 2 = 5 . В данном случае удельные теплоемкости запишутся как: c p H e = 5 2 R μ H e , c p O 2 = 7 R 2 μ O 2 ( 1 . 9 ) . Результатом будет записанная формула удельной теплоемкости смеси: c p = 7 R 2 μ O 2 m O 2 + 5 2 R μ H e m H e m O 2 + m H e ( 1 . 10 ) . c p = 3 , 5 · 8 , 31 · 16 32 + 2 , 5 · 8 , 31 · 10 4 26 = 14 , 5 + 51 , 94 26 = 2 , 56 Д ж г К . Ответ: удельная теплоемкость смеси равняется 2 , 56 Д ж г К . При проведении опытов Джоулем было получено, что с μ p — c μ V = 1 , 986 к а л К · м о л ь . Значение газовой постоянной, измеренной в механических единицах R = 8 , 314 · 10 7 э р г К · м о л ь . Определите, как соотносятся 1 к а л , э р г , Д ж . Основой решения данного задания принято считать уравнение Майера, формула записывается: с μ p = c μ V + R → c μ p — c μ V = R ( 2 . 1 ) . Отсюда получим, что: c μ p — c μ V = 1 , 986 к а л К · м о л ь = 8 , 314 · 10 7 э р г К · м о л ь → 1 к а л = 4 , 18 · 10 7 э р г = 4 , 18 Д ж . Ответ: 1 к а л = 4 , 18 · 10 7 э р г = 4 , 18 Д ж . Теплоемкость. Уравнение МайераУдельная теплоемкость веществавеличина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К: Единица удельной теплоемкости — джоуль на килограмм-кельвин (Дж/(кг•К)). Молярная теплоемкость—величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К: где v = m/M — количество вещества, выражающее число молей. Единица молярной теплоемкости — джоуль на моль-кельвин (Дж/(моль•К)). Удельная теплоемкость с связана с молярной Сm соотношением где М — молярная масса вещества. Различают теплоемкости при постоянном объеме и постоянном давлении, если в процессе нагревания вещества его объем или давление поддерживается постоянным. Запишем выражение первого начала термодинамики для 1 моля газа с: Если газ нагревается при постоянном объеме, то работа внешних сил равна нулю и сообщаемая газу извне теплота идет только на увеличение его внутренней энергии: т. е. молярная теплоемкость газа при постоянном объеме Сv равна изменению внутренней энергии 1 моля газа при повышении его температуры на 1 К. Так как Если газ нагревается при постоянном давлении, то выражение (9-21) можно записать в виде Учитывая, что dUm/dT не зависит от вида процесса (внутренняя энергия идеального газа не зависит ни от р, ни от V, а определяется лишь температурой Т) и всегда равна Сv, продифференцировав уравнение Клапейрона — Менделеева pVm=RT по T(p=const), получим Cp = Cv + R. (9-22) Выражение (9-22) называется уравнением Майера;оно показывает, что Ср всегда больше Сv на величину молярной газовой постоянной. Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, так как постоянство давления обеспечивается увеличением объема газа. Использовав (9-21) выражение (9-22) можно записать в виде При рассмотрении термодинамических процессов важно знать характерное источники: http://zaochnik.com/spravochnik/fizika/termodinamika/uravnenie-majera/ http://helpiks.org/3-16843.html |




 ,
, ,
, ,
,
 ,
, ,
, ,
, .
. .
. .
.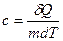
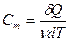 (9-17)
(9-17)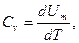 (9-20)
(9-20)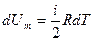 ,
,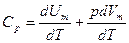 .
.