Уравнение Майера
Уравнение Майера связывает теплоемкости идеального газа в двух изопроцессах, тогда перейдем к самому его определению.
Теплоемкость. Уравнение Майера
Переданное телу количество теплоты для его нагревания на 1 К получило название теплоемкости тела данной системы. Обозначение принимается буквой » С » :
Значение теплоемкости единицы молярной массы тела:
c μ = C v ( 2 ) . Выражение называется молярной теплоемкостью.
Теплоемкость не считается функцией состояния, так как является характеристикой бесконечно близких состояний системы или выражается в качестве функции бесконечно малого процесса, совершаемого в системе. В количественном выражении это означает, что из ( 1 ) , применяя первое начало термодинамики, дифференциальная форма получится:
C = δ Q d T = d U + p d V d T ( 3 ) .
Уравнение Майера для идеального газа
Определение термодинамической системы производится при помощи трех параметров p , V , T . Существующее между ними отношение получило название уравнения состояния. Для идеального газа используется уравнение Менделеева-Клапейрона. Данная связь запишется в виде:
p = p ( T , V ) или T = T ( p , V ) , V = V ( p , T ) .
При выборе независимых переменных в качестве V и T внутренняя энергия системы выражается в виде функции U = U ( T , V ) . Получим, что значение полного дифференциала от внутренней энергии примет вид:
d U = ∂ U ∂ T V d T + ∂ U ∂ V T d V ( 4 ) .
Произведем подстановку из ( 4 ) в ( 3 ) , тогда
c = ∂ U ∂ T V d T + ∂ U ∂ V T d V + p d V d T = ∂ U ∂ T V + p + ∂ U ∂ V T d V d T ( 5 ) .
Исходя из формулы ( 5 ) , теплоемкость находится в зависимости от процесса. Если он изохорный, то
Значение теплоемкости изохорного процесса запишется как:
C V = ∂ U ∂ T V ( 6 ) .
При изобарном теплоемкость выражается через формулу:
C p = ∂ U ∂ T V + p + ∂ U ∂ V T ∂ V ∂ T p = C V + p + ∂ U ∂ V T ∂ V ∂ T p ( 7 ) .
Перейдем к рассмотрению исследуемой системе идеального газа. Запись малого приращения энергии идеального газа:
d U = i 2 v R d T ( 8 ) .
d U d V T = 0 ( 9 ) .
Состояние идеального газа описывается при помощи уравнения Менделеева-Клапейрона:
∂ V ∂ T p = v R p ( 11 ) .
Произведем подстановку в ( 7 ) из ( 10 ) и ( 11 ) :
C p = C V + p + 0 v R p = C V + v R ( 12 ) .
Выражение ( 12 ) называют выведенным соотношением Майера.
Или для молярных теплоемкостей:
C μ p = C μ V + R ( 13 ) .
Найти удельную теплоемкость смеси 16 г кислорода и 10 г гелия в процессе с постоянным давлением.
Если Q считается количеством тепла, получаемым смесью газов в процессе, то
Q = c p m ∆ T ( 1 . 1 ) , где m является массой смеси, c p – удельной теплоемкостью смеси при неизменном давлении.
Q O 2 — это количество тепла, получаемое кислородом:
Q O 2 = c p O 2 m O 2 ∆ T ( 1 . 2 ) , m O 2 выражается массой кислорода, c p O 2 – теплоемкостью кислорода с постоянным давлением.
Для гелия аналогично:
Q H e = c p H e m H e ∆ T ( 1 . 3 ) .
Кроме этого рассмотрим:
Q = c p m ∆ T = Q O 2 + Q H e = c p O 2 m O 2 ∆ T + c p H e m H e ∆ T ( 1 . 4 ) .
Нахождение массы смеси производится по закону сохранения массы:
m = m O 2 + m H e ( 1 . 5 ) .
Произведем выражение теплоемкости c p из ( 1 . 4 ) , учитывая ( 1 . 5 ) . Тогда имеем:
c p = c p O 2 m O 2 + c p H e m H e m O 2 + m H e ( 1 . 6 ) .
Существует связь между молярной теплоемкостью и удельной:
c μ = c · μ → c = c μ μ ( 1 . 7 ) .
Если c μ V = i 2 R , то по уравнению Роберта Майера c μ p = c μ V + R :
c μ p = i + 2 2 R ( 1 . 8 ) ; i H e = 3 , i O 2 = 5 .
В данном случае удельные теплоемкости запишутся как:
c p H e = 5 2 R μ H e , c p O 2 = 7 R 2 μ O 2 ( 1 . 9 ) .
Результатом будет записанная формула удельной теплоемкости смеси:
c p = 7 R 2 μ O 2 m O 2 + 5 2 R μ H e m H e m O 2 + m H e ( 1 . 10 ) .
c p = 3 , 5 · 8 , 31 · 16 32 + 2 , 5 · 8 , 31 · 10 4 26 = 14 , 5 + 51 , 94 26 = 2 , 56 Д ж г К .
Ответ: удельная теплоемкость смеси равняется 2 , 56 Д ж г К .
При проведении опытов Джоулем было получено, что с μ p — c μ V = 1 , 986 к а л К · м о л ь . Значение газовой постоянной, измеренной в механических единицах R = 8 , 314 · 10 7 э р г К · м о л ь . Определите, как соотносятся 1 к а л , э р г , Д ж .
Основой решения данного задания принято считать уравнение Майера, формула записывается:
с μ p = c μ V + R → c μ p — c μ V = R ( 2 . 1 ) .
Отсюда получим, что:
c μ p — c μ V = 1 , 986 к а л К · м о л ь = 8 , 314 · 10 7 э р г К · м о л ь → 1 к а л = 4 , 18 · 10 7 э р г = 4 , 18 Д ж .
Ответ: 1 к а л = 4 , 18 · 10 7 э р г = 4 , 18 Д ж .
Теплоемкость газов. Уравнение Майера.
Теплоемкость идеального двухатомного газа.
Теплоемкостью системы тел (тела) называется физическая величина, равная отношению количества теплоты dQ, которое нужно затратить для нагревания системы тел (тела), к изменению температуры dТ, характеризующей это нагревание:
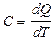
Удельной теплоемкостью вещества с называется скалярная величина, равная отношению теплоемкости однородного тела С к его массе:
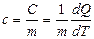
Молярной теплоемкостью называется физическая величина, численно равная отношению теплоемкости системы С к количеству вещества n, содержащегося в ней:

Различают молярные теплоемкости при постоянном объеме СV и постоянном давлении Cp:

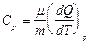
Уравнение, связывающее молярные теплоемкости при постоянном давлении и постоянном объеме имеет вид (уравнение Майера):
где R – универсальная газовая постоянная.
Учитывая распределение энергии по степеням свободы и уравнение Майера (9.3.4), получим распределение теплоемкостей Cp и CV по степеням свободы:
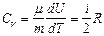
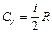
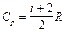
При рассмотрении термодинамических процессов удобно пользоваться соотношением: 
Величина g — показатель адиабаты — определяется числом и характером степеней свободы молекулы (табл.1).
| Молекула | Число степеней свободы | CV | Cp | g |
| Поступательное движение | Вращательное движение. | i | ||
| Одноатомная | — |  | 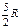 | 1,67 |
| Двухатомная | 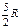 | 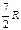 | 1,40 | |
| Трехатомная | 3R | 4R | 1,33 |
Обратимся к двухатомной молекуле. Если связь между атомами жесткая, то число степеней свободы равна 5 (три поступательных и две вращательных). Теперь предположим, что связь упругая, то есть атомы могут совершать колебания друг относительно друга. Тогда требуется еще одна координата для определения конфигурации молекулы, это расстояние между атомами. Следовательно, у двухатомной молекулы в общем случае шесть степеней свободы. Во многих случаях колебательное движение атомов не возбуждается. Но если колебания совершаются и их амплитуды малы (по сравнению с расстоянием между атомами), то такие колебания можно считать гармоническими. Атомы в этом случае являются гармоническими осцилляторами. Но осциллятор обладает как кинетической, так и потенциальной энергией. Для гармонического осциллятора, как известно из механики, средние значения кинетической и потенциальной энергии равны между собой. Тогда по закону равнораспределения на каждую колебательную степень свободы приходится kT/2 в виде кинетической энергии и kT/2 в виде потенциальной энергии. Энергия, приходящаяся на одну колебательную степень свободы равна не kT/2, а 2. kT/2= kT. Поэтому при подсчете степеней свободы надо число колебательных степеней свободы удвоить.
Для двухатомного газа
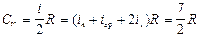
 |
причем СV не зависит от температуры. Экспериментально было доказано (рис.8.3.), что в определенном интервале температур эта теплоемкость составляет всего (5/2)R, при очень низких температурах она уменьшалась до (3/2)R, а при высоких становится больше 3R.
Это означает, что при низких температурах молекулы участвуют только в поступательном движении. По мере повышения температуры Т молекулы начинают совершать и вращательные движения. И лишь при высоких температурах она совершает все три вида движения (добавляется колебательное).
Классическая теория такое поведение объяснить не может. Объяснение было получено в рамках квантовой теории. В зависимости теплоемкости от температуры проявляются квантовомеханические свойства молекул — энергия вращательного и колебательного движения у них меняется скачками на величину hn, где n— частота вращения или колебания, h — постоянная Планка. Так как получить такой прирост энергии молекула может лишь при соударении с другой, движущейся с большей поступательной скоростью, то при низких температурах колебания и вращения не происходят (соответствующие степени свободы «вымораживаются»). При более высокой температуре средняя энергия, приходящаяся на каждую из этих степеней, зависит от соотношения между hn и kT.
Уравнение майера — справочник студента






Адиабатический процесс. Вывод уравнения для адиабатического процесса.
Обратимые и необратимые процессы. Круговые процессы. Прямой и обратный циклы и их характеристики.
Цикл Карно. Второе начало термодинамики.
Энтропия и ее свойства. Закон возрастания энтропии. Третье начало термодинамики. Вероятностная трактовка понятия энтропии Больцманом.
Сила и потенциальная энергия молекулярного взаимодействия. Межмолекулярный потенциал Леннард-Джонса.
- Переход от отталкивания на малых расстояниях к притяжению на больших расстояниях приводит к появлению минимума на кривой зависимости потенциальной энергии взаимодействия двух частиц от расстояния r между ними (П = f(r), Fr = –dП/dr).
- В качестве примера приведем явный вид потенциальной энергии Ф(r) взаимодействия двух молекул простых веществ:
- – потенциал Леннард-Джонса.
Величины ε и σ, которые являются параметрами этого потенциала, находятся в результате обработки экспериментальных данных о термодинамических свойствах каждого отдельного вещества и содержатся в различных справочниках. Из рисунка следует, что параметр σ определяет положение потенциальной ямы , а ε – глубину этой ямы.
Экспериментальные изотермы реальных газов. Критическая точка.
На рисунке приведено семейство экспериментальных изотерм, полученных для одного моля углекислого газа.
Как видно из рисунка, для температур, меньших Ткр = 340 К, на каждой изотерме имеется строго горизонтальный участок BC, вдоль которого оказывается постоянной не только температура Т, но и давление p, а молярный объем вещества изменяется в пределах от VB до VC.
Длина участка BC тем меньше, чем выше температура газа. При критической температуре Ткр = 340 К объемы VB и VC совпадают. Это означает, что критическая изотерма Ван-дер-Ваальса имеет точку перегиба, которая совпадает с критической точкой.
Соответствующие критической точке Кр значения температуры Ткр, давления pкр и объема Vкр называются критическими. Любую докритическую изотерму (Т https://studopedia.net/5_26640_pervoe-nachalo-termodinamiki-i-ee-primenenie-k-issledovaniyu-ravnovesnih-protsessov-vivod-formuli-mayera.html
Уравнение майера
- Если ТС – однородное рабочее тело, то в расчетах применяются относительные теплоемкости:
- — удельная теплоемкость – теплоемкость, отнесенная к 1 кг вещества с=С/m, Дж/кгК;
- — молярная теплоемкость – теплоемкость, отнесенная с 1 молю вещества , Дж/мольК;
- — объемная теплоемкость – теплоемкость, отнесенная к 1м3 вещества , Дж/м3К.
- Теплоемкость – функция процесса и зависит от рода рабочего тела, характера процесса и параметров состояния. Так, теплоемкость в процессе с постоянным давлением называется изобарной теплоемкостью:
где H, Дж – энтальпия.
Теплоемкость в процессе с постоянным объемом называется изохорной теплоемкостью:
где U, Дж – внутренняя энергия.
Теплоемкость идеального газа не зависит от температуры и давления и зависит только от числа степеней свободы движения молекул и в соответствии с законом о равном распределении энергии по степеням свободы движения молекул теплоемкость: 
Для одноатомного газа и , для двухатомного газа и , для трех и более атомных газов и .
Теплоемкость реальных газов зависит от давления и температуры. В ряде случаев можно пренебречь влиянием давления на теплоемкость и принять, что теплоемкость реальных газов зависит только от температуры: C=f(t). Эта зависимость определяется экспериментально.
Эмпирическая зависимость удельной истинной теплоемкости от температуры может быть представлена в виде многочлена:
где при температуре t=00C. Для двухатомных газов можно ограничиться двумя слагаемыми: , или , где .
- Для конечного участка процесса 1-2 количество теплоты равно:
- .
- Тогда средняя теплоемкость на этом участке процесса будет равна:
- , Дж/кгК.
В области низких температур при Т
Теплоемкость. Уравнение Майера
Удельная теплоемкость веществавеличина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
Единица удельной теплоемкости — джоуль на килограмм-кельвин (Дж/(кг•К)).
Молярная теплоемкость—величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К:
- где v = m/M — количество вещества, выражающее число молей.
- Единица молярной теплоемкости — джоуль на моль-кельвин (Дж/(моль•К)).
- Удельная теплоемкость с связана с молярной Сm соотношением
- Ст = сМ, (9-18)
- где М — молярная масса вещества.
- Различают теплоемкости при постоянном объеме и постоянном давлении, если в процессе нагревания вещества его объем или давление поддерживается постоянным.
- Запишем выражение первого начала термодинамики для 1 моля газа с:
- CmdT=dUm + pdVm. (9-19)
- Если газ нагревается при постоянном объеме, то работа внешних сил равна нулю и сообщаемая газу извне теплота идет только на увеличение его внутренней энергии:
т. е. молярная теплоемкость газа при постоянном объеме Сv равна изменению внутренней энергии 1 моля газа при повышении его температуры на 1 К. Так как
- то
- Cv = iR/2. (9-21)
- Если газ нагревается при постоянном давлении, то выражение (9-21) можно записать в виде
Учитывая, что dUm/dT не зависит от вида процесса (внутренняя энергия идеального газа не зависит ни от р, ни от V, а определяется лишь температурой Т) и всегда равна Сv, продифференцировав уравнение Клапейрона — Менделеева pVm=RT по T(p=const), получим
Cp = Cv + R. (9-22) Выражение (9-22) называется уравнением Майера;оно показывает, что Ср всегда больше Сv на величину молярной газовой постоянной.
Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, так как постоянство давления обеспечивается увеличением объема газа.
Использовав (9-21) выражение (9-22) можно записать в виде
При рассмотрении термодинамических процессов важно знать характерное
для каждого газа отношение Ср к Cv:
- g=Cp/Cv=(i+2)/i.
- Адиабатный процесс
- Существует достаточно много явлений, например, нагревание ручного насоса при накачивании шин, понижение температуры воздуха после извержения вулкана, при котором быстро расширяются газы, изменение температуры воздуха при сильных порывах ветра, процессы, происходящие с веществом, заключённым в теплоизолирующую оболочку, распространение звуковых волн и многие другие, объяснить которые можно, используя понятие адиабатного процесса.
- Адиабатный процесс это процесс, происходящей без теплообмена системы с окружающей средой.
Реализовать такой процесс на практике можно, быстро сжимая или расширяя газ, или заключая его в теплоизолирующую оболочку (термос, сосуд Дьюара). При адиабатном процессе , а, следовательно, первое начало термодинамики будет иметь вид: или . При адиабатном расширении газ совершает механическую работу за счёт убыли собственной внутренней энергии. При адиабатном сжатии внутренняя энергия газа растёт за счёт работы внешних сил, сжимающих его.
Исключим из этого уравнения приращение температуры, используя уравнение Менделеева — Клапейрона . Продифференцируем его и получим: , отсюда выразим приращение температуры и подставим его в (9-23), после приведения подобных получим: . Заменим в этом равенстве R на , приведём к одному знаменателю, раскроем скобки и получим:
- .
- Так как знаменатель не равен нулю, то равенство будет выполняться, если числитель равен нулю. После приведения подобных получим:
- .
Обозначим отношение теплоёмкостей . Это отношение g принято называть показателем адиабаты или коэффициентом Пуассона. После введения g получим:
Поделим обе части равенства на PV и получим уравнение с разделяющимися переменными: . Проинтегрируем это уравнение и получим: или . Воспользуемся свойством логарифмов: сумму логарифмов можно представить как логарифм произведения: . После потенцирования получим уравнение адиабаты:
Это уравнение показывает, что при адиабатном процессе с изменением объёма давление изменяется на большую величину, чем при изотермическом процессе, поскольку . Рис.9.4, на котором приведены изотерма (пунктирная линия) и адиабата (сплошная линия) для случая, когда начальные параметры состояния газа одинаковы, наглядно показывает это.
Используя уравнение состояния идеального газа, можно записать уравнение адиабаты через объём и температуру. Для этого нужно из уравнения состояния идеального газа выразить давление и подставить в уравнение (9-24). После преобразований получим:
- (9-25)
- Можно записать уравнение адиабаты через давление и температуру, выразив из уравнения состояния идеального газа, объём через давление и температуру:
- (9-26)
При адиабатном процессе все три параметра состояния изменяются. Это изменение выражено формулами (9-24), (9-25), (9-26).
Процесс адиабатного расширения изображён на рис.9.5 При адиабатном расширении газ совершает работу за счёт убыли собственной внутренней энергии: .
Работу адиабатного процесса проще всего рассчитать через изменение внутренней энергии: .
Поскольку внутренняя энергия идеального газа – функция состояния и зависит только от температуры, то изменение внутренней энергии, а, следовательно, и работу можно найти по формуле:
Работу газа при адиабатном процессе можно определить и через элементарную работу: . Для этого будем считать известными начальные параметры состояния P1 , V1, T1. Из уравнения адиабаты выразим давление Р: .
Тогда элементарная работа будет определяться формулой: . При определении работы адиабатного процесса вынесем за знак интеграла известные величины и получим: .
Вынесем за скобки , и после преобразования получим:
- (9-28)
- Используя уравнение Менделеева – Клапейрона, можно получить другую формулу:
- (9-29)
Следует отметить, что само по себе расширение идеального газа не может привести к его охлаждению, если при расширении газ не производит работу.
Это значит, что, если идеальный газ расширяется таким образом, что к сосуду, в котором он находится, присоединяется другой пустой сосуд, то температура газа не изменится.
Неизменность температуры обусловлена тем, что внутренняя энергия идеального газа не зависит от объёма. При таком расширении в пустоту идеальный газ не совершает работы.
Политропический процесс
Политропическим процессом называется всякий процесс изменения состояния, при котором теплоёмкость газа С остаётся постоянной и равной .
Отсюда выразим количество теплоты через теплоёмкость газа при политропическом процессе: . Используем первое начало термодинамики: . Здесь и — теплоёмкости газа при постоянном объёме и давлении соответственно. С учётом выражения количества теплоты через теплоёмкость политропического процесса получим или
- (9-30)
- Продифференцируем уравнение состояния идеального газа и выразим дифференциал температуры: . Учтём, что , а , получим:
- (9-31)
- Обозначим — показатель политропы. После интегрирования (9-31) и дальнейшего потенцирования полученного результата, придём к уравнению политропы:
- (9-32)
- Это уравнение может быть выражено и через другие пары параметров состояния, аналогично тому, как это было сделано для адиабатного процесса.
Рассмотренные изопроцессы и адиабатный процесс изменения состояния газа можно рассматривать как частные случаи более общего политропического процесса. Покажем, что из уравнения (9-32) можно получить уравнения известных нам процессов.
Для адиабатного процесса , следовательно, теплоёмкость С этого процесса равна нулю, а показатель политропы равен показателю адиабаты . Тогда уравнение (9-32) перейдёт в уравнение адиабаты .
Для изотермического процесса dT=0 , , показатель адиабаты n=1 , а уравнение (9-32) перейдёт в уравнение изотермы: .
Для изобарного процесса С=СР , n=0 , а уравнение (9-32) будет иметь вид или Р=const .
Для изохорического процесса С=СV , , а уравнение (9-32) можно переписать в виде: . При , следовательно, уравнение (9-32) переходит в уравнение изохоры: V= const.
Формула Майера — это… Что такое Формула Майера?
- Соотношение Майера — Для любого идеального газа справедливо соотношение Майера: , где универсальная газовая постоянная, молярная теплоёмкость при постоянном давлении, молярная теплоёмкость при постоянном объёме. Уравнение Майера вытекает из… … Википедия
- Фон Майер, Юлиус Роберт — В Википедии есть статьи о других людях с такой фамилией, см. Майер. Юлиус Роберт фон Майер нем. Julius Robert von Mayer … Википедия
- Фон Майер — Фон Майер, Юлиус Роберт В Википедии есть статьи о других людях с фамилией Майер. Роберт Майер Юлиус Роберт фон Майер (нем. Julius Robert von Mayer; … Википедия
- ОБЛИТЕРАЦИЯ — (лат. obliteratio уничтожение), термин, употребляемый для обозначений закрытия, уничтожения той или иной полости или просвета посредством разрастания^ ткани, идущего со стороны стенок данного полостного образования. Указанное разрастание чаще… … Большая медицинская энциклопедия
- Кинетическая теория газов — Сущность ее может быть выражена в немногих словах. Согласно этой теории, газы состоят из огромного числа отдельных весьма малых частиц, двигающихся по всем возможным направлениям и со всеми возможными скоростями; частицы эти связаны между собой… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
- Морфин — Эта статья о веществе; о лекарственном средстве см.: Морфин (лекарственное средство). Запрос «Морфий» перенаправляется сюда; см. также другие значения. Морфин … Википедия
- Газы — тела, характеризующиеся стремлением наполнять любое пространство и лишенные собственной формы. Учение о Г. представляет блестящую страницу современного естествознания. Казавшаяся некогда неуловимой форма тела, по понятиям древних занимавшего… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
- Газы тела — характеризующиеся стремлением наполнять любое пространство и лишенные собственной формы. Учение о Г. представляет блестящую страницу современного естествознания. Казавшаяся некогда неуловимой форма тела, по понятиям древних занимавшего среднее… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
- ТЕРМОДИНАМИКА — раздел прикладной физики или теоретической теплотехники, в котором исследуется превращение движения в теплоту и наоборот. В термодинамике рассматриваются не только вопросы распространения теплоты, но и физические и химические изменения, связанные … Энциклопедия Кольера
- Чемпионат мира по футболу — англ. FIFA World Cup … Википедия
Книги, учебные пособия, диссертации Майера Р.В. — ФИЗИКА И ИНФОРМАТИКА
Майер Р.В. Как стать компьютерным гением или книга о информационных системах и технологиях / Р.В.Майер. — Глазов: ГГПИ, 2008. — 204 c.
В доступной форме излагаются основные принципы работы современных информационных систем и сущность информационно—коммуникационных технологий. рассматриваются основы аналоговой и цифровой электроники, принципы радио— и телевизионной связи, элементы теории информации и ее кодирования, теория алгоритмов. описываются различные физические эксперименты с персональным компьютером, методы программирования на языке qbasic и некоторые другие вопросы, касающиеся сбора, хранения, обработки и передачи информации. анализируются программы, написанные в средах borland pascal 7.0 и ms—dos qbasic 1.0. книга рассчитана на старших школьников и студентов, интересующихся информатикой и электроникой. файл *.djvu, объем 4,5 mбайт — скачать
Майер Р.В. Компьютерное моделирование физических явлений: Монография. / Р.В.Майер. — Глазов: ГГПИ, 2009. — 112 c.
В работе изложены основы численных методов решения дифференциальных уравнений и рассмотрены следующие вопросы компьютерной физики: моделирование систем с одной степенью свободы, моделирование колебательного движения, двумерное движение материальной точки и системы частиц, модель одномерной упругой среды, решение задач аналитической механики, хаос в детерминированных системах, расчет электрического и магнитного поля, решение задач геометрической оптики, моделирование явлений микромира, расчет течения жидкости, моделирование автоволновых процессов и т.д. Файл *.djvu, объем 3,2 MБайт — СКАЧАТЬ
Майер Р.В. ПСИХОЛОГИЯ ОБУЧЕНИЯ БЕЗ ОГОРЧЕНИЯ. КНИГА ДЛЯ НАЧИНАЮЩЕГО УЧИТЕЛЯ (112 с.)
Книга посвящена важной педагогической проблеме: как сделать так, чтобы обучение приносило радость, а не огорчение? В ней рассматриваются психологические аспекты процесса обучения, особенности восприятия, внимания и запоминания, анализируются проблемы развития логического мышления и формирования научных знаний, а также описываются различные методы обучения, приводятся примеры использования тех или иных методических приемов в работе учителя. Книга предназначена для студентов педагогических вузов и начинающих учителей. || ФАЙЛ DJVU 1,1 МБайт ||
Майер В.В., Майер Р.В. ЭЛЕКТРИЧЕСТВО: УЧЕБНЫЕ ИССЛЕДОВАНИЯ. — М.: Физматлит, 2007. — 232 с.
Представлен новый подход к проблеме формирования эмпирических знаний по физике. На основе анализа курса физик построена полная и логически непротиворечивая система физических доказательств по электричеству.
Разработана методика использования физических доказательств на уроке физики, предложены специальные задания и методы оценки уровня сформированности эмпирических знаний.
Книга предназначена для преподавателей, аспирантов и студентов физических факультетов педагогических вузов; она будет полезна также учителям физики средних общеобразовательных школ и учащимся классов углубленного изучения физики.
Майер Р.В Исследование процесса формирования эмпирических знаний по физике: Монография. — Глазов: ГГПИ, 1998. — 132 с.
Методологические аспекты проблемы формирования эмпирических знаний. — Системный анализ проблемы формирования эмпирических знаний и процесса их формирования у учащихся. — Качественная модель и основные этапы формирования эмпирических знаний. — Классификация фактов на основе экспертных оценок их дидактических характеристик. — Динамика поступления эмпирической информации при изучении физики в школе. — Математическое моделирование процесса формирования эмпирических знаний. — Поисковый педагогический эксперимент. — Методика проведения и результаты констатирующего эксперимента. Методика проведения и результаты обучающего эксперимента. || СКАЧАТЬ || ФАЙЛ DJVU
Майер Р.В. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ИНФОРМАТИКИ. ЗАДАЧИ И ПРОГРАММЫ НА ЯЗЫКЕ PASCAL (73 с.)
Учебное пособие включает в себя систему учебных задач по следующим темам курса «Теоретические основы информатики»: формула Шеннона, кодирование и декодирование, передача информации по каналу связи, автоматы и их модели, машина Поста, машина Тьюринга, алгорифмы Маркова, нейросети и персептроны, основы теории игр. Отличие от других пособий состоит в том, что большая часть рассматриваемых задач предполагает написание компьютерных программ на языке Pascal. Для преподавателей информатики и студентов вузов, изучающих информатику в качестве профильной дисциплины. (Файл *.pdf, объем 4,3 MБайт) СКАЧАТЬ
Майер Р.В. Расчет электрических цепей в системе MathCAD. — Глазов: ГГПИ, 2007. — 44 c
В краткой форме рассмотрены методы расчета различных электрических цепей с помощью пакета MathCAD.
Проанализированы цепи постоянного тока, переменного тока, трехфазные цепи, индуктивно связанные цепи, цепи с источниками периодической негармонической ЭДС, переходные и автоколебательные процессы, фильтры.
Пособие предназначено для преподавателей и студентов вузов. Файл *.djvu, объем 400 кБайт — СКАЧАТЬ
Майер Р.В. Решение физических задач с помощью пакета MathCAD / Р.В.Майер. — Глазов: ГГПИ, 2006. — 37 c.
В краткой форме рассмотрены некоторые способы решения физических задач с помощью математического пакета MathCAD.
Показаны методы рассчета электрических цепей постоянного тока, однофазных и трехфазных цепей переменного тока, колебательных систем, переходных процессов, способы разложения функций в ряд Фурье и проведения спектрального анализа.
Приведены примеры использования комплексных чисел, решения дифференциальных уравнений, построения графиков. Для студентов высших учебных заведений. Файл *.djvu, объем 400 кБайт. — СКАЧАТЬ
Майер В.В., Майер Р.В. Измерение скорости звука импульсным методом. Учебное пособие. — Глазов, 1991. — 53 c
Предложена серия электронно—цифровых приборов, предназначенных для измерения скорости звука импульсным методом.
Рассмотрены методы измерения малых промежутков времени с точностью до 10 мс, в течение которых звук проходит в воздухе расстояние 0,1 — 1 м. Приведены принципиальные схемы и чертежи печатных плат.
Описаны лабораторные работы по измерению скорости звука в твердых телах, проверке принципа Фкрма, изучению зависимости скорости звука в газе от температуры. Файл *.djvu, объем 450 кБайт. — СКАЧАТЬ
Майер Р.В. КИБЕРНЕТИЧЕСКАЯ ПЕДАГОГИКА: Имитационное моделирование процесса обучения (138 с.)
Монография посвящена проблеме исследования процесса обучения методами имитационного моделирования.
В ней процесс обучения рассмотрен с позиций информационно-кибернетического моделирования, проанализированы различные дискретные и непрерывные модели системы «ученик-учитель», получены графики, описывающие динамику изменения уровня знаний среднестатистического ученика, методом имитационного моделирования изучены различные ситуации, возникающие в процессе обучения. Рассмотрены варианты решения оптимизационной задачи обучения, проанализированы результаты. В книге приведены тексты более 30 программ на языке Pascal. БЕСПЛАТНО СКАЧАТЬ
Майер Р.В. ОСНОВЫ ЭЛЕКТРОНИКИ. КУРС ЛЕКЦИЙ. . . (79 с.)
В учебно-методическом пособии представлены лекции по электронике, читаемые автором в техническом вузе. В них рассмотрены основные элементы электронных цепей, принципы действия электронных устройств: усилителей, генераторов, фильтров, модуляторов.
Изложены принципы радио- и телевизионной связи, проанализирована работа телевизионных и радиопередатчиков и премников. Рассмотрены основы цифровой электроники, работа логических элементов, узлов ЭВМ, различных цифровых приборов.
Предназначено для студентов и преподавателей технических вузов. | СКАЧАТЬ PDF |
Майер Р.В., Кощеев Г.В. УЧЕБНЫЕ ЭКСПЕРИМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ ПО ЭЛЕКТРОТЕХНИКЕ И ЭЛЕКТРОНИКЕ (72 c.)
В учебном пособии предложены задания для проведения экспериментальных исследований по электротехнике и электронике на лабораторных занятиях.
Представлены следующие разделы: «Цепи постоянного тока», «Однофазные цепи переменного тока», «Трехфазные цепи», «Электрические измерения», «Электрические машины и трансформаторы», «Основы аналоговой электроники», «Основы цифровой электроники».
Предлагаемые задания исследовательского типа могут использоваться при изучении основ физики, электротехники и электроники в школе, техническом лицее и вузе. Предназначено для студентов и преподавателей вузов, учителей физики. || СКАЧАТЬ HTML|| | СКАЧАТЬ |
Майер Р.В. Проблема формирования системы эмпирических знаний по физике: Дисс. … докт. пед. наук. — С. Петербург., 1999. — 350 с.
В диссертации проанализировано современное состояние методики формирования у учащихся системы эмпирических знаний по физике, предложена математическая модель этого процесса, осуществлен контент-анализ школьных учебников физики, разработана концепция построения системы эмпирических знаний при изучении физики, рассмотрена методика экспериментального изучения ряда физических явлений, описаны результаты педагогического эксперимента. файл *.djvu, zip-архив, объем 2,3 mбайт — скачать|
Майер Р.В. МЕТОДИКА УЧЕБНОГО ФУНДАМЕНТАЛЬНОГО ЭКСПЕРИМЕНТА ПО ВОЛНОВОЙ ФИЗИКЕ: Дисс. … канд. пед. наук. — М., 1995. — 258 с.
Диссертация по методике преподавания физики, посвящена актуальной проблеме совершенствования учебного физического эксперимента по изучению волнового движения на примере звуковых волн.
Рассмотрена система учебных опытов, позволяющих экспериментально изучить различные явления волновой физики (отражение, интерференция, дисперсия, эффект Доплера и др.) и соответствующие им функциональные зависимости. Описаны результаты педагогического эксперимента, подтверждающие эффективность предложенной методики.
Майер Р.В. ЗАДАЧИ, АЛГОРИТМЫ, ПРОГРАММЫ
Персональная ЭВМ позволяет решать широкий круг задач из совершенно различных областей знания. В электронной книге «Задачи, алгоритмы, программы» рассмотрены некоторые возможности использования среды программирования MS DOS Qbasic 1.0, Borland Pascal 7.0 для анализа физических, биологических, информационных и других систем.
При этом проанализированы компьютерные модели различных физических явлений, способы решения дифференциальных уравнений, методы построения фракталов, моделирования машин Поста и Тьюринга и т.д.
Книга предназначена для учителей информатики, физики и математики, преподавателей и студентов вузов, а также всех, кто интересуется вопросами программирования.
Майер Р.В. ПРАКТИЧЕСКАЯ ЭЛЕКТРОНИКА: ОТ ТРАНЗИСТОРА ДО КИБЕР-НЕТИЧЕСКОЙ СИСТЕМЫ. — Глазов: ГГПИ, 2011.
Книга предназначена для преподавателей и учителей, руководящих учебными исследованиями школьников и студентов. В ней рассмотрено около 50 простых схем, позволяющих изучить основы электроники на практическом уровне.
Некоторые темы: опыты с электромагнитным реле; выпрямители, блоки питания; транзисторы, тиристоры; термореле и фотореле; усилители электрических колебаний; генераторы электрических колебаний; компаратор и опыты с ним; источники высокого напряжения; простые опыты с микросхемой К155ЛА3; счетчик импульсов; экспериментируем с компьютером; подключение датчиков к ПЭВМ; цифро-аналоговое и аналого-цифровое преобразование сигнала; управление внешним устройством с помощью ПЭВМ; замкнутые оптические САУ; замкнутые электронно-механические САУ.
Уравнение состояния реальных газов
Для решения практических задач необходима наглядность физических свойств газов и рабочих тел.
Уравнение состояния нельзя найти термодинамическим методом. Его получают экспериментально, либо путем введения поправочных коэффициентов уравнения состояния идеального газа.
- Основные отличия реальных газов от идеального объясняются:
- Наличием сил притяжения и отталкивания между молекулами;
- Молекулы реальных газов занимают некоторый объем.
- Данные факторы имеют все большее значение с повышением плотности газов.
Первая поправка учитывает силы притяжения, действующие в направлении действия внешнего давления. Увеличиваем его на добавочное давление ?p, называемое внутренним.
Вторая поправка учитывает объем, недоступный для движения молекул.
В — объем газа, учитывающий «недоступный объем», т.к. в связи с наличием сил отталкивания молекул не могут быть доведены до соприкосновения.
Эти поправки учитываются в уравнении Ван-дер-Ваальса
?, В- зависят от природы газа. Погрешность данного уравнения возрастает с увеличением плотности (?)
Уравнение Майера — Боголюбова
В 1937 году ученый Майер и русский ученый Боголюбов получили уравнение, которое более точно описывало уравнение идеального газа.
Уравнение Майера — Боголюбова
Сn — вириальные коэффициенты, которые являются функцией температуры.
Уравнение позволяет более точно описать состояние газов при высоких температурах или при очень низких температурах.
Фазовые равновесия. Фазовые температуры.
Переход вещества из одной фазы в другую называется фазовым переходом. Если однофазовая система пришла в равновесие, то температура и давление во всех частях системы одинаковы.
Для многофазной системы верно: если одна фаза (и более) находится в равновесии, то температура, давление и химические потенциалы равны во всех частях системы.
В зависимости от давления и температуры вещество может находиться в различных агрегатных состояниях (твердое, жидкое, газ, плазма).
Правило фаз Гиббса
Оно устанавливается для термодинамической системы, находящейся в равновесии и имеющей несколько компонентов и несколько фаз:
- ? — число степеней свободы;
- n — число компонентов;
- r — число фаз в системе.
- Для однокомпонентной системы, находящейся в одном фазовом состоянии:
?=2, т.е. число независимых параметров равно двум.
· Для двухфазной системы (кипящая вода с паром) число степеней свободы равно единице (?=1, при n=1, r=2).
· Для трехфазной системы (тройная точка воды), когда в равновесии находится жидкая, твердая и газообразная фаза воды (?=0, при n=1, r=3).
Отсюда следует, что вещества могут находиться в равновесии только при постоянных и конкретных значениях температуры и давления, причем индивидуально для каждого вещества.
Большая Рнциклопедия Нефти Рё Газа
Боголюбова-Майера Рё алгебраическая комбинация индексов / Рі -; ПЛЖР�ДК — для вычисления плотности насыщенной жидкости РїРѕ температуре насыщения РёР· уравнения (1.83); Р РќРђРЎ — для вычисления давления насыщенного пара РїРѕ температуре насыщения. [1]
Уравнение Боголюбова-Майера представляет собой наиболее общую форму уравнения состояния с вириальными коэффициентами и имеет теоретическое обоснование.
Вследствие этого РѕРЅРѕ признано сейчас основным уравнением состояния, что значительно облегчает программирование Рё выполнение расчетов РЅР° РР’Рњ, так как переход РѕС‚ РѕРґРЅРѕРіРѕ рабочего вещества Рє РґСЂСѓРіРѕРјСѓ осуществляется без изменения алгоритма простой заменой РѕРґРЅРѕРіРѕ массива коэффициентов аппроксимации РЅР° РґСЂСѓРіРѕР№. [2]
Уравнение Боголюбова-Майера (1.50) разрешено в явном виде только относительно давления и коэффициента сжимаемости. [3]
Битти-Бриджмена РІ форме, полученной для уравнения Боголюбова-Майера. Рто существенно облегчает выполнение расчетов, особенно РїСЂРё использовании готовых программ для РР’Рњ. [4]
Достоинствами уравнения Битти-Бриджмена являются возможность его представления РІ форме Боголюбова-Майера Рё наличие простой Рё СѓРґРѕР±РЅРѕР№ методики комбинирования коэффициентов РїСЂРё расчете смесей. Коэффициенты Рє уравнению Битти-Бридж — мена более чем Р·Р° 50 лет его существования получены для очень РјРЅРѕРіРёС… газов, что расширяет возможности его применения. [5]
Уравнения БВРи Стерлинга также РјРѕРіСѓС‚ быть представлены РІ форме Боголюбова-Майера, однако РѕРЅРё имеют остаточный член, содержащий экспоненту. Рто сопряжено СЃ изменением программы расчетов, так как необходимо вводить соответствующие поправки РІ алгоритм. [6]
Первое — теоретическое обоснование модели РЅР° РѕСЃРЅРѕРІРµ молекулярно-кинетической теории Рё статистической механики — — уравнения идеального газа, Ван-дер — Ваальса, Боголюбова-Майера Рё РґСЂ. Р’ конечном счете это позволило качественно получить модель РІРѕРґСЏРЅРѕРіРѕ пара Рё РґСЂСѓРіРёС… газов, например для описания свойств пара РІ критической Рё околокритической области. Для количественного описания модели рабочего вещества этот РїРѕРґС…РѕРґ применим РІ частных случаях. [7]
Применение каждого из уравнений определяется характером поставленной задачи и требуемой точностью расчетов.
РџСЂРё расчете процессов сжатия перегретого пара РїСЂРё средних Рё малых давлениях Рё плотностях, РЅРµ превышающих критической плотности, инженерная точность вполне может быть обеспечена СЃ помощью уравнений Битти-Бриджмена, Старлинга, БВР. Существенным преимуществом зтих уравнений является возможность расчета параметров смесей реальных газов, которые часто являются рабочими веществами компрессоров РІ химическом Рё нефтехимическом производствах. Если необходима высокая точность расчетов, то применяют уравнения Боголюбова-Майера, Клецкого Рё РґСЂ. Отметим, что РїРѕ существу почти РІСЃРµ известные уравнения состояния являются математическими аппроксимациями двумерных термодинамических поверхностей, описывающих термические свойства реальных газов. Поэтому точность СЂ — v — Р“ — зависимостей определяется главным образом степенью полинома, который РІС…РѕРґРёС‚ РІ уравнение состояния. Так, уравнение Битти-Бриджмена является уравнением третьей степени РїРѕ температуре Рё плотности, уравнение БВР— пятой степени РїРѕ плотности Рё третьей степени РїРѕ температуре, уравнение Старлинга — пятой степени Рё РїРѕ плотности Рё РїРѕ температуре. Р’ некоторых случаях таких значений степени недостаточно для получений нужной точности, тогда принимают уравнение Боголюбова-Майера, которое теоретически представляет СЃРѕР±РѕР№ бесконечный СЂСЏРґ РїРѕ степеням температуры Рё плотности. Однако РЅР° практике даже для прецизионного описания термических свойств редко приходится применять степени выше РІРѕСЃСЊРјРѕР№. [8]
Применение каждого из уравнений определяется характером поставленной задачи и требуемой точностью расчетов.
РџСЂРё расчете процессов сжатия перегретого пара РїСЂРё средних Рё малых давлениях Рё плотностях, РЅРµ превышающих критической плотности, инженерная точность вполне может быть обеспечена СЃ помощью уравнений Битти-Бриджмена, Старлинга, БВР. Существенным преимуществом зтих уравнений является возможность расчета параметров смесей реальных газов, которые часто являются рабочими веществами компрессоров РІ химическом Рё нефтехимическом производствах. Если необходима высокая точность расчетов, то применяют уравнения Боголюбова-Майера, Клецкого Рё РґСЂ. Отметим, что РїРѕ существу почти РІСЃРµ известные уравнения состояния являются математическими аппроксимациями двумерных термодинамических поверхностей, описывающих термические свойства реальных газов. Поэтому точность СЂ — v — Р“ — зависимостей определяется главным образом степенью полинома, который РІС…РѕРґРёС‚ РІ уравнение состояния. Так, уравнение Битти-Бриджмена является уравнением третьей степени РїРѕ температуре Рё плотности, уравнение БВР— пятой степени РїРѕ плотности Рё третьей степени РїРѕ температуре, уравнение Старлинга — пятой степени Рё РїРѕ плотности Рё РїРѕ температуре. Р’ некоторых случаях таких значений степени недостаточно для получений нужной точности, тогда принимают уравнение Боголюбова-Майера, которое теоретически представляет СЃРѕР±РѕР№ бесконечный СЂСЏРґ РїРѕ степеням температуры Рё плотности. Однако РЅР° практике даже для прецизионного описания термических свойств редко приходится применять степени выше РІРѕСЃСЊРјРѕР№. [9]
http://helpiks.org/3-19531.html
http://school16rostov.ru/ekonomicheskie/uravnenie-majera-spravochnik-studenta.html







