Уравнение Майера. Сравнение между собой Ср и СV приводит к уравнению Майера:
Сравнение между собой Ср и СV приводит к уравнению Майера:
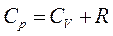
Это уравнение показывает, что Ср больше, чем СV на величину универсальной газовой постоянной R. Это объясняется тем, что при изобарном нагревании газа, в отличие от изохорного нагревания, требуется дополнительное количество теплоты на совершение работы расширения газа.
Таким образом, молярная теплоемкость газа определяется лишь числом степеней свободы и не зависит от температуры. Это утверждение справедливо в довольно широком интервале температур лишь для одноатомных газов.Уже у двухатомных газов число степеней свободы, проявляющееся в теплоемкости, зависит от температуры.
Дата добавления: 2015-10-05 ; просмотров: 852 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Уравнение майера связывает между собой
| Теплоёмкость идеального газа. Уравнение Майера |   |
Теплоёмкость тела характеризуется количеством теплоты, необходимой для нагревания этого тела на один градус:
Однако, теплоёмкость – величина неопределённая, поэтому пользуются понятиями удельной и молярной теплоёмкости. Удельная теплоёмкость (Суд) есть количество теплоты, необходимое для нагревания единицы массы вещества на 1 градус [Cуд] = Дж/К. Для газов удобно пользоваться молярной теплоемкостью Cμ— количество теплоты, необходимое для нагревания 1 моля газа на 1 градус:
Из п. 1.2 известно, что молярная масса – масса одного моля:
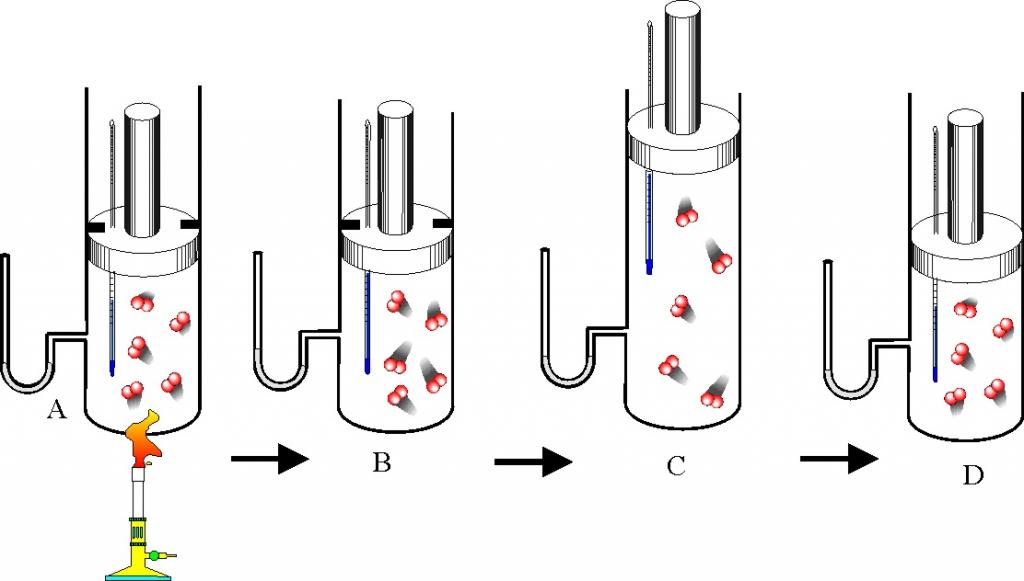
Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при нагревании. Если газ нагревать при постоянном объёме, то всё подводимое тепло идёт на нагревание газа, то есть изменение его внутренней энергии. Теплоёмкость при этом обозначается СV. СР – теплоемкость при постоянном давлении. Если нагревать газ при постоянном давлении Р в сосуде с поршнем, то поршень поднимется на некоторую высоту h, то есть газ совершит работу (рис. 4.2). Итак, проводимое тепло и теплоёмкость зависят от того, каким путём осуществляется передача тепла. Значит, Q и С не являются функциями состояния. Величины СР и СV оказываются связанными простыми соотношениями. Найдём их. Пусть мы нагреваем один моль идеального газа при постоянном объёме(dA = 0). Тогда первое начало термодинамики запишем в виде:
Теплоемкость при постоянном объёме будет равна:
Из (4.2.4) следует, что
Для произвольной идеальной массы газа:
При изобарическом процессе, кроме увеличения внутренней энергии, происходит совершение работы газом:
Из этого следует, что физический смысл универсальной газовой постоянной в том, что R – численно равна работе, совершаемой одним молем газа при нагревании на один градус в изобарическом процессе. Используя это соотношение, Роберт Майер в 1842 г. вычислил механический эквивалент теплоты: 1 кал = 4,19 Дж. Полезно знать формулу Майера для удельных теплоёмкостей: Формула Майера для теплоемкостей идеального газа, пример задачиМногие газы в физике принято описывать в рамках идеальной модели, с помощью которой можно легко определить основные термодинамические характеристики системы. В данной статье приведем вывод формулы Майера для газа идеального и покажем, как ее можно использовать для решения задачи. Идеальный газ и его уравнениеЧтобы понять вывод формулы Майера, следует ближе познакомиться с моделью идеального газа. Согласно ей, термодинамическая система представляет собой совокупность частиц, которые не обладают размерами (являются материальными точками). Их кинетическая энергия является единственной компонентой внутренней энергии системы (потенциальная энергия взаимодействий равна нулю), и скорости частиц подчиняются классическому распределению Максвелла-Больцмана. Описанная модель хорошо подходит для многих реальных газообразных систем, состоящих из химически инертных атомов и молекул, и имеющих невысокие давления и температуры в несколько сотен кельвин. Идеальный газ описывается универсальным выражением, которое называется законом Клапейрона-Менделеева. Оно приведено ниже: Здесь P, V, T — три термодинамических величины: давление, объем и температура. Параметры n и R — это количество вещества в системе и постоянная для всех газов, соответственно. Внутренняя энергия и изохорный процессСогласно определению, внутренняя энергия U произвольной системы равна сумме потенциальной и кинетической энергий ее элементов. Выше отмечалось, что в идеальной модели газовые молекулы и атомы друг с другом не взаимодействуют, это означает, что внутренняя энергия определяется исключительно кинетической составляющей. Из кинетической теории газов следует равенство, связывающее среднюю кинетическую энергию частицы с абсолютной температурой в системе: Где m — масса одной частицы, kB — Больцмана константа, v — скорость средняя квадратичная, z — число степеней свободы. Если обе части равенства умножить на количество N частиц в системе, то мы получим выражение для внутренней энергии U: При записи этого выражения мы воспользовались следующими равенствами: Теперь рассмотрим вопрос определения внутренней энергии газа с точки зрения термодинамики. Обратимся к изохорному процессу. В результате него все подводимое тепло идет на нагрев системы, поскольку объем остается постоянный, и работа газа равна нулю, то есть: В свою очередь, изменение величины U можно записать так: Где CV — теплоемкость системы при постоянном объеме. Эта величина показывает, сколько энергии в джоулях необходимо затратить, чтобы нагреть систему на 1 Кельвин. Сравнивая это выражение с формулой для U, которая получена из кинетической теории, приходим к равенству: Вместо теплоемкости CV часто пользуются молярной изохорной теплоемкостью, то есть той же величиной, только для 1 моля газа: Формула Майера для теплоемкостейЧтобы получить названную формулу, следует рассмотреть с точки зрения термодинамики изобарный процесс. Под ним понимают переход системы между двумя равновесными состояниями, при котором давление не изменяется. Предположим, что в рассматриваемой системе содержится 1 моль газа, тогда первое начало термодинамики для изобарного процесса примет вид: Теперь введем понятие об изобарной теплоемкости CP. Под ней понимают количество теплоты, которое следует системе сообщить, чтобы она нагрелась на 1 Кельвин, а ее давление при этом не изменилось. Это определение позволяет переписать равенство выше в виде: Если вспомнить уравнение для 1 моля идеального газа и выражение для изменения внутренней энергии, то это равенство запишется так: Это выражение называется формулой Майера для идеального газа. Оно показывает, что изобарная теплоемкость всегда больше изохорной на величину газовой постоянной для 1 моля газа. Значение же газовой постоянной R также приобретает конкретный физический смысл — это работа, которую совершает один моль газа во время его изобарного расширения при нагреве на один Кельвин. Задача на определение теплоемкостей воздухаНеобходимо вычислить молярные теплоемкости CP и CV для воздуха, полагая его идеальным газом. Решить эту задачу несложно, если вспомнить, что изохорная молярная теплоемкость равна: Тогда в соответствии с формулой Майера молярная величина CP будет равна: Поскольку воздух на 99% образован двухатомными молекулами O2 и N2, то z для него равно 5. Подставляя это значение, а также значение R=8,314 Дж/(К*моль) в формулы, получаем ответы на задачу: CV = 20,8 Дж/(К*моль), CP = 29,1 Дж/(К*моль). источники: http://ens.tpu.ru/POSOBIE_FIS_KUSN/%D0%9C%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%B0%D1%8F%20%D1%84%D0%B8%D0%B7%D0%B8%D0%BA%D0%B0.%20%D0%A2%D0%B5%D1%80%D0%BC%D0%BE%D0%B4%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%BA%D0%B0/04-2.htm http://fb.ru/article/461461/formula-mayera-dlya-teploemkostey-idealnogo-gaza-primer-zadachi |




 ,
, ,
, ,
,
 ,
, ,
, ,
, .
. .
. .
.