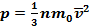Давление газа.Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона).Изопроцессы

Идеальный газ – это модель реального газа. За идеальный газ принимают газ в сосуде, когда молекула, пролетая от стенки до стенки сосуда не испытывает столкновения с другими молекулами. Точнее, Идеальный газ – это газ, взаимодействие между молекулами которого пренебрежимо мало ⇒ Eк >> Eр .
Основное уравнение МКТ связывает макроскопические параметры (давление p, объём V, температура T, масса m) газовой системы с микроскопическими параметрами (масса молекулы , средняя скорость их движения):
, где n— концентрация, 1/м 3 ; m — масса молекулы, кг; 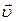
Уравнение состояния идеального газа — формула, устанавливающая зависимость между давлением , объёмом и абсолютной температурой идеального газа, характеризующее состояние данной системы газа. 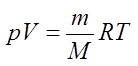
Часто необходимо исследовать ситуацию, когда меняется состояние газа при его неизменном количестве (m=const) и в отсутствие химических реакций (M=const). Это означает, что количество вещества ν=const. Тогда:
Для постоянной массы идеального газа отношение произведения давления на объем к абсолютной температуре в данном состоянии есть величина постоянная: 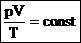
Термодинамический процесс (или просто процесс) — это изменение состояния газа с течением времени. В ходе термодинамического процесса меняются значения макроскопических параметров — давления, объёма и температуры. Особый интерес представляют изопроцессы — термодинамические процессы, в которых значение одного из макроскопических параметров остаётся неизменным. Поочерёдно фиксируя каждый из трёх параметров, мы получим три вида изопроцессов.
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака. Эти законы называют законами для изопроцессов:
Изопроцессы – это процессы, которые совершаются при одинаковом параметре или Т-температуре, или V-объеме, или р-давлении.
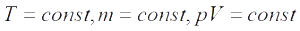
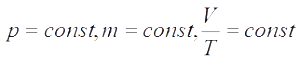
Изохорный п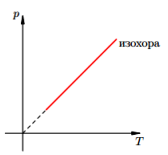
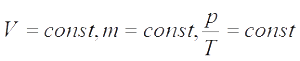
Вывели газовые законы из уравнения Менделеева — Клапейрона. Но исторически всё было наоборот: газовые законы были установлены экспериментально, и намного раньше. Уравнение состояния появилось впоследствии как их обобщение.
Лекция «Уравнение Менделеева-Клапейрона. Газовые законы. Изопроцессы.»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Уравнение Менделеева-Клапейрона. Газовые законы. Изопроцессы
Молекулы в идеальном газе движутся хаотически. Движение одной молекулы характеризуют микроскопические параметры (масса молекулы, ее скорость, импульс, кинетическая энергия). Свойства газа как целого описываются с помощью макроскопических параметров (масса газа, давление, объем, температура). Молекулярно-кинетическая теория устанавливает взаимосвязь между микроскопическими и макроскопическими параметрами.
Число молекул в идеальном газе столь велико, что закономерности их поведения можно выяснить только с помощью статистического метода. Равномерное распределение в пространстве молекул идеального газа является наиболее вероятным состоянием газа, т. е. наиболее часто встречающимся.
Распределение молекул идеального газа по скоростям при определенной температуре является статистической закономерностью.
Наиболее вероятная скорость молекул — скорость, которой обладает максимальное число молекул. Стационарное равновесное состояние газа — состояние, в котором число молекул в заданном интервале скоростей остается постоянным.
Температура тела — мера средней кинетической энергии поступательного движения его молекул:
где черта сверху — знак усреднения по скоростям, k = 1,38 • 10 -23 Дж/К — постоянная Больцмана.
Единица термодинамической температуры — кельвин (К).
При абсолютном нуле температуры средняя кинетическая энергия молекул равна нулю.
Средняя квадратичная (тепловая) скорость молекул газа
где М — молярная масса, R = 8,31 Дж/(К • моль) — молярная газовая постоянная.
Давление газа — следствие ударов движущихся молекул:
где n — концентрация молекул (число молекул в единице объема), E k — средняя кинетическая энергия молекулы.
Давление газа пропорционально его температуре :
Постоянная Лошмидта — концентрация идеального газа при нормальных условиях (атмосферное давление р= 1,01 • 10 5 Па и температура Т = 273 К):
Уравнение Клапейрона—Менделеева — уравнение состояния идеального газа, связывающее три макроскопических параметра (давление, объем, температуру) данной массы газа.
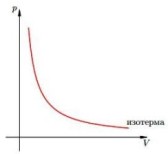
Изопроцесс — процесс, при котором один из макроскопических параметров состояния данной массы газа остается постоянным. Изотермический процесс — процесс изменения состояния определенной массы газа при постоянной температуре.
Закон Бойля—Мариотта : для газа данной массы при постоянной температуре:
где р 1 , р 2 , V 1 , V 2 — давление и объем газа в начальном и конечном состояниях
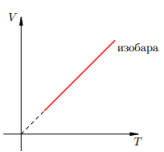
Изотерма — график изменения макроскопических параметров газа при изотермическом процессе. Изобарный процесс — процесс изменения состояния определенной массы газа при постоянном давлении.
Закон Гей-Люссака : для газа данной массы при постоянном давлении
где V 1 , V 2 , T 1 , Т 2 — объем и температура газа в начальном и конечном состояниях.
Изобара — график изменения макроскопических параметров газа при изобарном процессе.
Изохорный процесс — процесс изменения состояния определенной массы газа при постоянном объеме. Закон Шарля: для газа данной массы при постоянном объеме
где p 1 , р 2 , T 1 , Т 2 — давление и температура газа в начальном и конечном состояниях.
Изохора — график изменения макроскопических параметров газа при изохорном процессе.
Уравнение состояния идеального газа. Изопроцессы
Соотношение p = n k T – это формула, связывающая значение давления газа с его температурой и концентрацией молекул на единицу объема.
Они взаимодействуют со стенками сосуда посредствам упругих соударений. Данное выражение можно записать иначе, учитывая параметрические состояния объема V , давления p , температуры T и количества вещества ν . Применим неравенства:
n = N V = ν N А V = m M N A V .
Значением N является количество молекул данного сосуда, N А – постоянной Авогадро, m – массой газа в емкости, М – молярной массой газа. Исходя из этого, формула примет вид:
p V = ν N А k T = m M N А k T .
Произведение постоянной Авогадро N А на постоянную Больцмана k называют универсальной газовой постоянной и обозначают R .
По системе С И имеет значение R = 8 , 31 Д ж / м о л ь · К .
Соотношение p V = ν R T = m M R T получило название уравнения состояния идеального газа.
Один моль газа обозначается p V = R T .
При температуре T н = 273 , 15 К ( 0 ° C ) и давлении ρ н = 1 а т м = 1 , 013 · 10 5 П а говорят о нормальных условиях состояния газа.
Из уравнения видно, что один моль газа при нормальных условиях занимает один и тот же объем, равный v 0 = 0 , 0224 м 3 / м о л ь = 22 , 4 д м 3 / м о л ь . Выражение получило название закона Авогадро.
Если имеется смесь невзаимодействующих газов, то формулу запишем как:
p V = ν 1 + ν 2 + ν 3 + . . . R T ,
где ν 1 , v 2 , v 3 обозначает количество вещества каждого из них.
Еще в ХХ веке Б. Клапейрон получил уравнение, показывающее связь между давлением и температурой:
p V = ν R T = m M R T .
Впоследствии оно было записано Д.И. Менделеевым. Позже его назвали уравнением Клапейрона-Менделеева.
Задолго до получения уравнения состояния идеального газа на основе молекулярно-кинетической теории поведения газов изучались в различных условиях экспериментально. То есть уравнение p V = ν R T = m M R T служит обобщением всех опытных фактов.
Газ принимает участие в процессах с постоянно изменяющимися параметрами состояния: ( p , V и T ).
При протекании процессов медленно, система находится в состоянии, близком к равновесному. Процесс получил название квазистатического.
Соотнеся с происхождением процессов в нашем времени, то его протекания нельзя считать медленными.
Обычное время для разрежения и сжатия газа сотни раз в секунду. Это рассматривается как квазистатический процесс. Они изображаются с помощью диаграммы состояний параметров, где каждая из точек показывает равновесное состояние.
При неизменном одном параметре из ( p , V или T ) процесс принято называть изопроцессом.
http://infourok.ru/lekciya-uravnenie-mendeleevaklapeyrona-gazovie-zakoni-izoprocessi-3226099.html
http://zaochnik.com/spravochnik/fizika/molekuljarno-kineticheskaja-teorija/uravnenie-sostojanija-idealnogo-gaza-izoprotsessy/