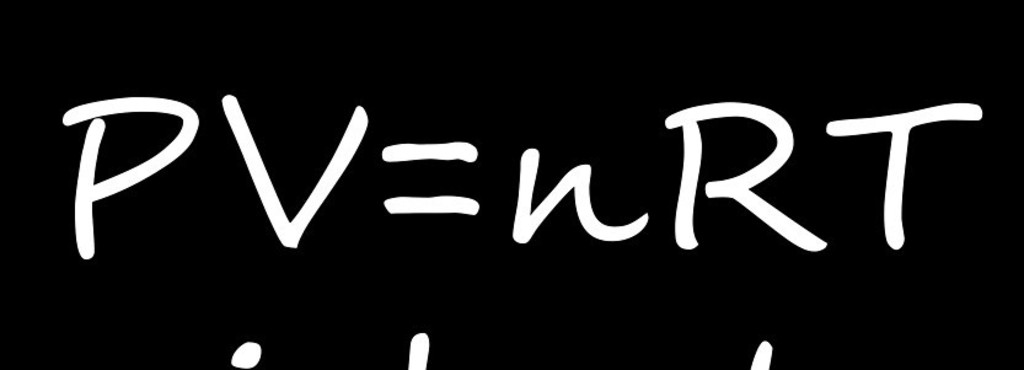Уравнение менделеева клапейрона количество вещества
Уравнение Менделеева-Клапейрона — уравнение состояния для идеального газа, отнесенное к 1 молю газа. В 1874 г. Д. И. Менделеев на основе уравнения Клапейрона объединив его с законом Авогадро, используя молярный объем Vm и отнеся его к 1 молю, вывел уравнение состояния для 1 моля идеального газа:
pV = RT , где R — универсальная газовая постоянная,
R = 8,31 Дж/(моль . К)
Уравнение Клапейрона-Менделеева показывает, что для данной массы газа возможно одновременно изменение трех параметров, характеризующих состояние идеального газа. Для произвольной массы газа М, молярная масса которого m: pV = (М/m) . RT. или pV = NАkT,
где NА — число Авогадро, k — постоянная Больцмана.
С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса газа и один из параметров — давление, объем или температура — остается постоянным, а изменяются только остальные два и получить теоретически газовые законы для этих условий изменения состояния газа.
Такие процессы называют изопроцессами. Законы, описывающие изопроцессы, были открыты задолго до теоретического вывода уравнения состояния идеального газа.
Изотермический процесс — процесс изменения состояния системы при постоянной температуре. Для данной массы газа произведение давления газа на его объем постоянно, если температура газа не меняется. Это закон Бойля — Мариотта.
Для того, чтобы температура газа оставалась в процессе неизменной, необходимо, чтобы газ мог обмениваться теплотой с внешней большой системой — термостатом. Роль термостата может играть внешняя среда (воздух атмосферы). Согласно закону Бойля-Мариотта, давление газа обратно пропорционально его объему: P1V1=P2V2=const. Графическая зависимость давления газа от объема изображается в виде кривой (гиперболы), которая носит название изотермы. Разным температурам соответствуют разные изотермы.
Изобарный процесс — процесс изменения состояния системы при постоянном давлении. Для газа данной массы отношение объема газа к его температуре остается постоянным, если давление газа не меняется. Это закон Гей-Люссака. Согласно закону Гей-Люссака, объем газа прямо пропорционален его температуре: V/T=const. Графически эта зависимость в координатах V-T изображается в виде прямой, выходящей из точки Т=0. Эту прямую называют изобарой. Разным давлениям соответствуют разные изобары. Закон Гей-Люссака не соблюдается в области низких температур, близких к температуре сжижения (конденсации) газов.
Изохорный процесс — процесс изменения состояния системы при постоянном объеме. Для данной массы газа отношение давления газа к его температуре остается постоянным, если объем газа не меняется. Этот газовый закон Шарля. Согласно закону Шарля, давление газа прямо пропорционально его температуре: P/T=const. Графически эта зависимость в координатах P-Т изображается в виде прямой, выходящей из точки Т=0. Эту прямую называют изохорой. Разным объемам соответствуют разные изохоры. Закон Шарля не соблюдается в области низких температур, близких и температуре сжижения (конденсации) газов.
Итак, из закона pV = (М/m) . RT выводятся следующие законы:
p = const => V/T = const — закон Гей — Люссака .
V= const => p/T = const — закон Шарля
Если идеальный газ является смесью нескольких газов, то согласно закону Дальтона, давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов. Парциальное давление — это такое давление, которое производил бы газ, если бы он один занимал весь объем, равный объему смеси.
Некоторых, возможно, интересует вопрос, каким образом удалось определить постоянную Авогадро NA = 6,02·10 23 ? Значение числа Авогадро было экспериментально установлено только в конце XIX – начале XX века. Опишем один из таких экспериментов.
В откачанный до глубокого вакуума сосуд объемом V = 30 мл поместили навеску элемента радия массой 0,5 г и выдержали там в течение одного года. Было известно, что за секунду 1 г радия испускает 3,7·10 10 альфа-частиц. Эти частицы представляют собой ядра гелия, которые тут же принимают электроны из стенок сосуда и превращаются в атомы гелия. За год давление в сосуде выросло до 7,95·10 -4 атм (при температуре 27 о С). Изменением массы радия за год можно пренебречь. Итак, чему равна NA?
Сначала найдем, сколько альфа-частиц (то есть атомов гелия) образовалось за один год. Обозначим это число как N атомов:
N = 3,7·10 10 · 0,5 г · 60 сек · 60 мин · 24 час · 365 дней = 5,83·10 17 атомов.
Запишем уравнение Клапейрона-Менделеева PV = nRT и заметим, что число молей гелия n = N/NA. Отсюда:
NA = NRT = 5,83 . 10 17 . 0,0821 . 300 = 6,02 . 10 23
PV 7,95 . 10 -4 . 3 . 10 -2
В начале XX века этот способ определения постоянной Авогадро был самым точным. Но почему так долго (в течение года) длился эксперимент? Дело в том, что радий добывается очень трудно. При его малом количестве (0,5 г) радиоактивный распад этого элемента дает очень мало гелия. А чем меньше газа в замкнутом сосуде, тем меньшее он создаст давление и тем большей будет ошибка измерения. Понятно, что ощутимое количество гелия может образоваться из радия только за достаточно долгое время.
Уравнение Клапейрона-Менделеева. Связь между числом молей газа, его температурой, объемом и давлением.
Уравнение Клапейрона-Менделеева. Связь между числом молей газа, его температурой, объемом и давлением.
Калькулятор ниже предназначен для решения задач на использование уравнения Клапейрона-Менделеева, или уравнение состояния идеального газа. Некоторая теория изложена под калькулятором, ну а чтобы было понятно, о чем идет речь — пара примеров задач:
Примеры задач на уравнение Менделеева-Клапейрона
В колбе объемом 2,6 литра находится кислород при давлении 2,3 атмосфер и температуре 26 градусов Цельсия .
Вопрос: сколько молей кислорода содержится в колбе?
Вопрос: Каков объем этого газа при нормальных условиях? (Напомню, что нормальными условиями для газов считается давление в 1 атмосферу и температура 0 градусов Цельсия)
В калькулятор вводим начальные условия, выбираем, что считать (число моль, новые объем, температуру или давление), заполняем при необходимости оставшиеся условия, и получаем результат.
Уравнение Клапейрона-Менделеева. Связь между числом молей газа, его температурой, объемом и давлением.
Теперь немного формул.
где
P — давление газа (например, в атмосферах)
V — объем газа (в литрах);
T — температура газа (в кельвинах);
R — газовая постоянная (0,0821 л·атм/моль·K).
Если используется СИ, то газовая постоянная равна 8,314 Дж/K·моль
Так как m-масса газа в (кг) и M-молярная масса газа кг/моль, то m/M — число молей газа, и уравнение можно записать также
где n — число молей газа
И как нетрудно заметить, соотношение
есть величина постоянная для одного и того же количества моль газа.
И эту закономерность опытным путем установили еще до вывода уравнения. Это так называемые газовые законы — законы Бойля-Мариотта, Гей-Люссака, Шарля.
Так, закон Бойля-Мариотта гласит (это два человека):
Для данной массы газа m при неизменной температуре Т произведение давления на объем есть величина постоянная.
Закон Гей-Люссака (а вот это один человек):
Для данной массы m при постоянном давлении P объем газа линейно зависит от температуры
Закон Шарля:
Для данной массы m при постоянном объеме V давление газа линейно зависит от температуры
Посмотрев на уравнение, нетрудно убедиться в справедливости этих законов.
Уравнение Менделеева-Клапейрона, также как и опытные законы Бойля-Мариотта, Гей-Люссака и Шарля справедливы для широкого интервала давлений, объемов и температур. То есть во многих случаях эти законы удобны для практического применения. Однако не стоит забывать, что когда давления превышают атмосферное в 300-400 раз, или температуры очень высоки, наблюдаются отклонения от этих законов.
Собственно, идеальный газ потому и называют идеальным, что по определению это и есть газ, для которого не существует отклонений от этих законов.
Уравнение Менделеева Клапейрона: формулы для решения задач с газами
Сегодня мы рассмотри уравнение Уравнение Менделеева Клапейрона, которое используется для решения задач по термодинамике.
При решении термодинамических задач по физике, в которых возникают переходы между различными состояниями идеального газа, уравнение Менделеева-Клапейрона является важной опорной точкой. В данной статье рассмотрим, что это за уравнение и как им можно пользоваться при решении практических задач.
Газы реальные и идеальные
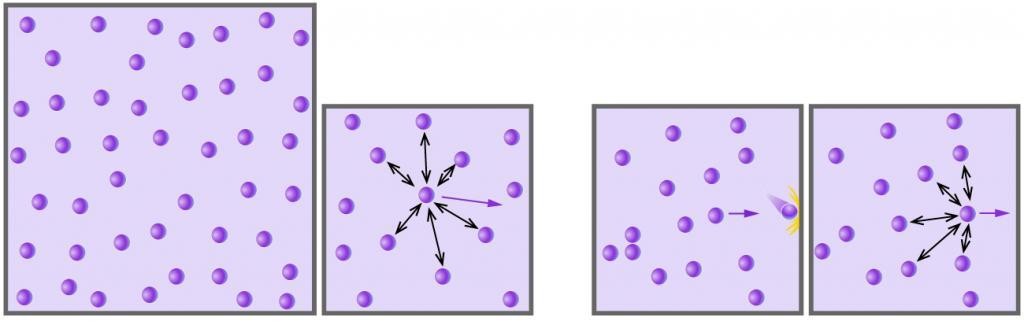
Газовое состояние материи представляет собой одно из существующих четырех агрегатных состояний вещества. Примерами чистых газов являются водород и кислород. Газы могут смешиваться друг с другом в произвольных пропорциях. Всем известный пример смеси — воздух. Названные газы являются реальными, однако при определенных условиях они могут считаться идеальными. Идеальным считается газ, который соответствует следующим характеристикам:
- Частицы, образующие его, не взаимодействуют друг с другом.
- Столкновения между отдельными частицами и между частицами и стенками сосудов носят абсолютно упругий характер, то есть количество движения и кинетическая энергия до и после столкновения сохраняется.
- Частицы не обладают объемом, но имеют некоторую массу.
Все реальные газы при температурах порядка и выше комнатной (больше 300 К) и при давлениях порядка и ниже одной атмосферы (10 5 Па) можно считать идеальными.
Описывающие состояние газа термодинамические величины
Под термодинамическими величинами понимают макроскопические физические характеристики, которые однозначно определяют состояние системы. Существует три базовых величины:
Температура отражает интенсивность движения атомов и молекул в газе, то есть она определяет кинетическую энергию частиц. Измеряется эта величина в Кельвинах. Для перевода из градусов Цельсия в Кельвины следует использовать равенство:
Объем — способность каждого реального тела или системы занимать часть пространства. Выражается в СИ в метрах кубических (м 3 ).
Давление — макроскопическая характеристика, которая в среднем описывает интенсивность столкновений частиц газа со стенками сосуда. Чем больше температура и выше концентрация частиц, тем больше будет давление. Выражается оно в паскалях (Па).
Далее будет показано, что уравнение Менделеева-Клапейрона в физике содержит еще один макроскопический параметр — количество вещества n. Под ним полагают число элементарных единиц (молекул, атомов), которое равно числу Авогадро (NA = 6,02 * 10 23 ). Выражается количество вещества в молях.
Уравнение состояния Менделеева-Клапейрона
Запишем сразу это уравнение, а затем объясним его значение. Это уравнение имеет следующий общий вид:
Произведение давления на объем идеального газа является пропорциональным произведению количества вещества в системе на абсолютную температуру. Коэффициент пропорциональности R называется универсальной газовой постоянной. Ее значение равно 8,314 Дж/(моль*К). Физический смысл величины R заключается в том, что она равна работе, которую совершает при расширении 1 моль газа в случае его нагрева на 1 К.
Записанное выражение также называется уравнением состояния идеального газа. Его важность состоит в том, что оно не зависит от химического типа частиц газа. Так, это могут быть молекулы кислорода, атомы гелия или вообще газовая воздушная смесь, для всех этих веществ будет справедливо рассматриваемое уравнение.
Оно может быть записано в других формах. Приведем их:
Здесь m — масса газа, ρ — его плотность, M — молярная масса, N — число частиц в системе, kB — постоянная Больцмана. В зависимости от условия задачи можно использовать любую форму записи уравнения.
Краткая история получения уравнения
Уравнение Клапейрона-Менделеева впервые было получено в 1834 году Эмилем Клапейроном в результате обобщения законов Бойля-Мариотта и Шарля-Гей-Люссака. При этом закон Бойля-Мариотта был известен уже во второй половине XVII века, а закон Шарля-Гей-Люссака впервые был опубликован в начале XIX века. Оба закона описывают поведение закрытой системы при фиксированном одном термодинамическом параметре (температуре или давлении).
Заслуга Д. Менделеева при записи современной формы уравнения идеального газа заключается в том, что он впервые заменил ряд констант одной единственной величиной R.
Отметим, что в настоящее время уравнение Клапейрона-Менделеева может быть получено теоретически, если рассмотреть систему с точки зрения статистической механики и применить положения молекулярно-кинетической теории.
Частные случаи уравнения состояния
Существует 4 частных закона, которые следуют из уравнения состояния идеального газа. Остановимся кратко на каждом из них.
Если в закрытой системе с газом поддерживать постоянную температуру, то любое увеличение в ней давления вызовет пропорциональное уменьшение объема. Этот факт может быть записан математически в таком виде:
Этот закон носит фамилии ученых Роберта Бойля и Эдма Мариотта. Графиком функции P(V) является гипербола.
Если в закрытой системе зафиксировать давление, то любое увеличение температуры в ней приведет к пропорциональному возрастанию объема, то есть:
Описанный этим уравнением процесс называется изобарным. Он носит фамилии французских ученых Шарля и Гей-Люссака.
Если в закрытой системе объем не меняется, то процесс перехода между состояниями системы называется изохорным. Во время него любое повышение давления приводит к аналогичному повышению температуры:
Это равенство получило название закона Гей-Люссака.
Графиками изобарного и изохорного процессов являются прямые линии.
Наконец, если зафиксировать макроскопические параметры (температуру и давление), тогда всякое увеличение количества вещества в системе приведет к пропорциональному возрастанию его объема:
Это равенство называется принципом Авогадро. Оно лежит в основе закона Дальтона для идеальных газовых смесей.
Решение задачи
Уравнение Менделеева-Клапейрона удобно использовать для решения различных практических задач. Приведем пример одной из них.
Кислород массой 0,3 кг находится в баллоне объемом 0,5 м 3 при температуре 300 К. Как изменится давление газа, если температуру увеличить до 400 К?
Полагая кислород в баллоне идеальным газом, воспользуемся уравнением состояния для вычисления начального давления, имеем:
P1 = m * R * T1 / (M * V) = 0,3 * 8,314 * 300 / (32 * 10 -3 * 0,5) = 46766,25 Па.
Теперь вычислим давление, при котором газ будет находиться в баллоне, если поднять температуру до 400 К, получаем:
P2 = m * R * T2 / (M * V) = 0,3 * 8,314 * 400 / (32 * 10 -3 * 0,5) = 62355 Па.
Изменение давления при нагреве составит:
Полученное значение ΔP соответствует 0,15 атмосферы.
http://planetcalc.ru/4265/
http://infosort.ru/shkolnoe-obrazovanie/285-uravnenie-mendeleeva-klapejrona-formulyi-dlya-resheniya-zadach-s-gazami