Презентация по физике 10 класс. Тема «Идеальный газ в МКТ. Основное уравнение МКТ»
презентация к уроку по физике (10 класс) по теме
Презентация по физике 10 класс. Тема «Идеальный газ в МКТ. Основное уравнение МКТ». Учебник физики Г. Я. Мякишев, Б.Б. Буховцев, Н.Н.Сотский
Скачать:
| Вложение | Размер |
|---|---|
| 4344_id.gaz_osn.ur-ie_mkt.pptx | 122.59 КБ |
Предварительный просмотр:
Подписи к слайдам:
43. Идеальный газ в МКТ. Среднее значение квадрата скорости. 44. Основное уравнение МКТ идеального газа. Df . Идеальный газ — это газ, взаимодействие между молекулами которого пренебрежимо мало. Идеальный газ- это модель реального газа. М олекулы этого газа- крошечные шарики, не взаимодействующие друг с другом. Сталкиваясь со стенкой, молекулы газа оказывают на нее давление.
-среднее значение квадрата скорости Основное уравнение МКТ идеального газа:
средняя кинетическая энергия поступательного движения молекулы
Давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы. концентрация — количество частиц в единице объема вещества.
Основное уравнение МКТ идеального газа:
По теме: методические разработки, презентации и конспекты
Конспект урока и презентация для 8 класса по теме: «Формулы корней квадратных уравнений»
Урок алгебры. Тема: «Формулы корней квадратных уравнений». Урок «открытия» детьми нового знания. Цели урока: Деятельностные: формирование способности к построению нового метода решения ква.
Конспект урока физики в 10 классе по теме: «Идеальный газ. Давление идеального газа. Основное уравнение МКТ»
Конспект урока физики в 10 классе по теме: «Идеальный газ. Давление идеального газа. Основное уравнение МКТ».
Информационная карта по физике. 10 класс. Идеальный газ. Основное уравнение молекулярно-кинетической теории.
Информационная карта по физике для 10 класса вечерней школы по теме: «Идеальный газ.Основное уравнение молекулярно-кинетической теории».
Урок физики : «Идеальный газ в молекулярно-кинетической теории. Основное уравнение молекулярно- кинетической теории газа.»
План-конспект урока физики «Идеальный газ в молекулярно-кинетической теории. Основное уравнение молекулярно- кинетической теории газа.».
Дидактический материал по физике: «Основное уравнение МКТ идеального газа. Температура»
Проверочная работа по физике по теме»Основное уравнение МКТ идеального газа. Температура» предназначена для учеников 10 классов, обучающихся на базовом уровне. Состоит из двух вариантов.
Урок физики в 10 классе «Основное уравнение МКТ»
План конспект урока физики в 10 классе по теме: «Основное уравнение МКТ".
Урок физики в 10 классе по теме «ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ»
Урок физики в 10 классе по теме «ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ".
Презентация к уроку физики 10 класса «Основы МКТ. Размеры и масса молекул. Количество вещества»
Презентация к первому уроку Молекулярной физики в 10 классе.Предусмотрена работа с учебником и тренировочные вопросы из заданий ЕГЭ базового уровня.
Просмотр содержимого документа
«Презентация к уроку физики 10 класса «Основы МКТ. Размеры и масса молекул. Количество вещества»»
«Не знаю, за кого меня принимает мир, но себе самому я казался лишь мальчиком, который играл на морском берегу, забавляясь тем, что время от времени ему попадались редкий камешек или ракушка красивей других, между тем как великий океан Истины лежал весь закрытый передо мной».
Вопросы на которые не отвечает механика
- Агрегатные состояния и фазовые переходы вещества.
- Природа и происхождение сил.
- Макроскопические тела – это тела, состоящие из очень большого числа частиц (атомов или молекул). Поведение большой совокупности частиц отличается от поведения каждой частицы в отдельности.
Нагревание и охлаждение, испарение и кипение, плавление и отвердевание, конденсация — все это примеры тепловых явлений.
ОПРЕДЕЛЕНИЕ ТЕПЛОВЫХ ЯВЛЕНИЙ
ОСОБЫЙ ВИД ДВИЖЕНИЯ МАТЕРИИ – ТЕПЛОВОЕ ДВИЖЕНИЕ
БЕСПОРЯДОЧНОЕ ДВИЖЕНИЕ МОЛЕКУЛ.
ЗНАЧЕНИЕ ТЕПЛОВЫХ ЯВЛЕНИЙ
учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химических веществ.
ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ
- 1. Все вещества состоят из частиц (молекул, атомов), разделенных промежутками.
— фотографии атомов и молекул, сделанные с помощью электронного микроскопа;
— возможность механического дробления вещества, растворение вещества в воде, диффузия, сжатие и расширение газов
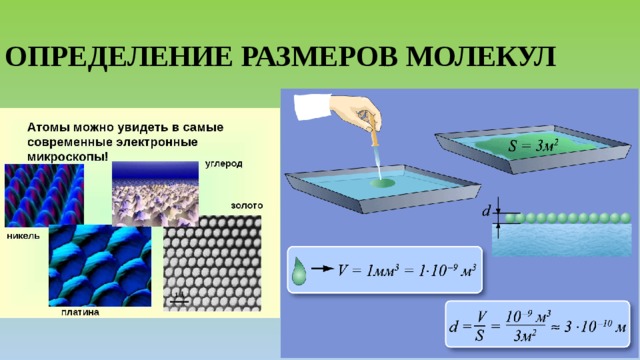
ОПРЕДЕЛЕНИЕ РАЗМЕРОВ МОЛЕКУЛ
ОЦЕНКА ЧИСЛА МОЛЕКУЛ
ОТНОСИТЕЛЬНАЯ МОЛЕКУЛЯРНАЯ (ИЛИ АТОМНАЯ) МАССА.
- Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов с учетом индексов.
- Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
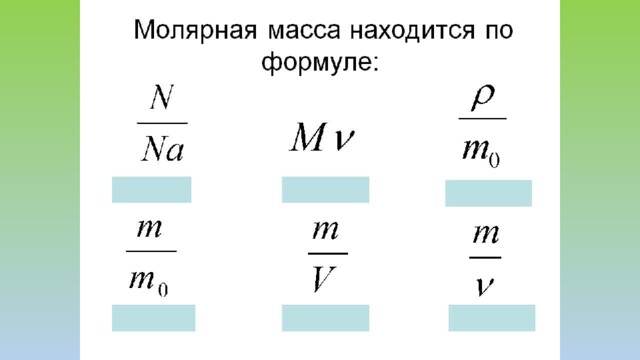
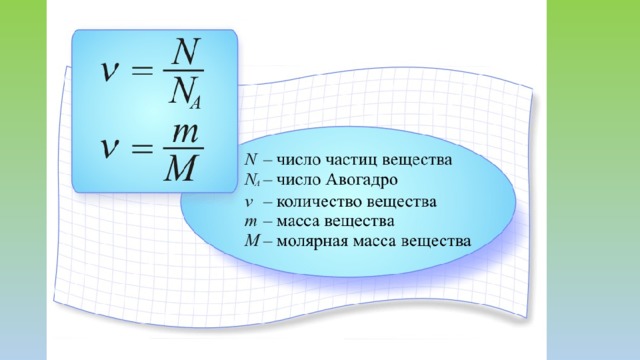
КОЛИЧЕСТВО ВЕЩЕСТВА И ПОСТОЯННАЯ АВОГАДРО
- Количество вещества v — величина, равная отношению числа молекул (атомов) N в данном теле к числу атомов в 0,012 кг изотопа углерода :
Моль — это такое количество вещества, которое содержит столько же атомов, молекул или других структурных элементов вещества, сколько атомов содержится в 0,012 кг углерода.
- Молярная масса – масса вещества, взятого в количестве 1 моль
ВТОРОЕ ПОЛОЖЕНИЕ МКТ
- Частицы всех веществ беспорядочно и хаотично движутся.
- Доказательства:
- диффузия – явление взаимного проникновения частиц одного вещества между частицами другого вещества вследствие их теплового движения.
- броуновское движение мелких, инородных, взвешенных в жидкости частиц под действием не скомпенсированных ударов молекул.
Работа с учебником Стр. 183
« Если молекулы и атомы действительно существуют, их относительный вес нам известен. Узнав число Авогадро, мы сможем узнать их абсолютный вес».
- В 1909 эксперимент французского учёного Жана Батиста Перрена подтвердил формулу Эйнштейна, опубликованную в 1905 году, и помог доказать существование атомов и молекул. Это доказательство принесло ему в 1926 году Нобелевскую премию по физике
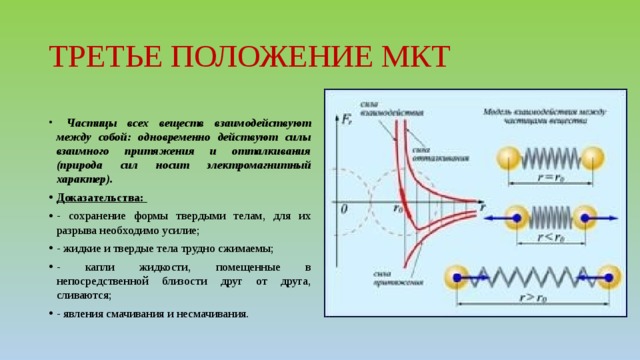
ТРЕТЬЕ ПОЛОЖЕНИЕ МКТ
- Частицы всех веществ взаимодействуют между собой: одновременно действуют силы взаимного притяжения и отталкивания (природа сил носит электромагнитный характер).
- Доказательства:
- — сохранение формы твердыми телам, для их разрыва необходимо усилие;
- — жидкие и твердые тела трудно сжимаемы;
- — капли жидкости, помещенные в непосредственной близости друг от друга, сливаются;
- — явления смачивания и несмачивания.
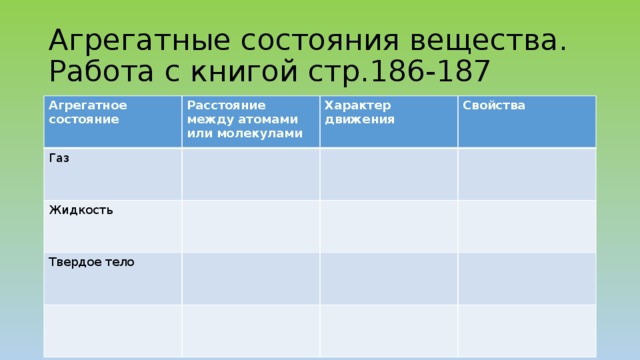
Агрегатные состояния вещества. Работа с книгой стр.186-187
Расстояние между атомами или молекулами
Ответим на вопросы Базового уровня
(А) Укажите пару веществ, скорость диффузии которых наибольшая при прочих равных
(А) Какова масса 25 моль углекислого газа?
- условиях:
- 1) раствор медного купороса и вода
- 2) пары эфира и воздух
- 3) свинцовая и медная пластины
- 4) вода и спир
- 1) 1,5 кг 2) 1,1 кг 3) 0,9 кг 4) 1,3 кг
- Указание: найти молярную массу СО2, по формуле m = νM определить массу.
Ответим на вопросы Базового уровня
(А) Какое явление наиболее убедительно доказывает, что между молекулами существуют
- (А) Где число молекул больше: в одном моле водорода или в одном моле воды?
- 1) одинаковое
- 2) в одном моле водорода
- 3) в одном моле воды
- 4) ответ неоднозначен
- силы отталкивания?
- 1) диффузия
- 2) броуновское движение
- 3) беспорядочное движение молекул
- 4) практическая несжимаемость жидкостей и твердых тел
Ответим на вопросы Базового уровня
(А) Частицы вещества находятся в среднем на таких расстояниях друг от друга, при которых силы притяжения между ними незначительны. В этом агрегатном состояниивещество
(А) Какое из утверждений справедливо для кристаллических тел?
- 1) сохраняет свою начальную форму
- 2) практически не сжимается
- 3) не сохраняет форму, но сохраняет начальный объем
- 4) занимает весь предоставленный объем
- 1) Во время плавления температура кристалла изменяется.
- 2) В расположении атомов кристалла отсутствует порядок.
- 3) Атомы кристалла расположены упорядоченно.
- 4) Атомы свободно перемещаются в пределах кристалла.
Ответим на вопросы Базового уровня
(А) Укажите правильное утверждение.
А) Как зависит скорость диффузии от агрегатного состояния вещества при постоянной
При переходе вещества из жидкого состояния в газообразное …
- температуре?
- 1) не зависит
- 2) скорость максимальна в газах
- 3) скорость максимальна в жидкостях
- 4) скорость максимальна в твердых телах
- А. увеличивается среднее расстояние между его молекулами.
- Б. молекулы почти перестают притягиваться друг к другу.
- В. полностью теряется упорядоченность в расположении его молекул.
- 1) только А 3) только В
- 2) только Б 4) А, Б и В
Ответим на вопросы Базового уровня
- А) Молекулы газов находятся на больших расстояниях друг от друга по сравнению с их размерами, силы притяжения между ними незначительны. Этим можно объяснитьследующие свойства газов:
- А. Не имеют своей собственной формы.
- Б. Не сохраняют своего объема.
- В. Легко сжимаются.
- Какие из утверждений правильны?
- 1) только А и Б 3) только Би В
- 2) только А и В 4) А, Б, В
- (А) Атомы в кристалле находятся друг от друга на таких расстояниях, при которых силы
- притяжения…
- 1)…больше сил отталкивания
- 2)…меньше сил отталкивания
- 3)… равны силам отталкивания
- 4)… равны нулю
10 класс.10 класс.ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ диффузия; броуновское движение делимость вещества; изменение объема при нагревании существование агрегатных состояний; — презентация
Презентация была опубликована 9 лет назад пользователемgordiev-uzel.ucoz.ru
Похожие презентации
Презентация на тему: » 10 класс.10 класс.ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ диффузия; броуновское движение делимость вещества; изменение объема при нагревании существование агрегатных состояний;» — Транскрипт:
2 ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ диффузия; броуновское движение делимость вещества; изменение объема при нагревании существование агрегатных состояний; смачиваемость
3 Некоторые величины и их физический смысл ν=1 моль Количество вещества [V ] =моль, V = N / Na; V = m / M; Число Авогадро (N частиц в 1 моле) Na = 6 ·10 23 моль -1, Относительная молекулярная масса [M r ] = г/ моль; (по таблице элементов) Молярная масса (масса 1 моля, Na) M = M r · кг/ моль Масса одной частицы m 0 = M / Na. N=N a
4 абсолютная T=0К – отсутствие теплового движения молекул Условия: p=const; V=const; T=const; T 1 =T 2. A A BB
5 Давление газа обусловлено ударами молекул о стенки сосуда.
6 Менделеева – Клапейрона ; для одного состояния ; для любых газов.
T 1 T1T1 p1p1 p 2 » title=»ИЗОПРОЦЕССЫ процесс, уравнение Система координат p — V p — T V — T Изотерми- ческий, T=const, pV=const Изобарный, p=const, V=Tconst Изохорный, V=const, p=Tconst p p p p p p V V V V V V TT TT TT T 2 >T 1 T1T1 p1p1 p 2 » > 7 ИЗОПРОЦЕССЫ процесс, уравнение Система координат p — V p — T V — T Изотерми- ческий, T=const, pV=const Изобарный, p=const, V=Tconst Изохорный, V=const, p=Tconst p p p p p p V V V V V V TT TT TT T 2 >T 1 T1T1 p1p1 p 2 T 1 T1T1 p1p1 p 2 «> T 1 T1T1 p1p1 p 2 «> T 1 T1T1 p1p1 p 2 » title=»ИЗОПРОЦЕССЫ процесс, уравнение Система координат p — V p — T V — T Изотерми- ческий, T=const, pV=const Изобарный, p=const, V=Tconst Изохорный, V=const, p=Tconst p p p p p p V V V V V V TT TT TT T 2 >T 1 T1T1 p1p1 p 2 «>
8 Различные газы, взятые в количестве 1 моль, имеют одинаковые объемы при одинаковых давлениях и температурах. Если: р 1 =р 2, T 1 = T 2, 1 = 2 =1моль, то V 1 = V 2 ; при нормальных условиях: V = 22,4л р i — парциальное давление (одного газа из смеси) р = р 1 + р 2 + р 3 + … (для разреженных газов)
9 Применение в технике Давление: изменить давление – изменить массу газа, пример, шины, вакуумные трубки; Сжимаемость: хранение; совершение работы, пример, амортизаторы, двигатели Зависимость объема от температуры: нагревание при p =const – увеличение V.
http://multiurok.ru/index.php/files/priezientatsiia-k-uroku-fiziki-10-klassa-osnovy-mk.html
http://www.myshared.ru/slide/216952/