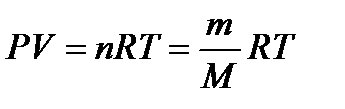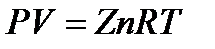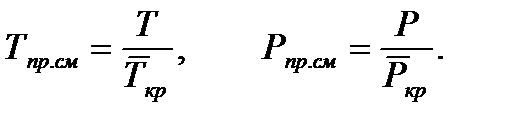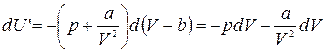Уравнение состояния идеального и реального газа.
Уравнение состояния идеальных газов.аналитическая зависимость между основными параметрами состояния газа (объем, давление и температура). Уравнением состояния идеальных газов называют уравнение Менделеева-Клапейрона или Клапейрона-Менделеева,
где Р – абсолютное давление, Па; V – объем занимающий газом, м 3 ; n – число киломолей газа; m – масса вещества; М – молекулярная масса; Т – абсолютная температура, К; R – универсальная газовая постоянная, 8314,3 Дж/(кмоль∙К).
Универсальная газовая постоянная – это работа расширения одного моля газа при нагревании на один градус при постоянном давлении. В системе СИ измеряется Дж/(моль*К) и равняется 8,3143.
Уравнение состояния реальных газовДля описания поведения природных газов во время добычи, переработки и транспортировки, при давлениях выше атмосферного, наиболее широко в отрасли используется следующее уравнение:
где Z – безразмерный коэффициент сферхсжимаемости газа, который вводится в уравнение состояния идеального газа, для того чтобы учитывать отклонение реального газа от законов идеального.
7. Критические параметры газа: Ткр , Ркр .
Критическим состоянием вещества (газа) является такое состояние, при котором исчезает граница между его газовой и жидкой фазой и свойства этих фаз становятся равными друг другу.
Критические параметры газа.Критической называется такая температура, выше которой, при любом давлении, газ не может быть переведен в жидкое состояние. Давление, необходимое для сжижения газа при критической температуре, называется критическим.Приведенные параметры газа.Приведенными параметрами называют безразмерные величины, показывающие, во сколько раз действительные параметры состояния газа (давление, температура, плотность, удельный объем) больше или меньше критических:
Дата добавления: 2016-12-27 ; просмотров: 5566 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Идеальный и реальный газ.
Уравнение состояния идеального газа.
Идеальным называется газ, взаимодействие между молекулами которого пренебрежимо мало. Реальный газ при достаточном разрежении близок по своим свойствам к идеальному. Идеальный газ одно из двух идеальных систем,
для которых можно строго вывести уравнение состояния. Для всех других систем уравнения состояния получают эмпирически.
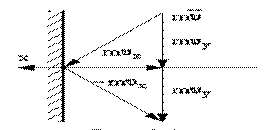
Рассмотрим идеальный газ, заключенный в сосуде. Молекулы газа непрерывно соударяются с его стенками, в результате чего оказывают давление на них. Рассмотрим взаимодействие молекул с одной стенкой (рис.1.15.1).
Вследствие хаотичности движения молекул давление газа на различные участки стенок сосуда одинаково. Давление газа на стенки определяется
р=(суммарная сила взаимодействия молекул со стенкой) / (площадь стенки)
Молекулы соударяются со стенкой упруго, т.е. отскакивают от стенки зеркально (углы падения и отражения равно). В результате взаимодействия с одной молекулой, массы т, движущейся со скоростью 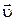
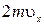
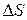
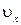

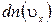
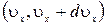
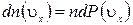
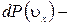
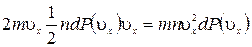
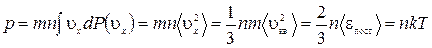
Выражение получено с учетом (1.14.11).
Это и есть уравнение состояния идеального газа:
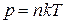
Это уравнение можно записать иначе, если учесть 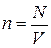
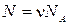
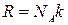
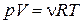
Внутренняя энергия идеального газа.
Поскольку в идеальном газе отсутствуют силы взаимодействия между молекулами, то внутренняя энергия идеального газа представляет собой только кинетическую энергию молекул
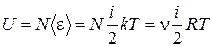
где i — число степеней свободы молекулы, которое равно 3 для одноатомной молекулы, 5 – для двухатомной, 6 – для многоатомной.
Теплоемкости и уравнение политропы идеального газа.
Из соотношений (1.13.5), (1.13.6), и (1.15.4) получим выражения для молярной теплоемкости при постоянном объеме и постоянном давлении идеального газа: 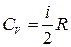
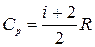
Для получения уравнения политропы воспользуемся формулой (1.13.8). Из уравнения состояния (1.15.3) получим 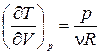
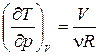
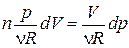
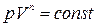
В частности, уравнение адиабатного процесса
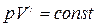
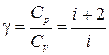
Энтропия идеального газа.
Из соотношений (1.14.4), (1.12.7), (1.13.5) и (1.12.4) следует

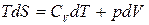
Для идеального газа 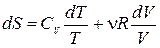
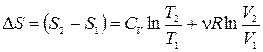
Реальный газ. Уравнение Ван – дер – Вальса.
В реальных газах между молекулами существуют как силы притяжения, которые преобладают на далеких расстояниях, так и силы отталкивания, которые преобладают при сближении молекул. Действие сил отталкивания сводится к тому, что молекула не допускает проникновения в некоторый объем других молекул. Следовательно, силы отталкивания характеризуются эффективным объемом молекулы. Наличие сил притяжения приводит к появлению дополнительного внутреннего давления.
Как уже говорилось, уравнение состояния реального газа нельзя получить аналитически. Существует несколько различных уравнений, описывающих состояние реального газа. Все они получены эмпирически. Чаще всего состояние реального газа описывают уравнением Ван – дер – Вальса, которое в достаточно широком диапазоне изменения параметров дает удовлетворительное согласие с экспериментом. Для моля реального газа оно имеет вид:
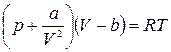
Параметры а и b называются постоянными Ван – дер – Вальса. Они зависят от рода газа.
Достоинство уравнения Ван – дер — Ваальса состоит не только в том, что оно описывает газовую фазу вещества в более широкой области температур и давления, но и в том, что оно описывает картину превращения газа в жидкость. Для объяснения этого факта рассмотрим зависимости давления от объема при постоянной температуре (изотермы).
Преобразуем уравнение Ван – дер — Ваальса для одного моля и запишем его по степеням объема

Уравнение состояния стало кубическим относительно объёма, а число постоянных, являющихся его параметрами, стало равным трем. Как известно, кубическое уравнение имеет три корня. Для уравнения Ван-дер-Ваальса имеют место три следующих случая: а) корни действительны; б) два корня мнимые и один корень действительный, в) три действительных корня тождественны.
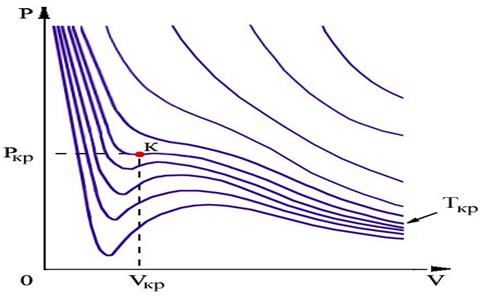
На рис.1.15.2 схематически изображены изотермы газа Ван-дер-Ваальса для различных температур.
 |
| Рис.1.15.2. |
На части этих изотерм хорошо просматривается участок, где давление растёт с ростом объёма. Этот участок не имеет физического смысла. В области, где изотерма делает зигзагообразный изгиб, изобара пересекает её три раза, то есть, имеется три значения объёма 
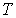
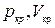
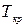
Критические параметры 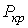
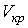
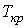
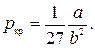 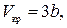 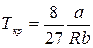 . . |
Таким образом, из уравнения состояния газа Ван-дер-Ваальса следует существование у реальных газов критической точки с параметрами 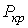
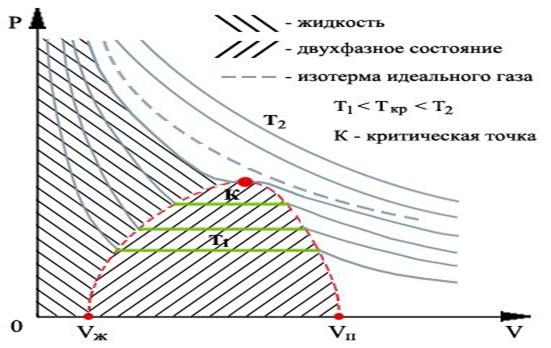
Обратимся теперь к экспериментальным кривым изотерм Ван-дер-Ваальса. На рис.1.15.3 показан вид экспериментально полученных изотерм, характерный для многих веществ.
 |
| Рис.1.15.3. |
На этих кривых виден горизонтальный участок, который заменяет немонотонный участок на теоретических изотермах газа Ван-дер-Ваальса (рис.1.15.2). Справа от горизонтального участка давление на экспериментальной изотерме монотонно растет с уменьшением объема, что соответствует сжатию реального газа при постоянной температуре. Горизонтальный участок соответствует сжижению газа, которое при заданной температуре происходит при постоянном давлении. При этом существует двухфазная система жидкость-газ. Наконец, слева от горизонтального участка, где изотерма вновь становится монотонно убывающей функцией 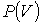
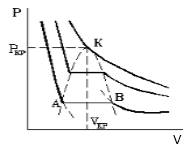
Совокупность участков изотерм реального газа, соответствующих двухфазным системам жидкость-газ, образуют колоколообразную фигуру (см. рис.1.15.3), вершиной которой является критическая точка. выше критической вещество может существовать только в газообразном состоянии. При температуре ниже критической, вещество может быть сжижено. Таким образом, на диаграмме можно указать три области значений параметров, при которых вещество может существовать только в газообразном, только в жидком состояниях и область, где жидкость и газ находятся в равновесии.
Например, критическая температура для гелия очень низкая — 5,2 К. Поэтому его сжижение связано с большими трудностями. В отличие от гелия, водорода, кислорода и азота, чьи критические температуры достаточно низкие (поэтому в основном они существуют в газообразном состоянии), такие вещества как вода и ртуть (критические температуры 647 К и 1820 К соответственно) существуют как в жидком, так и в газообразном состояниях при комнатных температурах. Поэтому исчезает различие понятий «газ» и «пар».При температурах
Внутренняя энергия реального газа.
Для нахождения внутренней энергии газа Ван-дер-Ваальса, воспользуемся следующим приемом. Пусть над газом Ван-дер-Ваальса осуществляется процесс без теплообмена с окружающей средой. Тогда изменение его внутренней энергии можно записать в виде
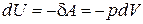
При тех же условиях изменение внутренней энергии идеального газа можно было бы рассчитать по формуле
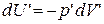
Сравнивая уравнения состояния моля идеального (1.15.3) и реального (1.15.9) газов, можем видеть 
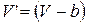
Первое слагаемое в правой части этого выражения согласно формуле (1.15.11) представляет собой изменение внутренней энергии газа Ван-дер-Ваальса. Отсюда следует:
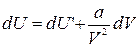
Интегрирование этого выражения дает
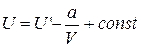
Здесь произвольную константу интегрирования необходимо положить равной нулю, так как при 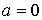
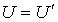
Использование выражения (1.15.4) для внутренней энергии идеального газа позволяет записать формулу, для расчета внутренней энергии одного моля газа Ван- дер – Вальса
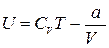
Как следует из этого выражения, внутренняя энергия газа Ван-дер-Ваальса зависит не только от его температуры, как в случае с идеальным газом, но и от объема, занимаемого им. По этой причине, при осуществлении изотермических процессов в газе Ван-дер-Ваальса, будет изменяться его внутренняя энергия, а, следовательно, при таких процессах подведенная к газу теплота не будет равна совершенной им работе.
Если внутренняя энергия идеального газа определяется кинетической энергией его молекул, то для газа Ван-дер-Ваальса существенное значение имеет потенциальная энергия, обусловленная силами притяжения и отталкивания.
Уравнение состояния вещества
Параметры состояния связаны друг с другом. Соотношение, при котором определяется данная связь, называют уравнением состояния данного тела. В самом простом случае равновесное состояние тела определяется значением следующих параметров: давления p , объема V и температуры (масса тела или системы, как правило, известна).
Что такое идеальный газ
Уравнение состояния так называемого идеального газа является простым, но достаточно информативным.
Идеальный газ – это газ, в котором пренебрегают взаимодействием молекул между собой.
Идеальными считают разреженные газы. Особенно близки к идеальным газы гелий и водород. Идеальный газ – это упрощенная математическая модель реального газа: молекулы движутся хаотически, а соударения между молекулами и удары молекул о стенки сосуда упругие, не приводящие к потерям энергии в системе. Подобная упрощенная модель весьма удобна, поскольку не требует учета силы взаимодействия между молекулами газа. Множество реальных газов не отличаются в своем поведении от идеального газа в условиях, когда суммарный объем молекул пренебрежимо мал в сравнении с объемом сосуда (то есть при атмосферном давлении и комнатной температуре). Это дает возможность применять уравнение состояния идеального газа для сложных расчетов.
Уравнение состояния идеального газа запишем несколько раз ( 2 ) , ( 3 ) , ( 5 ) :
p V = m μ R T = ν R T ( 2 ) .
Уравнение ( 2 ) – уравнение Менделеева-Клапейрона, где m – это масса газа, μ – это молярная масса газа, R = 8 , 31 Д ж м о л ь · К – это универсальная газовая постоянная, ν – это число молей вещества.
где N – это количество молекул газа в массе m , k = 1 , 38 · 10 — 23 Д ж К , постоянная Больцмана, определяющая «долю» газовой постоянной, которая приходится на 1 молекулу и
N A = 6 , 02 · 10 23 м о л ь — 1 – это постоянная Авогадро.
Если поделить в ( 4 ) обе части на V , то получаем следующий вид записи уравнения состояния идеального газа:
где n = N V – это количество частиц в единице объема или же концентрация частиц.
Что такое реальный газ
Рассмотрим теперь более сложные системы: неидеальные газы и жидкости.
Реальный газ – это газ, между молекулами которого наблюдаются заметные силы взаимодействия.
Необходимо учитывать, что в неидеальных, плотных газах взаимодействие молекул высоко. Известно, что взаимодействие молекул очень сильно усложняет физическую картину, потому точную формулу уравнения состояния неидеального газа не получается записать в простом виде. В данном случае прибегают к приближенным формулам, найденным полу-эмпирическим путем. Самая удачная формула – это уравнение Ван-деp-Ваальса.
Взаимодействие молекул обладает сложным характером. На достаточно больших расстояниях между молекулами действуют силы притяжения. С уменьшением расстояния силы притяжения вначале растут, однако потом уменьшаются и преобразуются в силы отталкивания. Притяжение и отталкивание молекул будем рассматривать и учитывать отдельно. Уравнение Ван-дер-Ваальса, которое описывает состояние одного моля реального газа, имеет вид:
p + a V μ 2 V μ — b = R T ( 6 ) ,
где a V μ 2 – это внутреннее давление, обусловленное силами притяжения между молекулами, b – это поправка на собственный объем молекул, учитывающая действие сил отталкивания между молекулами, при этом:
b = N A 2 3 πd 3 ( 7 ) ,
где d – это диаметр молекулы. Значение a рассчитывается по формуле:
a = — 2 πN A 2 ∫ d ∞ W p ( r ) r 2 dr ( 8 ) ,
где W p ( r ) – это потенциальная энергия притяжения 2 -х молекул.
При увеличении объема значение поправок в уравнении ( 6 ) становится менее существенным. И в пределе уравнение ( 6 ) превращается в уравнение ( 2 ) . Это согласовано с тем фактом, что с уменьшением плотности реальные газы по своим характеристикам приближаются к идеальным.
Положительным в уравнении Ван-деp-Ваальса является тот факт, что данное равенство при очень больших плотностях приблизительно описывает также и свойства жидкости, в частности, плохую ее сжимаемость. Потому существует основание предполагать, что уравнение Ван-деp-Ваальса позволяет отразить и переход от жидкости к газу (либо от газа к жидкости).
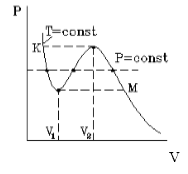
На рисунке 1 представлена изотерма Ван-дер-Ваальса для некоторого постоянного значения температуры T , которая построена из соответствующего уравнения.
В месте “извилины” (участок КМ) изотерма 3 раза пересекает изобару. На участке
V 1 , V 2 давление увеличивается с ростом объема.
Подобная зависимость невозможна. Это означает, что в этой области с веществом происходит что-то необыкновенное. Что именно, не видно в уравнении Ван-деp-Ваальса. Обратимся к опыту. В месте “извилины” на изотерме в состоянии равновесия вещество расслаивается на 2 фазы: жидкую и газообразную. Обе фазы существуют одновременно и находятся в фазовом равновесии. В таком состоянии происходит испарение жидкости и конденсация газа. Процессы протекают с такой интенсивностью, что полностью компенсируют друг друга: объем жидкости и газа со временем не изменяется.
Газ, который находится в фазовом равновесии со своей жидкостью, называется насыщенным паром. Если фазовое равновесие отсутствует, отсутствует также компенсация испарения и конденсации, тогда газ называется ненасыщенным паром.
Что происходит с изотермой в области двухфазного состояния вещества (то есть в месте «извилины» изотермы Ван-деp-Ваальса)? Эксперимент показывает, что в этом месте при изменении объема давление остается неизменным. График изотермы идет параллельно оси V (рисунок 2 ).
С увеличением температуры участок двухфазных состояний на изотермах уменьшается до тех пор, пока не превращается в точку (рисунок 2 ). Это особая точка К , в которой исчезает разница между жидкостью и паром. Ее называют критической точкой.
Параметры, которые соответствуют критическому состоянию, являются критическими (критическая температура, критическое давление, критическая плотность вещества).
Необходимо найти величину n . В процессе, представленном на рисунке 3 , давление p
Из графика, приведенного на рисунке 3 , запишем уравнение процесса в параметрах p ( V ) :
С учетом уравнения Менделеева-Клайперона:
V вместо объема, получаем:
Моль кислорода охлаждают до — 100 ° C . Необходимо определить давление, которое оказывает газ на стенки сосуда, если занимаемый газом объем V = 0 , 1 л . Необходимо также сравнить p с давлением идеального газа p i d , если бы кислород вел себя как идеальный газ. Величина постоянных Ван-дер-Ваальса a и b , для кислорода a = 0 , 1358 П а · м 6 / м о л ь 2 , b = 3 , 167 · 10 — 5 м 3 / м о л ь .
Из уравнения Ван-Дер-Ваальса имеем:
p = R T V μ — b — a V μ 2
Переведем температуру в систему измерения: T = t + 273 , По условию T = 173 K , V = 0 , 1 л = 10 — 4 м 3 .
Произведем расчет: p = 8 , 31 · 173 ( 10 — 3 , 2 ) · 10 — 5 — 0 , 1358 ( 10 — 4 ) 2 = 75 , 61 · 10 5 ( П а ) .
Для идеального газа:
Рассчитаем: p i d = 1 · 8 , 31 · 173 10 — 4 = 143 · 10 5 ( П а ) .
http://helpiks.org/4-64823.html
http://zaochnik.com/spravochnik/fizika/molekuljarno-kineticheskaja-teorija/uravnenie-sostojanija-veschestva/