Уравнение непрерывности потока в эхокардиографии
Скорости кровотока, определенные при ДЭхоКГ, используют для измерения давления в камерах сердца и крупных сосудах. Скорость ТР отражает разницу давления во время систолы между ПЖ и ПП. Систолическое давление в ПЖ можно рассчитать, сложив давление в ПП и скорость ТР, возведенную в квадрат и умноженную на 4. При отсутствии обструкции ВОПЖ систолическое давление в ЛА равно систолическому давлению в ПЖ. Скорость ЛР отражает разницу диастолического давления между ЛА и ПЖ. Конечное диастолическое давление в ЛА можно рассчитать, прибавляя КДД в ПЖ, которое эквивалентно давлению в ПП, к скорости ЛР, возведенной в квадрат и умноженной на 4.
Среднее давление в ЛА хорошо коррелирует с разницей раннего диастолического давления между ЛА и ПЖ, отсюда (пиковая скорость ЛР)2 х 4.
Конечное диастолическое давление в левом желудочке. Аортальная регургитация отражает разницу диастолического давления между Ао и ЛЖ. Поэтому: клд лж = дад-(КДС АР)2 х 4, где ДАД — диастолическое артериальное давление, КДС — конечная диастоли-ческая скорость. КДД АЖ и давление в ЛП также можно оценить по различным показателям диастолического наполнения трансмитрального потока, скорости кровотока в легочных венах, ТД, цветового трансмитрального потока в М-режиме.
Ударный объем и сердечный выброс. В соответствии с законами гидравлики объем крови, проходящий через фиксированное отверстие, равен произведению площади поперечного сечения отверстия (S) и скорости кровотока: Объем крови = S х Скорость кровотока.
Эту формулу используют при всех ДЭхоКГ-расчетах скорости кровотока УО и площади поперечного сечения отверстия.
Поскольку скорость кровотока во время выброса крови в пульсирующее сосудистое русло меняется, отдельные скорости допплеровского спектра необходимо суммировать (например, интегрировать), чтобы измерить общий объем потока за период изгнания. Сумму скоростей называют интегральной скоростью за определенное время (TVI, time velocity integral, или VTI, velocity time integral). Она равна площади, образованной изолинией и кривой, очерчивающей допплеровский спектр кровотока. После определения TVI рассчитывают УО как произведение TVI на площадь поперечного сечения отверстия (S): yo = SxTVI.
Местом определения УО чаще всего является ВОЛЖ. Поток через другие отверстия можно рассчитать с помощью этой же формулы. Площадь поперечного сечения отверстий в сердце обычно принимают за круг и рассчитывают, измеряя диаметр отверстия (D): S = (D/2)2 х я = D2 х 0,785.
Следовательно, УО = D2x 0,785 x TVI. Сердечный выброс (СВ) рассчитывают, умножая УО на ЧСС, а сердечный индекс (СИ) — деля СВ на площадь поверхности тела.
Уравнение непрерывности. Объем потока или УО, проходящий через стенозированное или расширенное (при регургитации) отверстие, равен объему потока или УО проксимальное (выше) в области с известной площадью поперечною сечения отверстия и скоростью кровотока (или TVI).
Объем потока рассчитывают как произведение площади и скорости кровотока (или TVI): A1 xTVI1 = A2xTVI2, где А1 — известная площадь, расположенная проксимальнее неизвестной площади А2. Это уравнение непрерывности потока используют для расчета площади клапана при его стенозе или недостаточности. С помощью следующего уравнения рассчитывают площадь стенозированного или расширенного отверстия: А2 = A1х TVV1/TVI2.
При аортальном стенозе УО через АК (А2) равен УО через ВОЛЖ (А1). При MP поток через отверстие МК (А2) равен потоку через проксимальную односкоростную зону, известную под названием «проксимальная изоскоростная площадь регургитации» (PISA, proximal isovelocity surf ace area) (А1). Следует отметить, что отношение указанных площадей обратно пропорционально отношению их TVI: А2/А1 = TVI1/TVI2.
Эхокардиография при легочной гипертензии (продолжение)
Допплерэхокардиография сердца при легочной гипертензии
Систолическое и диастолическое давление в легочной артерии на импульсный и непрерывный волновой допплер: методы диагностики и основные диагностические особенности
- Систолическое давление ПА оценивается с использованием упрощенного уравнения Бернулли: ΔP = 4V2; где, [V = пиковая скорость регургитации на трикуспидальном клапане (РTК)] + право предсердное давление
- Время начала пиковой скорости на легочном клапане (время ускорения) является показателем легочной гипертензии на эхокардиографии. Время ускорения 110 мсек). Кривая скорости потока ЛА также может показывать срединно-систолическое снижение кровотока, что соответствует срединно-систолическому закрытию легочного клапана, наблюдаемого в М-режиме.
- Соотношение РТК/ VTI ПЖ, равное 0,175, коррелирует с легочным сосудистым сопротивлением (ЛСС)> 2 единиц Вуда, и ЛСС можно оценить как: ЛСС = 10 × РТК/ VTI ПЖ, где РТК = пиковая скорость регургитации на трикуспидальном клапане в м/с, а VTI ПЖ = интеграл скорости по времени в выводном тракте правого желудочка (ВОПЖ) по импульсному волновому допплеру с парастернальной короткоосевой проекции. ЛСС> 2 единиц Вуда указывает на легочную гипертензию.
- Систолические, диастолические и рестрикционные потоки печеночных вен у пациентов с ЛГ в правом предсердии демонстрируют изменения, аналогичные тем, которые наблюдаются в легочных венах у пациентов с высоким давлением в левом предсердии.
- Большинство пациентов с легочной гипертензией на эхокардиографии имеют регургитацию на легочном клапане.
Таким образом, диастолическое давление ЛА на эхокардиографии может быть оценено как 4V2 + правое предсердное давление, где V = конечная диастолическая скорость легочной регургитации полученной с помощью допплера непрерывной волны. Диастолическая дисфункция правого желудочка на импульсном и непрерывном волновом допплере: основные диагностические особенности:
- Принципы, используемые для оценки диастолической функции левого желудочка, могут быть применены к правому желудочку.
- При легочной гипертензии и гипертрофии правого желудочка наблюдается уменьшение E-волны и увеличение A-волны скорости притока через трикуспидальный клапан в соответствии с аномальной релаксацией правого желудочка.
- При уменьшении податливости правого желудочка волна E становится преобладающей (псевдонормализация) до тех пор, пока не сформируется ограничительный паттерн с отношением волны E к А> 2.
Клапанная регургитация при легочной гипертензии и легочное сердце на эхокардиографии
Трикуспидальная регургитация (ТР): методы диагностики и основные диагностические особенности. Импульсный и непрерывный волновой допплер:
- Трикуспидальный клапан является структурно нормальным, а ТР, как правило, легкой или умеренной.
- Ранняя скорость притока через трикуспидальный клапан ≥1 свидетельствует о тяжелой ТР.
- При умеренном значении TР характер кровотока в печеночных венах свидетельствует о снижении нормального систолического кровотока.
- При тяжелой ТР может наблюдаться отсутствие или обратный систолический кровоток.
- Интенсивность спектрального сигнала при тяжелом ТР аналогична притоку через трикуспидальный клапан, и часто волна «V» или снижение скорости во второй половине систолы рассматривается как выравнивание давления в правом желудочке и правом предсердии.
Цветной допплер при легочной гипертензии
• Следующие параметры на эхокардиографии соответствуют тяжелой регургитации на трехстворчатом клапане:
- Радиус площади проксимальной поверхности (PISA) 10,6 мм для предела Найквиста 28 см/с.
- Радиус PISA 6,8 мм для ограничения Найквиста 41 см/сек.
- Струя площадью 10,6 см2.
- Струя длиной 5,3 см.
- Отношение струи к правой предсердности> 40%.
- Ширина вены контракта составляет ≥6,5 мм.
• Точная оценка степени тяжести ТР по эхокардиографии требует интеграции доплеровских параметров с параметрами давления ЛА, размерами и функции правого желудочка, а также размера и давления в правом предсердии.
Легочная регургитация: методы диагностики и основные диагностические особенности по эхокардиографии
Импульсный и непрерывный волновой допплер
- Легкая и умеренная легочная регургитация (РЛА) часто встречается у пациентов с легочным сердцем. Если видна тяжелая РЛА, то это, вероятно, связано с первичным заболеванием клапана.
- Хотя общий ударный объем правого желудочка, вычтенный из ударного объема левого желудочка, определяет регургитирующий объем при легочной регургитации, пороговые значения для классификации РЛА не были определены.
- Непрерывный волновой сигнал при РЛА демонстрирует медленное затухание при легких и умеренных поражениях, но при более сильной регургитации он показывает более крутой уклон и более короткое время полупериода давления. Половина времени давления> 100 мсек указывает на легкую РЛА. Период полспада
Эхокардиография в диагностике легочной гипертензии
Легочная гипертензия (ЛГ) – патологический симптомокомплекс, характеризующийся повышением давления в легочной артерии (ЛА) вследствие повышения легочного сосудистого сопротивления и/или наличием гемодинамически значимого лево-правого сброса при пороках сердца, когда давление в правых отделах сердца и легочных артериальных сосудах достигает значения системного. Морфологические и функциональные изменения, которые претерпевает правый желудочек (ПЖ) в создавшихся условиях, в конечном итоге приводят к развитию сердечной недостаточности (СН), инвалидности и летальному исходу.
ЛГ может быть самостоятельной патологией либо рассматриваться как синдром, вторичный по отношению к основному заболеванию.
В настоящее время общепризнанной является классификация ЛГ, принятая в 2008 году в г. Дана-Пойнт (Калифорния, США) на Всемирном симпозиуме по ЛГ. Согласно данной классификации выделяют пять основных групп ЛГ:
– легочная артериальная гипертензия (ЛАГ);
– ЛГ вследствие патологии левых отделов сердца;
– ЛГ вследствие заболеваний легких и/или гипоксии;
– хроническая тромбоэмболическая ЛГ;
– ЛГ вследствие невыясненных многофакторных механизмов.
На ежегодном конгрессе Европейского общества кардиологов (ESC), проходившем в 2015 году в г. Лондон (Великобритания), были представлены новые Рекомендации по диагностике и лечению ЛГ (Guidelines for the diagnosis and treatment of pulmonary hypertension), разработанные совместно ESC и Европейским респираторным обществом (ERS) (ESC/ERS, 2015) [1], которые стали результатом анализа ряда крупных исследований, проводившихся после выхода в свет предыдущего издания рекомендаций (Guidelines for the diagnosis and treatment of pulmonary hypertension ESC/ERS/ISHLT, 2009).
В данном документе с позиций доказательной медицины представлены лечебные стратегии при наличии у пациента ЛГ и с учетом конкретной клинической ситуации и соотношением риска и пользы диагностических процедур и медикаментозных средств.
Эксперты ERS рекомендуют диагностировать ЛГ при увеличении среднего давления в легочной арте-
рии (PAPm) ≥25 мм рт. ст. в покое по результатам катетеризации правых отделов сердца. Как известно, средние значения PAPm в покое в норме колеблются в пределах 14±3 мм рт. ст. с максимальным значением 20 мм рт. ст. Клиническое значение PAPm в интервале 21-24 мм рт. ст. не определено. В случае отсутствия явных клинических симптомов ЛГ при данных значениях PAPm необходимо проводить мониторинг состояния пациента [2, 3].
Как и прежде, ЛГ рассматривают как патофизиологическое состояние, осложняющее течение многих сердечно-сосудистых и респираторных заболеваний.
Эксперты ESC подчеркивают, что ЛГ – патофизиологическое и гемодинамическое состояние, а не клинический диагноз. В качестве клинического диагноза можно рассматривать только ее особую форму – идиопатическую (наследственную) ЛАГ, остальные группы ЛГ являются вторичными состояниями при различных заболеваниях и патологических нарушениях.
ЛАГ диагностируют у пациентов, у которых имеет место уровень среднего давления в ЛА ≥25 мм рт. ст. в покое, величина давления заклинивания в легочных капиллярах (PAWP) ≤15 мм рт. ст., а также легочное сосудистое сопротивление (PVR) >3 ед. С анатомической точки зрения ЛАГ представляет собой прекапиллярную ЛГ, которая развивается самостоятельно, без каких-либо провоцирующих заболеваний внутренних органов – хронические легочные заболевания (хроническое обструктивное заболевание легких –ХОЗЛ, интерстициальные поражения легких, синдром обструктивного апноэ сна, тромбоэмболия ЛА –ТЭЛА и пр.) [2].
В рекомендациях 2015 года предложена «гемодинамическая» классификация ЛГ, в которой разновидности ЛГ систематизированы с учетом величин давления в ЛА, давления заклинивания в легочных капиллярах, величины сосудистого сопротивления в малом круге кровообращения, а также сердечного выброса, измеренных в состоянии покоя (табл. 1).
Согласно Международной классификации болезней 10-го пересмотра (МКБ‑10) ЛАГ (группа 1 ЛГ) классифицируется как «болезни системы кровообращения» с кодами 127.0 – идиопатическая ЛАГ и 127.8 – ЛАГ, ассоциированная с врожденными пороками сердца; резидуальная ЛАГ; синдром Эйзенменгера; персистирующая ЛАГ новорожденных; ЛАГ, ассоциированная с системными заболеваниями соединительной ткани; ЛАГ, ассоциированная с ВИЧ-инфекцией; ЛАГ, ассоциированная с портальной гипертензией; ЛАГ, ассоциированная с шистосомозом; легочная веноокклюзионная болезнь или легочный веноакклюзионный гемангиоматоз.
Данная патология встречается достаточно редко, что и явилось основанием отнести ее к группе редких, или орфанных, заболеваний.
В Европе данную патологию диагностируют у 15-60 человек на 1 млн населения, заболеваемость в течение года – 5-10 случаев на 1 млн населения [4]. В регистрах у 50% пациентов диагностирована идиопатическая ЛАГ или ЛАГ, обусловленная приемом некоторых медикаментозных препаратов. Из заболеваний соединительной ткани наиболее частой причиной ЛАГ является склеродермия (системный склероз) [5]. Средний возраст пациентов – 50-65 лет (в регистре 1981 года указан средний возраст установления диагноза – 36 лет). Преобладание женщин в пожилом возрасте, по результатам последних исследований, сомнительно.
Наибольшую по численности больных составляет группа 2 ЛГ – как следствие заболевания левых отделов сердца. Распространенность ЛГ у пациентов группы 2 возрастает с появлением и по мере прогрессирования признаков СН. Повышение давления в ЛА определяют у 60% пациентов с тяжелой систолической дисфункцией левого желудочка (ЛЖ) и у 70% пациентов с СН и сохраненной фракцией выброса (ФВ) ЛЖ. Из приобретенных клапанных пороков практически все случаи стеноза митрального клапана осложняются посткапиллярной ЛГ и 65% случаев гемодинамически значимого стеноза аортального клапана 6.
При заболеваниях легких и/или гипоксемии (группа 3 ЛГ) часто встречается мягкая, редко – тяжелая ЛГ, преимущественно при сочетании эмфиземы и распространенного фиброза. Чаще всего причиной ЛГ является ХОЗЛ [9].
Распространенность ЛГ при хронической ТЭЛА составляет 3,2 случая на 1 млн населения. У выживших после острой ТЭЛА ЛГ диагностируется в 0,5-3,8% случаев [10, 11].
Вместе с тем на сегодняшний день существует проблема крайне малого количества информации о демографии и течении заболевания у данной части популяции больных ЛГ, что диктует необходимость создания региональных и государственных регистров в качестве методологического подхода к изучению проблемы.
Актуальной задачей является своевременная диагностика синдрома ЛГ, а также информирование об этой патологии широкого круга специалистов, поскольку, как уже подчеркивалось, она способна осложнять различные заболевания.
Рекомендации ERS (2015) предлагают диагностировать ЛГ на основании клинических данных, включающих анамнез, развитие симптомов и физикальное исследование. Важная роль в подтверждении диагноза ЛГ отводится результатам инструментальных методов исследования, интерпретированным опытными специалистами.
Диагностический алгоритм выстраивается на результатах, подтверждающих или исключающих заболевания, сопровождающиеся развитием ЛГ (группы 2-5).
Инструментальные методы диагностики ЛГ включают как неинвазивные (электрокардиография (ЭКГ), рентгенография органов грудной клетки, трансторакальная эхокардиография (ЭхоКГ), спирография, компьютерная томография высокого разрешения), так и инвазивные методы диагностики (вентиляционно-перфузионная сцинтиграфия легких, ангиопульмонография, катетеризация правых отделов сердца с определением давления в сосудах малого круга кровообращения).
Целесообразность использования каждого из диагностических методов прежде всего обусловлена этиологией ЛГ.
Каковы же место и роль ЭхоКГ в данном процессе? Ультразвуковое исследование сердца позволяет решить главную задачу и определить дальнейшую терапевтическую тактику: установить, на каком уровне отмечается поражение – либо это артерии малого круга кровообращения и речь идет о прекапиллярной ЛГ, либо это посткапиллярная ЛГ с первичным повышением давления в левых отделах сердца и легочных венах.
Американский консенсус и Европейские рекомендации по диагностике и лечению ЛГ предлагают рассматривать ЭхоКГ как метод скрининга для верификации данной патологии 14.
ЭхоКГ позволяет объяснить причину повышения давления в правых отделах сердца (выявляет предсердные и желудочковые шунты, врожденные аномалии, клапанные поражения, ТЭЛА, хроническую СН и пр.), оценить степень гипертензии малого круга, определить структурно-функциональные нарушения со стороны ПЖ при ЛГ.
С помощью метода трансторакальной ЭхоКГ оценивают состояние сердечной мышцы и камер сердца для выявления гипертрофии и дилатации правых отделов сердца, диагностики патологии миокарда и клапанного аппарата, нарушений гемодинамики (табл. 4). В последних рекомендациях говорится, что трансторакальной ЭхоКГ недостаточно для суждения о мягкой или малосимптомной ЛГ в связи с методическими неточностями исследования и индивидуальными особенностями пациентов. В клиническом контексте результаты ЭхоКГ-исследования необходимы для принятия решения о выполнении катетеризации сердца 17.
Чреспищеводную ЭхоКГ используют у пациентов с наличием ЛГ, чаще всего с целью уточнения причины, ее вызвавшей. Так, с помощью данной методики удается выявить дефекты межпредсердной перегородки с локализацией у места впадения нижней и верхней полых вен (дефекты венозного синуса), наличие частичного аномального дренажа легочных вен, а также подтвердить диагноз тромбоэмболической ЛГ – визуализировать наличие тромботических масс в ветвях ЛА. В целом чреспищеводная ЭхоКГ не имеет преимуществ в диагностике ЛГ перед трансторакальной ЭхоКГ.
У пациентов с ЛГ развиваются нарушения морфометрических и гемодинамических параметров, которые можно обнаружить методом трансторакальной ЭхоКГ, проводимой по стандартным методикам, рекомендуемым американским и европейским обществами по эхокардиографии [13, 14].
Ультразвуковыми признаками ЛГ являются: дилатация полости ПЖ >2,6 см, измеренной по длинной оси из парастернального доступа, гипертрофия его свободной стенки >0,5 см (рис. 1), вдавливание базального сегмента межжелудочковой перегородки (МЖП) в полость ЛЖ в диастолу вследствие повышения давления в правых отделах сердца (рис. 2), увеличение соотношения медиально-латеральных размеров ПЖ и ЛЖ сердца, измеренных из верхушечной четырехкамерной позиции, дилатация правого предсердия (рис. 3), дилатация ствола >3 см и ветвей ЛА (рис. 4), дилатация нижней полой вены (НПВ) >2 см с коллабированием ее на вдохе менее чем на 50% (рис. 5).
Допплерографическое исследование внутрисердечной гемодинамики существенно повышает диагностическую ценность ЭхоКГ в выявлении ЛГ, поскольку позволяет оценить степень гипертензии малого круга кровообращения. С помощью допплерографии можно рассчитать систолическое давление в ЛА (СДЛА), которое эквивалентно СД в ПЖ при отсутствии стеноза ЛА. СДЛА вычисляют по формуле:
СДЛА (мм рт. ст.) = СДПЖ (мм рт. ст.) + ДПП (мм рт. ст.), где СДПЖ – систолическое давление в ПЖ; ДПП – давление в правом предсердии.
СДПЖ равняется градиенту давления (ΔР) между ПЖ и правым предсердием, которое определяют по максимальной скорости струи трикуспидальной регургитации (СТР), измеренной в режиме постоянноволнового допплера (рис. 6), с помощью уравнения Бернулли:
ΔР = 4V2, где V – максимальная скорость допплеровского спектра (м/с).
Для расчета давления в правом предсердии измеряют размеры НПВ приблизительно на расстоянии 2 см от места ее впадения в правое предсердие. Кроме абсолютных размеров НПВ, необходимо определить уровень ее коллабирования (%) на вдохе. Величины этих значений определяют величину ДПП:
НПВ ≤2,1 см; уровень спадения на вдохе ≥50%; ДПП=0-5 мм рт. ст. (норма);
НПВ >2,1 см; уровень спадения на вдохе ≥50%; ДПП=6-10 мм рт. ст.;
НПВ >2,1 см; уровень спадения на вдохе 2,1 см; спадение на вдохе отсутствует; ДПП >15 мм рт. ст.
Однако, учитывая неточности оценки ДПП с использованием производных переменных, эксперты ESC/ERS рекомендуют применять постоянноволновое допплеровское картирование для измерения скорости СТР, а не расчетного СДЛА в качестве основного показателя для определения вероятности ЛГ по данным ЭхоКГ.
При затруднениях определения СТР из-за невыраженности ТР рекомендуется использовать так называемую
ЭхоКГ с контрастированием. В качестве контраста применяют физиологический раствор, который взбалтывают до образования мелких пузырьков газа с последующим его внутривенным введением. Наличие газов в полости правого предсердия позволяет более четко выявить регургитацию на трикуспидальном клапане, если таковая имеет место.
В то же время авторы рекомендаций акцентируют внимание на том, что ЛГ нельзя достоверно исключить по значению СТР, определенному эхокардиографически. Поэтому при постановке диагноза ЛГ даже при казалось бы невысоких значениях СТР следует принимать во внимание другие ЭхоКГ-признаки данной патологии (табл. 2).
Измерение среднего давления в ЛА (ДЛАср) методом допплерографии. ДЛАср определяют по спектру кровотока в ЛА, измеренного на уровне ее клапанов в режиме импульсноволнового допплера (PW-допплер).
Существуют различные формулы для расчета ДЛАср:
– наиболее распространен метод Китабатаке: AcT/ET (рис. 7), где AcT – время ускорения кровотока в ЛА (мс); ET – общая длительность кровотока в ЛА (мс). Полученное соотношение подставляют в специальную номограмму и рассчитывают ДЛАср. Чем выше среднее давление в ЛА, тем короче АсТ:
– ДЛАср = 0,61 СДЛА + 2;
– ДЛАср = 79-0,45 × АсТ;
– ДЛАср = 2/3 ДДЛА + 1/3 СДЛА, где ДДЛА – диастолическое давление в ЛА (мм рт. ст.).
При наличии регургитации на клапане ЛА, что нередко наблюдается вследствие дилатации ее ствола при ЛГ, ДЛАср можно вычислить по раннему диастолическому пику струи легочной регургитации. Градиент давления между ЛА и ПЖ, рассчитанный по формуле Бернулли, отражает среднее давление в ЛА (рис. 8).
Допплер-ЭхоКГ позволяет также неинвазивно оценить ДДЛА, которое отражает давление заклинивания в легочных капиллярах.
ДДЛА = конечно-диастолический градиент легочной регургитации + давление в правом предсердии.
Конечно-диастолический градиент давления легочной регургитации определяют с помощью уравнения Бернулли, по скорости струи легочной регургитации в конце диастолы (рис. 9); ДПП рассчитывают по методике, приведенной выше.
Определение резистентности легочных сосудов (pulmonary vascular resistance, PVR) методом допплер-ЭхоКГ. PVR – важный гемодинамический показатель, необходимый для диагностики ЛГ. Расчет PVR дает возможность определить этиологию ЛГ (пост- или прекапиллярная), оценить эффективность ее лечения и прогноз.
Несмотря на то что катетеризация правых отделов сердца является наиболее точным методом измерения PVR, допплер-ЭхоКГ позволяет неинвазивно определить этот параметр.
Резистентность сосудов измеряют в единицах Вуда (Wood’s units, wu):
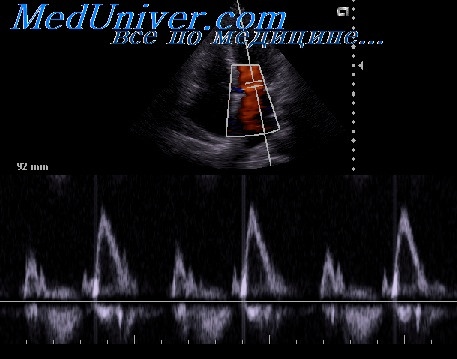
PVR (Wood’s units) = [Peak TR velocity (m/s) / RVOT velocity time integral (cm)] × 10 + 0,16, где Peak TR velocity – максимальная СТР (рис. 10, а); RVOT – интеграл «время-скорость» спектра кровотока в выходном отделе ПЖ (рис. 10, б).
В норме PVR 18 мм: годичная выживаемость – 94%, двухлетняя – 88%;
– TAPSE 01.02.2022 Кардіологія Моксонідин: «центральний гравець» у веденні артеріальної гіпертензії
Артеріальна гіпертензія (АГ) є причиною більшої кількості смертей, ніж COVID‑19, а в доковідні роки – ніж усі інфекційні хвороби разом [1]. Отже, на сьогодні людство програє боротьбу з АГ – «вбивцею» № 1 у світі. І це попри наявність чітких міжнародних і національних настанов і великої кількості антигіпертензивних препаратів (АГП) різних класів.
За останні кілька років життя українського народу суттєво змінилося. Коронавірусна інфекція (COVID‑19) призвела до змін у всіх сферах діяльності. Зокрема, варто відзначити негативний вплив хвороби, соціальних обмежень та вимушеної самоізоляції на психоемоційний стан людей. Про те, як захистити серцево-судинну й нервову системи в умовах стресу, розповів завідувач кардіологічного відділення для хворих на гострий інфаркт міокарда із блоком інтенсивної терапії Київської міської клінічної лікарні № 5, завідувач кафедри внутрішніх та професійних захворювань Київського медичного університету, д. мед. н., професор Валерій Володимирович Батушкін.
Синдром обструктивного апное сну (СОАС) є частим і недостатньо діагностованим розладом дихання під час сну, поширеність якого зросла від 10 до 30‑50% у загальній популяції та до 66% у пацієнтів із гострим інфарктом міокарда (ІМ) з елевацією сегмента ST. Захворюваність на СОАС збільшується з віком, в осіб з ожирінням та серед чоловіків. Враховуючи старіння населення та пандемію ожиріння в усьому світі, тягар СОАС, імовірно, посилюватиметься. Ішемічна хвороба серця (ІХС) є основною причиною захворюваності та смертності в розвинених країнах. СОАС частіше спостерігається у пацієнтів з ІХС (26‑69%) порівняно із загальною популяцією. Цей огляд літератури присвячений аналізу даних щодо зв’язку ІХС і СОАС, а також впливу цього синдрому на ІХС із метою поліпшення поінформованості лікарів щодо потенційних ризиків, покращення діагностики СОАС, своєчасного призначення відповідного лікування і поліпшення прогнозу для таких хворих. .
Від самого початку пандемії COVID‑19 перед лікарями усіх спеціальностей та кардіологами зокрема постала низка питань щодо ведення пацієнтів із серцево-судинними (СС) захворюваннями, але відповіді на деякі з них не отримано і до сьогодні. Враховуючи недостатню кількість даних доказової медицини щодо менеджменту осіб із гострим коронарним синдромом (ГКС) в умовах COVID‑19 та обмежені дані реальної клінічної практики, член-кореспондент НАМН України, президент Асоціації з невідкладної кардіології, віце-президент Асоціації кардіологів України, керівник відділу реанімації та інтенсивної терапії ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України, д. мед. н., професор Олександр Миколайович Пархоменко запросив до участі у науковому вебінарі президента Асоціації анестезіологів України, завідувача кафедри анестезіології та інтенсивної терапії Національного медичного університету імені О.О. Богомольця, д. мед. н., професора Сергія Олександровича Дуброва з метою обговорення й пошуку рішень щодо ефективної та безпечної профілактики артеріальних і венозних тромбозів у пацієнтів із ГКС та COVID‑19. Незважаючи на те, що захід відбувся 09 лютого 2021 р., ключові питання залишаються вкрай актуальними і сьогодні. У вебінарі також взяли участь д. мед. н. Я.М. Лутай (м. Київ), к. мед. н. І.В. Кузнецов (м. Харків), к. мед. н. І.М. Січкарук (м. Луцьк), к. мед. н. В.О. Колесник (м. Одеса). .
http://alfa-med.su/article/ehokardiografiya-pri-legochnoj-gipertenzii-prodolzhenie
http://www.health-ua.com/article/25151-ehokardiografiya-v-diagnostike-legochnoj-gipertenzii