Уравнение нернста для хингидронного электрода
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
3.5 ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
3.5.4 Классификация электродов
По типу электродной реакции все электроды можно разделить на две группы (в отдельную группу выделяются окислительно-восстановительные электроды, которые будут рассмотрены особо в разделе 3.5.5).
Электроды первого рода
К электродам первого рода относятся электроды, состоящие из металлической пластинки, погруженной в раствор соли того же металла. При обратимой работе элемента, в который включен электрод, на металлической пластинке идет процесс перехода катионов из металла в раствор либо из раствора в металл. Т.о., электроды первого рода обратимы по катиону и их потенциал связан уравнением Нернста (III.40) с концентрацией катиона (к электродам первого рода относят также и водородный электрод).
Электроды второго рода
Электродами второго рода являются электроды, в которых металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона и зависимость их электродного потенциала от температуры и концентрации аниона может быть записана в следующем виде:
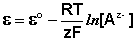
Для определения электродного потенциала элемента необходимо измерить ЭДС гальванического элемента, составленного из испытуемого электрода и электрода с точно известным потенциалом – электрода сравнения . В качестве примеров рассмотрим водородный, каломельный и хлорсеребряный электроды.
Водородный электрод представляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий ионы водорода. Адсорбируемый платиной водород находится в равновесии с газообразным водородом; схематически электрод изображают следующим образом:
Электрохимическое равновесие на электроде можно рассматривать в следующем виде:
Потенциал водородного электрода зависит от активности ионов Н + в растворе и давления водорода; потенциал стандартного водородного электрода (с активностью ионов Н + 1 моль/л и давлением водорода 101.3 кПа) принят равным нулю. Поэтому для электродного потенциала нестандартного водородного электрода можно записать:
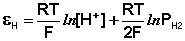
Каломельный электрод . Работа с водородным электродом довольно неудобна, поэтому в качестве электрода сравнения часто используется более простой в обращении каломельный электрод, величина электродного потенциала которого относительно стандартного водородного электрода точно известна и зависит только от температуры. Каломельный электрод состоит из ртутного электрода, помещенного в раствор КСl определенной концентрации и насыщенный каломелью Hg2Сl2:
Каломельный электрод обратим относительно анионов хлора и уравнение Нернста для него имеет вид:
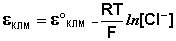
Хлорсеребряный электрод . В качестве электрода сравнения используют также другой электрод второго рода – хлорсеребряный, представляющий собой серебряную проволоку, покрытую хлоридом серебра и помещённую в раствор хлорида калия. Хлорсеребряный электрод также обратим относительно анионов хлора:
Величина потенциала хлорсеребряного электрода зависит от активности ионов хлора; данная зависимость имеет следующий вид:
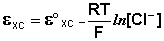
Чаще всего в качестве электрода сравнения используется насыщенный хлорсеребряный электрод, потенциал которого зависит только от температуры. В отличие от каломельного, он устойчив при повышенных температурах и применим как в водных, так и во многих неводных средах.
Электроды, обратимые относительно иона водорода, используются на практике для определения активности этих ионов в растворе (и, следовательно, рН раствора) потенциометрическим методом, основанном на определении потенциала электрода в растворе с неизвестным рН и последующим расчетом рН по уравнению Нернста. В качестве индикаторного электрода может использоваться и водородный электрод, однако работа с ним неудобна и на практике чаще применяются хингидронный и стеклянный электроды.
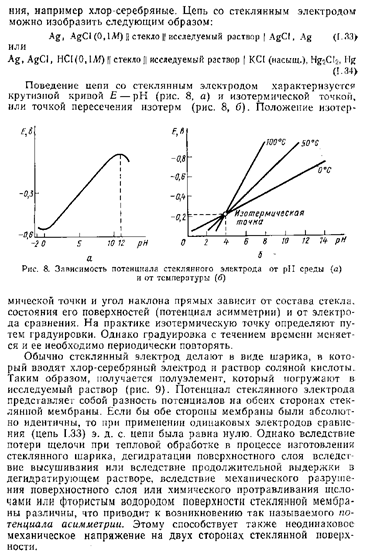
Хингидронный электрод , относящийся к классу окислительно-восстановительных электродов (см. ниже), представляет собой платиновую проволоку, опущенную в сосуд с исследуемым раствором, в который предварительно помещают избыточное количество хингидрона С6Н4О2·С6Н4(ОН)2 – соединения хинона С6Н4О2 и гидрохинона С6Н4(ОН)2, способных к взаимопревращению в равновесном окислительно-восстановительном процессе, в котором участвуют ионы водорода:
Хингидронный электрод является т.н. окислительно-восстановительным электродом (см. разд. 3.5.5); зависимость его потенциала от активности ионов водорода имеет следующий вид:
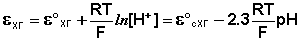
Стеклянный электрод , являющийся наиболее распространенным индикаторным электродом, относится к т.н. ионоселективным или мембранным электродам. В основе работы таких электродов лежат ионообменные реакции, протекающие на границах мембран с растворами электролитов; ионоселективные электроды могут быть обратимы как по катиону, так и по аниону.
Принцип действия мембранного электрода заключается в следующем. Мембрана, селективная по отношению к некоторому иону (т.е. способная обмениваться этим ионом с раствором), разделяет два раствора с различной активностью этого иона. Разность потенциалов, устанавливающаяся между двумя сторонами мембраны, измеряется с помощью двух электродов. При соответствующем составе и строении мембраны её потенциал зависит только от активности иона, по отношению к которому мембрана селективна, по обе стороны мембраны.
Наиболее часто употребляется стеклянный электрод в виде трубки, оканчивающейся тонкостенным стеклянным шариком. Шарик заполняется раствором НСl с определенной активностью ионов водорода; в раствор погружен вспомогательный электрод (обычно хлорсеребряный). Потенциал стеклянного электрода с водородной функцией (т.е. обратимого по отношению к иону Н + ) выражается уравнением
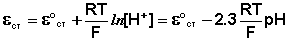
Необходимо отметить, что стандартный потенциал ε °ст для каждого электрода имеет свою величину, которая со временем изменяется; поэтому стеклянный электрод перед каждым измерением рН калибруется по стандартным буферным растворам с точно известным рН.
3.5.5 Окислительно-восстановительные электроды
В отличие от описанных электродных процессов в случае окислительно-восстановительных электродов процессы получения и отдачи электронов атомами или ионами происходят не на поверхности электрода, а только в растворе электролита. Если опустить платиновый (или другой инертный) электрод в раствор, содержащий двух- и трехзарядные ионы железа и соединить этот электрод проводником с другим электродом, то возможно либо восстановление ионов Fe 3+ до Fe 2+ за счет электронов, полученных от платины, либо окисление ионов Fe 2+ до Fe 3+ с передачей электронов платине. Сама платина в электродном процессе не участвуют, являясь лишь переносчиком электронов. Такой электрод, состоящий из инертного проводника первого рода, помещенного в раствор электролита, содержащего один элемент в различных степенях окисления, называется окислительно-восстановительным или редокс-электродом . Потенциал окислительно-восстановительного электрода также определяют относительно стандартного водородного электрода:
Pt, H2 / 2H + // Fe 3+ , Fe 2+ / Pt
Зависимость потенциала редокс-электрода ε RO от концентрации (активности) окисленной [Ox] и восстановленной форм [Red] для окислительно-восстановительной реакции, в которой не участвуют никакие другие частицы, кроме окислителя и восстановителя, имеет следующий вид (здесь n – число электронов, участвующих в элементарном акте окислительно-восстановительной реакции):
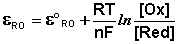
Из данного выражения следует уравнение для потенциала металлического электрода (III.40), т.к. активность атомов металла (восстановленной формы) в материале электрода равна единице.
В случае более сложных систем в выражении для окислительно-восстановительного потенциала фигурируют концентрации всех участвующих в реакции соединений, т.е. под окисленной формой следует понимать все соединения в левой части уравнения реакции
а под восстановленной – все соединения в правой части уравнения. Так, для окислительно-восстановительных реакций, протекающих с участием ионов водорода
уравнение Нернста будет записываться следующим образом:
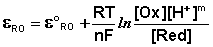
При составлении гальванических элементов с участием редокс-электрода электродная реакции на последнем в зависимости от природы второго электрода может быть либо окислительной, либо восстановительной. Например, если составить гальванический элемент из электрода Pt / Fe 3+ , Fe 2+ и второго электрода, имеющего более положительный электродный потенциал, то при работе элемента редокс-электрод будет являться анодом, т.е. на нем будет протекать процесс окисления:
Если потенциал второго электрода будет меньше, чем потенциал электрода Pt / Fe 3+ , Fe 2+ , то на последнем будет протекать реакция восстановления и он будет являться катодом:
Знание величин электродных потенциалов позволяет определить возможность и направление самопроизвольного протекания любой окислительно-восстановительной реакции при одновременном наличии в растворе двух или более окислительно-восстановительных пар. Восстановленная форма любого элемента или иона будет восстанавливать окисленную форму другого элемента или иона, имеющего более положительный электродный потенциал.
Copyright © С. И. Левченков, 1996 — 2005.
Физическая и коллоидная химия (стр. 15 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 |
в) Зависимость потенциала от рН позволяет использовать хингидронный электрод для измерения рН. Правда, в этих целях он применим в области значений рН, не больших 8. Дело в том, что в щелочной среде гидрохинон ведет себя как слабая кислота, т. е. теряет протоны, отчего они перестают фигурировать в уравнении полуреакции.
15.6. Ионоселективные электроды
1. Особенность данных электродов состоит в том, что они включают такую
(обычно твердую) фазу, которая избирательно высвобождает в раствор или
сорбирует из него те или иные ионы. Это приводит к созданию разности
потенциалов.

Другое отличие от устройства, представленного на рис. 15.3, состоит в том, что внутренней средой является раствор HCl, а не KCl.
б) В качестве второго полуэлемента в полной цепи (рис. 15.4) можно взять обычный хлорсеребряный электрод, имеющий на конце микрощель. Оба электрода погружены в раствор, где надо измерить рН.
 |
3. а) Принцип действия основан на том, что стеклянный электрод долго находится в воде. При этом в поверхностном слое стекла происходит гидролиз
силиката Na:
ионы водорода частично переходят в раствор, что создает разность потенциалов
(∆Ψ) между поверхностью и жидкой средой. Ясно, что величина ∆Ψ зависит от концентрации ионов H+ в растворе.
б) Причем, в данном случае у нас — две поверхности:
— внутренняя, где скачок потенциала (∆Ψin) постоянен и определяется раствором НСl внутри стеклянного электрода;
— внешняя, где скачок потенциала (∆Ψex) зависит от рН исследуемого раствора.
Следовательно, зависит от рН и разность потенциалов, измеряемая в элементе между внутренней и внешней средами.
 |
в) Аналогично (15.21), получается:
15.7. Другие способы классификации электродов
Кроме вышеизложенного, существуют и другие принципы подразделения электродов и элементов. Так, и те, и другие могут быть обратимыми и
необратимыми.
1. а) Обратимые электроды таковы, что если с помощью внешней ЭДС изменить направление тока в цепи на противоположное, в полуэлементе пойдет
обратная полуреакция.
б) В элементе Даниэля—Якоби оба электрода — обратимые:
 |
в) Обратимые электроды, в свою очередь, могут быть двух видов.
I. Обратимые по катиону: электроды и раствор обмениваются катионами. В
основном, это электроды первого рода: электроды элемента Даниэля–Якоби
(медный и цинковый), водородный электрод и др. Потенциал таких электродов определяется активностью соответствующего катиона в растворе.
II. А в обратимых по аниону электродах происходит обмен (между твердой
фазой и раствором) анионами; соответственно, от их концентрации и зависит
потенциал электрода. Очевидно, сюда относятся электроды второго рода.
2. а) А каковы необратимые электроды и элементы? В этом случае при изменении направления тока (с помощью внешней цепи) происходит не та реакция, которая обратна исходной, а другая.

 |
В нем цинковая и медная пластинки погружены в один и тот же раствор.
I. При отсутствии внешней ЭДС (рис. 15.5,а) происходят те же реакции, что в элементе Даниэля–Якоби:
 |
т. е. цинковая пластинка растворяется, а медная — утолщается. Но если изменить направление тока (рис. 15.5,б), будет происходить электролиз, и на цинковой пластинке будет выделяться не цинк, а медь — потому что сродство к электронам у неё выше, чем у цинка.
3. Наконец, отметим еще одно подразделение гальванических элементов:
с переносом и без переноса.
а) В элементах с переносом есть граница между жидкими фазами полуэлементов, и поэтому при замыкании цепи происходит перенос ионов (по солевому мостику) из одной среды в другую. Сюда относится большинство известных нам элементов.
б) В элементах же без переноса нет границы между жидкими фазами. Приме-
ры — элементы Вольта (рис. 15.5, а) и Вестона (рис. 15.1).
1. Нам осталось рассмотреть последний вопрос этого раздела — измерение ЭДС гальванических элементов в целях физико-химического анализа. Данный подход обозначается как потенциометрия. Возможные его применения весьма многообразны.
а) Например, найдя для OB-реакции ∆Ψрц (при нескольких температурах), можно рассчитать термодинамические параметры этой реакции — ∆Gрц, ∆G0рц, Kp, ∆Н0рц и ∆S0рц.
б) С помощью потенциометрии определяют также характеристики растворенного вещества:
— коэффициент активности сильного электролита (активность рассчитывают по формуле Нернста и сравнивают с реальной концентрацией),
— константу кислотности слабого электролита (в эквимолярной буферной
смеси, составленной с участием этого электролита, рН совпадает с pKa), и т. д.
2. Подробней остановимся на потенциометрическом титровании.
а) Это метод, используемый для определения концентрации какого-либо вещества (электролита). – Составляют гальванический элемент; в полуэлемент с исследуемым раствором последовательно добавляют титрант и измеряют каждый раз ЭДС элемента.
б) В критической точке титрования происходит резкое изменение ЭДС.

а) Пусть требуется определить в растворе концентрацию соли FeCl3. Составим гальванический элемент (рис. 15.6): один электрод водородный, другой — редокс-электрод с изучаемым раствором FeCl3.
б) В принципе, некоторое количество ионов Fe3+ могло бы восстанавливаться за счет окисления H2. Но из-за высокого сопротивления во внешней цепи этот процесс совершенно незначителен. Поэтому до титрования в левом полуэлементе ОВ-пары ещё нет, так как имеется только один ее компонент — ионы Fe3+.
 |
в) Начнем добавлять к раствору FeCl3 в данном полуэлементе раствор соли SnCl2 . Будет происходить реакция:
Поскольку появятся ионы Fe2+, то образуется пара Fe3+/Fe2+, и измеряемая ЭДС будет определяться соотношением её компонентов:
 |

Б. В критической точке титрования (КТТ) будет оттитровано всё количество Fe3+, так что в растворе останутся только продукты реакции – ионы Fe2+ и Sn4+, т. е. ОВ-пары в растворе вновь больше нет. Но определить прохождение системой КТТ можно лишь после дальнейшего титрования.
 |
д) А. Действительно, при добавлении очередных порций раствора SnCl2 в системе возникнет новая ОВ пара – Sn4+/Sn2+, и теперь ЭДС определяется ею (ветвь II на рис. 15.7):
Б. По мере добавления SnCl2 соотношение c(Fe3+)/c(Fe2+) тоже падает, так что ΔΨ продолжает снижаться.
е) Но теперь критический объём титрования (VКТТ) легко определить по точке перегиба кривой – от ветви I к ветви II. Тогда, зная количество соли в этом объёме, можно найти и количество исчезнувшей соли FeCl3 (оно в 2 раза больше), а значит и концентрацию FeCl3 в исходном растворе.
ж) Кроме того, можно оценить и стандартные редокс-потенциалы обеих ОВ пар, если они неизвестны. Действительно,
а при V1 = 2 VКТТ ΔΨ = Ψ0 (Sn4+/Sn2+) (15.29, а-б)
Заметим, что самомỳ критическому объёму (VКТТ ) соответствует такое ΔΨ, которое равно среднему арифметическому значению Ψ0 (Fe3+/Fe2+) и Ψ0 (Sn4+/Sn2+).
 |
Краткое содержание главы 15
В этой главе продолжалось рассмотрение гальванических элементов.
1. В частности, в обобщённом виде природу элемента записывают так:
При этом гальванические элементы делятся на
ХИМИЧЕСКИЕ — полуэлементы различны по природе, и
КОНЦЕНТРАЦИОННЫЕ — оба полуэлемента одинаковы по природе, но различаются по концентрации компонентов.
Сами же электроды (полуэлементы) подразделяют на 4 группы.
I. ЭЛЕКТРОДЫ ПЕРВОГО РОДА – M│M2+, включают ПРОСТОЕ ВЕЩЕСТВО И ПРОСТОЙ ИОН этого вещества.
Примеры: электроды элемента Даниэля–Якоби — Zn│Zn2+ и Cu│Cu2+, водородный электрод — (Pt)H+│H, амальгамный электрод в элементе Вестона — Cd(в Hg) │Cd2+.
II. ЭЛЕКТРОДЫ ВТОРОГО РОДА — КатАн↓|M|Ан. Здесь — три компонента:
ПРОСТОЕ ВЕЩЕСТВО (М), его ТРУДНОРАСТВОРИМАЯ СОЛЬ (КатАн), а также
РАСТВОРИМЫЙ ИОН данной соли (Ан). Примеры: ртутно–сульфатный электрод
элемента Вестона — Hg2SO4|Hg|SO42-, каломельный электрод — Hg2Cl2|Hg(Pt)Cl-, хлорсеребряный электрод — AgCl|Ag|Cl-.
III. РЕДОКС-ЭЛЕКТРОДЫ: все компоненты полуреакции (Ох и Rd) находятся в растворе.
Примеры: пара 
IV. ИОНОСЕЛЕКТИВНЫЕ ЭЛЕКТРОДЫ: включают твердую фазу, которая избирательно сорбирует из раствора те или иные ионы. Пример — СТЕКЛЯННЫЙ электрод, используемый для измерения рН.
4. Кроме того, электроды могут быть ОБРАТИМЫМИ по катиону или аниону.
Обратимыми являются и составленные из них элементы.
НЕОБРАТИМЫЕ же элементы таковы, что при изменении направления тока происходит не реакция, обратная исходной, а другая. Пример — элемент Вольта:
5. Наконец, элементы делят еще по-иному: С ПЕРЕНОСОМ и БЕЗ ПЕРЕНОСА. В
последнем случае нет границы между жидкими фазами (пример – тот же элемент Вольта).
6. Составление гальванических элементов и измерение их ЭДС может служить для физико-химического анализа, что обозначается как ПОТЕНЦИОМЕТРИЯ. В частности, при ПОТЕНЦИОМЕТРИЧЕСКОМ ТИТРОВАНИИ в критической точке титрования резко меняется ЭДС элемента. Это позволяет оценить концентрации веществ и стандартные редокс-потенциалы.
ЗАДАЧИ К РАЗДЕЛУ 3
Решение
Действуем по формуле (13.2):
 |
Na+ C2O42– Cu+ SO42– H+ CH3 COO–
При расчёте этой суммы двумя последними слагаемыми можно пренебречь (а значит, не рассчитывать степень диссоциации α) по двум причинам:
— во-первых, в растворе отсутствуют основания (щёлочи), а в нейтральной и кислой среде степень диссоциации (α) уксусной кислоты очень мала (11.29,б);
— во-вторых, концентрация уксусной кислоты (c3) на порядок ниже концентрации остальных компонентов раствора, так что даже при большей диссоциации вклад этой кислоты в ионную силу был бы весьма мал.
 |
2. Имеется раствор СаCl2 c концентрацией с = 0,002 М при 25оС. Оценить коэффициент активности ионов Са2+ с помощью предельного закона Дебая-Хюккеля. Фигурирующий в этом законе коэффициент считать равным А ≈ 0,52 √1/M.
Решение
а) Ионная сила раствора:
Первый член в этой сумме относится к ионам Са2+, второй – к ионам Сl– .
б) Для оценки коэффициента активности ионов Са2+ используем формулу (13.15):

Как видно, даже в таком относительно разбавленном растворе (0,002 М) коэффициент активности ионов существенно меньше единицы. Правда, при использовании более точной формулы расчёта (13.16) результат оказывается несколько выше (13.18,а-б).
3. Требуется приготовить V = 1 л натрий-фосфатного буфера с рН =6,6 и ионной силой I = 0,1. Определить количество необходимых (не считая воды) компонентов (в молях). Значения рКа для фосфорной кислоты таковы (рис. 12.2):
Решение
а) Заданное значение рН (6,23) лежит во второй буферной зоне фосфорной кислоты, в которой существуют следующие две её формы:
Н2РО4– ↔ Н+ + НРО42– , рКа.2 = 7,2 . (III.4)
Таким образом, требуются две натриевые соли: NaН2РО4 (“кислота”) и Na2НРО4 (“соль”).
б) Соотношение, в котором они должны быть взяты, находим из уравнения Гендерсона-Хассельбаха (12.3):
рН = рКа.2 + lg (сс /ск ), откуда lg (сс /ск ) = – 0,6 и сс /ск ≈ 0,25 . (III.5,а-в)
в) Количество же солей определяется условием, наложенным на ионную силу:
Na+ из “соли” Na+ из “к-ты” HPO42– H2PO4–
г) Подставляя в это уравнение сс = 0,25 ск (из III.5,в), легко находим искомые концентрации компонентов в составляемой буферной системе:
ск ≈ 0,057 моль/л ; сс ≈ 0,014 моль/л . (III.7,а)
Поскольку требуемый объём раствора – 1 л, то таковы же по величине и количества солей, необходимые для приготовления системы:
4. Пусть имеется буферный раствор, рассмотренный в предыдущей задаче.
Какое количество одноосновной сильной кислоты надо добавить к этому раствору (объёмом V= 1л и с рН = 6,6) для понижения рН на 1 (т. е. до 5,6)?
И до какого значения упал бы рН раствора (при исходном уровне 6,6) под влиянием того же количества кислоты в отсутствие буферной системы?
Решение
 |
а) Понижение рН буферной системы на 1: требуемое увеличение концентрации сильной кислоты (согласно (12.19,б)), а также количество этой кислоты, необходимое для внесения в раствор, таковы:
б) Безбуферная система: значение рН = 6,6 говорит о том, что в растворе имеется небольшое количество кислоты, причём сильной (поскольку буферные свойства отсутствуют). Концентрация водородных ионов при этом равна
Дополнительное повышение концентрации сильной кислоты на А = 0,012 моль/л доводит концентрацию водородных ионов и рН до следующих значений:
в) Замечание: разница между снижением рН в буферной (до 5,6) и безбуферной (до 1,9) системах под влиянием одного и того же количества кислоты оказалась не столь значительной, как в примере (12.9 – 12.11). Тому есть две причины:
— во-первых, здесь почти на порядок ниже концентрация компонентов (а значит, и буферная ёмкость) буферной системы,
— и, во-вторых, рН=6,6 находится на заметном удалении от центра буферной зоны (рН = 7,2), т. е. значительная часть и без того небольшой буферной ёмкости уже израсходована.
5. Имеется буферный раствор, содержащий nк = 0,01 моля молочной кислоты (рКа = 3,6) и nс = 0,05 моля лактата натрия. К раствору добавлено V = 5 мл раствора HCl с концентрацией с = 0,5 моль/л.
Найти исходное значение рН буферного раствора и изменение рН после добавления кислоты.
Решение
В обоих случаях используем уравнение Гендерсона-Хассельбаха (12.3).
а) Исходное значение:
б) В раствор внесено следующее количество HCl:
 |
в) Запишем вышеуказанное уравнение для нового значения рН (рНt) и затем вычтем из него исходный вариант уравнения (для рН0). Это и приводит к искомому изменению рН:
Знак минус означает, что рН снижается, но, как видно, очень незначительно.
6. Пусть удельная проводимость (электропроводность) воды, использованной для приготовления раствора, равна χв = 1,517·10—4 1/(Ом· м) (Вообще говоря, эта величина зависит от степени очистки воды и после 40-50 перегонок может уменьшаться до 10–7–10–8 1/(Ом ·м).)
И пусть в насыщенном растворе AgBr удельная проводимость оказалась немного выше – χ0 = 1,600·10—4 1/(Ом· м). Эквивалентная проводимость AgBr в том же растворе – λ = 0,012 м2/(Ом· моль).
Найти растворимость AgBr, т. е. концентрацию его насыщенного раствора (max сэкв ), а также произведение растворимости для этой соли.
Решение
а) В насыщенном растворе AgBr самой солью обеспечивается лишь небольшая часть удельной проводимости:
б) Она связана с эквивалентной проводимостью растворённой соли соотношением (13.30):
Такова максимально возможная концентрация AgBr в воде. Всё остальное количество AgBr, вносимое в систему, будет просто переходить в осадок.
в) Поскольку растворённая соль практически полностью диссоциирует на ионы, каждый из которых имеет вышенайденную концентрацию, то произведение растворимости равно
7. Дан раствор NH3 с концентрацией сэкв = 0,011 моль/л. Удельная проводимость раствора – χ = 1,22·10-2 1/(Ом· м). А предельная эквивалентная проводимость водных растворов NH3 – λ0 = 0,027 м2/(Ом· моль).
Решение
а) Вначале по формуле (13.30) найдём эквивалентную проводимость данного раствора (не забыв перейти к одинаковым единицам объёма: сэкв = 0,011 моль/л = 11 моль/м3):
λ = χ / сэкв ≈ 1,1·10–3 м2/(Ом· моль). (III.17)
б) Теперь сопоставим её (λ) с предельной эквивалентной проводимостью растворов аммиака. Последняя соответствует предельно низким концентрациям NH3, при которых, согласно закону разведения Оствальда (п.11.4), весь аммиак находится в ионизованном состоянии NH4+ (или, что то же самое, весь гидроксид аммония NH4ОН диссоциирован).
Таким образом, согласно (13.50), степень ионизации аммиака в имеющемся растворе равна
8. Теперь пусть раствор NH3 имеет концентрацию сэкв = 0,022 моль/л и удельную проводимость χ = 1,7·10—2 1/(Ом· м). Как указывалось в задаче 7, предельная эквивалентная проводимость водных растворов NH3 – λ0 = 0,027 м2/(Ом· моль).
Найти для аммиака константу основности (Кb ) и показатели рКb и рКа.
Решение
а) Константа Kb характеризует обратимую реакцию, в которой для простоты недиссоциированной формой можно считать гидроксид аммония:
NH4OH ↔ NH4+ + OH– , Kb = [NH4+ ] · [OH–] / [NH4OH] . (III.19,a-б)
б) Для расчёта Kb вначале выполним те же два действия, что и в задаче 7: найдём эквивалентную проводимость раствора, а с её помощью – степень диссоциации:
λ = χ / сэкв = 7,7·10-–4 м2/(Ом· моль), α = λ / λ0 ≈ 0,0285 . (III.20,а-б)
в) Затем, по аналогии с выкладками (11.24–11.25), запишем:
г) Подставляя эти выражения в (III.19,б), находим Kb, а по формулам (11.11,г) и (11.35,г) – остальные два показателя:
Последний результат, в частности, означает, что при рН = 9,26 ионизировано ровно 50% частиц аммиака и что его буферной зоной на шкале рН служит интервал 9,26 ± 1,5.
Р = 101,3 кПа а = 1 М
а) В обозначении элемента заменить символы Rdi и Охi на конкретные вещества или ионы. Что можно сказать об устройстве элемента?
б) Найти ЭДС (ΔΨрц) элемента, а для вышеприведённой реакции – стандартную энергию Гиббса (ΔG0рц) и константу равновесия (Кр).
Решение
а) I. Очевидно, участниками реакции являются две окислительно-восстановительные пары: Н+/H2 и I2 /I– (напомним: в обозначении отдельной пары первой пишется окисленная форма; п. 14.7).
II. Их редокс-потенциалы таковы:
Т. е. обе пары находятся в стандартных условиях (Р(H2) = 1 атм; а(H+) = а(I–) = а(HI) = 1 M, I2 – в твёрдой фазе), и поэтому их потенциалы равны стандартным значениям.
III. Поскольку потенциал иодной пары выше, чем водородной, то последняя служит донором водорода и в связи с этим указывается в обозначении элемента первой (п.15.1). Следовательно, вышеприведенную схему элемента следует переписать так:
IV. Из исходной схемы следует также, что оба электрода погружены в один и тот же раствор HI. Т. е. это так называемый гальванический элемент без переноса (п. 15.7). По данной причине в его обозначении нельзя выполнить ещё одно правило: расположить обе восстановленные формы по краям, а обе окисленные формы – в центре (п.15.1).
б) Рассчитываем характеристики элемента и происходящей в нём химической реакции:
Два последних результата свидетельствуют о том, что реакция является фактически необратимой (4.38).
10. Гальванический элемент с ЭДС = 0,142 В состоит из насыщенного каломельного электрода (Ψк, нас = +0,242 В) и хингидронного электрода (Ψ0хг = +699 В), соединённых солевым мостиком. ЭДС элемента равна 0,142 В. Определить рН раствора, в который погружён хингидронный электрод.
Решение
а) Потенциал хингидронного электрода зависит от рН (15.21):
Ψхг = Ψ0хг – 0,059 рН . (III.26)
б) Баланс, из которого складывается ЭДС элемента, таков:
ЭДС = Ψ2 – Ψ1 = Ψхг – Ψк, нас = Ψ0хг – 0,059 рН – Ψк, нас. (III.27)
в) Подставляя значения потенциалов и ЭДС, находим: рН = 5,75.
11. Гальванический элемент с ЭДС = 0,297 В состоит из стандартного водородного электрода и медного электрода ( Ψ0 (Cu2+/Cu) = +0,337 B), погружённого в раствор СuSO4 с концентрацией с = 1 моль/л.
Определить коэффициент активности ионов Cu2+ в этом растворе.
Решение
а) Т. к. потенциал стандартного водородного электрода принимается за нуль, измеряемая ЭДС равна потенциалу медного электрода: ЭДС = Ψ (Cu2+/Cu).
б) А этот потенциал, в соответствии с уравнением Нернста, зависит от концентрации ионов меди в растворе (14.26):
в) Подставляя потенциалы, находим активность ионов меди и коэффициент активности:
12. Имеется концентрационный элемент
Какая из активностей (а1 или а2) больше по величине? Оценить ЭДС элемента, считая, что активности иона в электродах различаются в 10 раз.
Решение
а) Потенциалы электродов, зависящие от аииона, по аналогии с (15.10), определяются формулой вида
б) Тогда для ЭДС концентрационного элемента получаем:
в) В любом гальваническом элементе ЭДС – положительная величина (это следует из того, что для самопроизвольной реакции ΔG0рц a2 . (III.32)
Это соответствует и правилам записи гальванических элементов (пп. 14.7 и 15.1): индекс 1 присваивается тому элементу, который служит донором электронов. Здесь, очевидно, это электрод с большей концентрацией отрицательных ионов.
Глава 16. ВВЕДЕНИЕ В ХИМИЧЕСКУЮ КИНЕТИКУ
16.1. Предмет кинетики
1. Новый раздел посвящен кинетике химических реакций. Кинетика — это
учение о скоростях различных процессов и механизме их протекания. Имеются
в виду те процессы, которые, в принципе, могли бы протекать по своим
термодинамическим характеристикам.
2. Почему важны кинетические характеристики реакций?
а) Начнём с того, что реакции, возможные термодинамически,
I. в одних случаях протекают очень энергично (пример — взрыв смеси O2
и 2H2, т. е. гремучего газа),
II. в других случаях имеют умеренную скорость,
III. в третьих — вообще в обычных условиях не проходят.
б) Вот два примера реакций последнего типа:
 |
Обе реакции в обычных условиях фактически не протекают. Как известно, и сахароза, и глюкоза могут храниться весьма долго.
Окислительно-восстановительные электроды: определение, примеры, электродные полуреакции. Вывод и анализ уравнения Нернста для электродов данного типа.
Окислительно-восстановительные электроды (редокс-электроды) – система из химически инертного металла, погруженного в раствор, содержащий окисленную и восстановленную формы элемента.
Для окислительно-восстановительных электродов характерно, что в процессе их работы катионы и анионы, изменяя степень окисления, не выделяются на электроде из химически инертного металла. Металлический проводник в данном случае является лишь «посредником» в передаче электронов от одной формы элемента к другой. Обычно в качестве металлического проводника используют платину, реже – ртуть, золото.
Потенциалы окислительно-восстановительных электродов зависят, в первую очередь, от соотношения активностей (концентраций) потенциалопределяющих ионов в растворе. Увеличение концентрации окисленной формы (или уменьшение концентрации восстановленной формы) приводит к возрастанию потенциала электрода. Вместе с тем, ионы (вещества), не участвующие в электродных реакциях (индифферентные), изменяют ионную силу раствора, а, следовательно, и коэффициент активности и активность потенциалопределяющих ионов. Это опять же приводит к изменению потенциала электрода. Те вещества, которые вступают в химическое взаимодействие с потенциалопределяющими ионами, также влияют на потенциалы электродов.
Для оценки влияния различных веществ на потенциалы электродов составляются гальванические элементы, содержащие электрод сравнения.
Окислительно-восстановительные электроды можно разделить на простые и сложные.
| Простые | Cложные |
Электродная реакция сводится к изменению заряда ионов без изменения их состава: Fe 3+ + e = Fe 2+ Fe(CN)6 3- + e = Fe(CN)6 4- В общем виде: Ох + ze = Red Схема простого окислительно-восстановительного электрода: Red, Ox | Pt EOx,Red = E o Ox,Red +  ln ln  | Реакции протекают с изменением заряда реагирующих частиц и их состава (в таких реакциях обычно участвуют ионы Н + , ОН — и молекулы воды). Примеры сложные окислительно-восстановительных электродов: 1) В электродной реакции обмен электронами протекает между анионами и катионами, в состав которых входит один и тот же металл. Схема: MnO4 — , Mn 2+ , H + |Pt MnO4 — +8H + + 5e = Mn 2+ + H2O, EMnO4-, Mn2+, H+ = E o MnO4-, Mn2+, H+ + 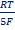 ln ln 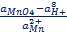 Т.е. электродный потенциал зависит не только от соотношения активностей окисленной и восстановленной форм элемента, но и от кислотности среды. 2) В окислительно-восстановительной реакции участвует одно или несколько твердых веществ: Схема: MnO4 — , H + , MnO2(тв)|Pt MnO4 — +4H + + 3e = MnO2 + 2H2O EMnO4-, H+, MnO2 = E o MnO4-, H+, MnO2+ Т.е. электродный потенциал зависит не только от соотношения активностей окисленной и восстановленной форм элемента, но и от кислотности среды. 2) В окислительно-восстановительной реакции участвует одно или несколько твердых веществ: Схема: MnO4 — , H + , MnO2(тв)|Pt MnO4 — +4H + + 3e = MnO2 + 2H2O EMnO4-, H+, MnO2 = E o MnO4-, H+, MnO2+  ln(a 4 H+aMnO4-) 3) Хингидронный электрод С6Н4О2*С6Н4(ОН)2 = С6Н4О2 + С6Н4(ОН)2 Хинон ( Ox ) Гидрохинон ( H 2 R ) С6Н4О2 + 2H + + 2e = С6Н4(ОН)2 EOx,H+,H2R = E o Ox,H+,H2R + ln(a 4 H+aMnO4-) 3) Хингидронный электрод С6Н4О2*С6Н4(ОН)2 = С6Н4О2 + С6Н4(ОН)2 Хинон ( Ox ) Гидрохинон ( H 2 R ) С6Н4О2 + 2H + + 2e = С6Н4(ОН)2 EOx,H+,H2R = E o Ox,H+,H2R + 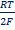 ln ln 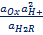 В приближенной теории хингидронного электрода считают, что концентрация хинона и гидрохинона в растворе примерно одинаковы и коэффициенты активности этих соединений имеют близкие значения, то и их активности одинаковы. При этом уравнение упрощается: EOx,H+,H2R = E o Ox,H+,H2R + В приближенной теории хингидронного электрода считают, что концентрация хинона и гидрохинона в растворе примерно одинаковы и коэффициенты активности этих соединений имеют близкие значения, то и их активности одинаковы. При этом уравнение упрощается: EOx,H+,H2R = E o Ox,H+,H2R +  ln ln 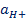 Таким образом, потенциал хингидронного электрода определяется водородным показателем раствора (рН = -lg Таким образом, потенциал хингидронного электрода определяется водородным показателем раствора (рН = -lg 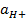 ) и его можно использовать как индикаторный при измерениях рН среды. ) и его можно использовать как индикаторный при измерениях рН среды. |
Величина стандартного окислительно-восстановительного потенциала характеризует свойства окислителей и восстановителей, а именно: чем выше Е 0 , тем более сильным окислителем являются ионы в высшей степени окисления.
Окислительно-восстановительные ( Ox — Red — ) электроды. Приведите пример Ox — Red — электрода, потенциал которого зависит от pH раствора. Запишите электродную реакцию и уравнение Нернста, назовите все используемые величины.
Уравнение Нернста:
http://pandia.ru/text/78/330/1243-15.php
http://megaobuchalka.ru/15/3529.html