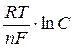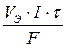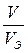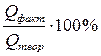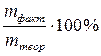ОCНОВНЫЕ ПОНЯТИЯ. ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ. ЗАКОНЫ ФАРАДЕЯ.
Одним из важнейших элементов внутренней цепи является граница раздела электрод-ионный проводник. На этой границе возникает так называемый двойной электрический слой, характеризуемый сложным взаимодействием металла с компонентами раствора, которое приводит к скачку потенциала, который называют электродным потенциалом. Величина этого скачка потенциала зависит от природы электрода, состава электролита и температуры. Абсолютное значение электродного потенциала определить нельзя, но можно измерить разность потенциалов между двумя электродами. Такой электродный потенциал принято обозначать 
Ox + n 

Электродный потенциал в отсутствии тока в цепи при равновесии потенциалопределяющей реакции называется равновесным и обозначается 




В электрохимии общепринятой является водородная шкала потенциалов, в которой за нуль принят потенциал стандартного водородного электрода при 298 К; 


Потенциалопределяющей на таком электроде является реакция
2H + (p) + 2 

Значения стандартных потенциалов электродов в водных растворах при 298 К, определенные по водородной шкале представлены в таблице 1 Приложения.
Значения равновесных потенциалов для условий, отличительных от стандартных, рассчитывают по уравнению Нернста, которое в общем случае для потенциалопределяющей реакции (1.1) имеет вид:
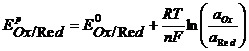
где – R – универсальная газовая постоянная, 8,31Дж/моль . К; n – число электронов, принимающих участие в реакции (равно числу моль эквивалентов в моль вещества); F – число Фарадея, 96500 Кл/моль-экв (26,8А . ч/моль-экв); T – температура, К.
Существует 3 различных типов электродов: 1) металлические (металлы в растворе собственных ионов); 2) газовые (на основе Pt в растворе электролита, через который пропускает соответствующий газ); 3) окислительно-восстановительные (инертный электрод в растворе, содержащей окисленную и восстановленную формы в ионном виде – редокс-электроды).
Для металлических электродов потенциалопределяющей является реакция :
M(р) n + + n 

Уравнение Нернста для расчета потенциала металлического электрода, поскольку активность твердой фазы принимают равной единице, имеет вид:

Для 298 К, переходя к десятичному логарифму, имеем
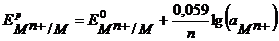
Для водородного электрода потенциалопределяющая реакция (1.2), уравнение Нернста запишем в виде:

Поскольку, как указано выше, 


Газовый кислородный электрод представляет собой Pt – электрод, на котором осуществляется потенциалопределяющая реакция
О2 + 4 

Уравнение Нернста для такого электрода запишется в виде:

Стандартный потенциал кислородного электрода 




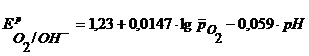
Законы Фарадея. Количественно электрохимические превращения веществ подчиняются двум законам Фарадея:
1) масса или количество вещества, претерпевшего превращение на электроде при протекании постоянного тока, прямо пропорционально количеству прошедшего электричества;
2) при прохождении через различные электролиты одного и того же количества электричества массы различных веществ, участвующих в электродных реакциях, пропорциональны молярным массам их эквивалентов. Из этого следует, что для электрохимического превращения 1 моль эквивалента вещества требуется одинаковое количество электричества F, называемое числом Фарадея.
Оба эти закона можно объединить следующими выражениями:
— для массы вещества: 
— для объема газообразных веществ: 
где МЭ – молярнаямасса эквивалента вещества, г/моль, 
VЭ – объем моль-эквивалента газа, л/моль; 
Q – количество электричества, прошедшего через систему, Кл,

( При нормальных условиях (н.у.) 1 моль любого газа занимает объем



Количество моль-эквивалентов веществ, испытавших электрохимические превращения на катоде и аноде, выраженные в моль-эквивалентах, равны между собой
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
Гальваническим элементом (ГЭ) называется электрохимическая система, в которой химическая энергия превращается в электрическую.
Рис. 1.1. Схема гальванического элемента
Представленный на рисунке 1.1. ГЭ состоит из двух электродов 1 (катода К и анода А), погруженных в растворы собственных солей (2) и разделенных диафрагмой (3) проницаемой для ионов. Электроды через внешнюю цепь (4) соединены между собой металлическими проводниками.
При разомкнутой цепи в ГЭ на обоих электродах устанавливается равновесие, характеризуемое величиной соответствующих равновесных электродных потенциалов (ЭП). Разность равновесных ЭП катода и анода называется электродвижущей силой ГЭ:

Разность стандартных ЭПназывается стандартной ЭДС ГЭ:


При замыкании цепи равновесие нарушается, во внешней цепи возникает самопроизвольное направленное движение электронов от анода – электрода с меньшим потенциалом, к катоду – электроду с большим потенциалом.
Электродные реакции, например, для серебряно-цинкового элемента записываются следующим образом:


Суммируя анодную и катодную реакции, получаем уравнение токообразующей реакции (ТОР):
Zn + 2Ag + → 2Ag + Zn 2+ , (2.3).
Электродвижущая сила элемента связана с энергией Гиббса ТОР 

где п — количество моль-эквивалентов вещества.
В общем случае, для ТОР реакции:
bB + dD → lL + mM, (2.5),
протекающей в ГЭ при стандартных состояниях веществ при Т = 298 К, энергия Гиббса 

Таким образом стандартную ЭДС ГЭ можно определить двумя способами:
— первый способ по уравнению 
— второй способ по уравнению (2.1а), используя табличные значения стандартных потенциалов.
ЭДС гальванического элемента для ТОР при активности ионов отличных от 1 моль/л можно рассчитать из выражения:

где аВ, аD, аL , aM, – активности веществ; b, d, l, m – стехиометрические коэффициенты ТОР (2.5). Для твердых веществ активности принимают равными единице.
Максимальная электрическая работа ГЭ определяется соотношением 

В работающем ГЭ при прохождении тока I напряжение U меньше ЭДС из-за явления поляризации катода (DEК) и анода (DЕА) и омического падения напряжения на сопротивлении r1 в проводниках с электронной проводимостью (проводниках первого рода) и на сопротивлении r2 в электролите (проводнике второго рода)

Поляризацией называется изменение потенциала электрода при прохождении электрического тока: 
Зависимость потенциала электрода от тока графически изображается поляризационной кривой. В гальваническом элементе при прохождении электрического тока потенциал анода становится более положительным, а потенциал катода – более отрицательным, что приводит к уменьшению напряжения U. Поляризационные кривые ГЭ представлены на рисунке 1.2.
Рис. 1.2. Поляризационные кривые ГЭ.
Пример 1.1.Рассмотрите работу серебряно-цинкового гальванического элемента. Напишите катодные и анодные процессы, рассчитайте стандартную ЭДС элемента при 298 К двумя способами.
Решение.Выпишем из таблицы 1 приложения значения стандартных электродных потенциалов Zn и Ag:


Т.к. 
1 способ: рассчитаем 
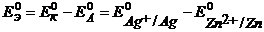
2 способ: по уравнению (2.6) рассчитываем

По уравнению 2.4 : 
Значения 
Пример 1.2.Рассчитать ЭДС серебряно – цинкового ГЭ при Т = 298 К, если активность Zn 2+ и Ag + равны по 0,01 моль/л.
Решение. Процессы, протекающие в ГЭ, и стандартная ЭДС элемента те же, что в примере 1.1. Рассчитаем величины электродных потенциалов.
Равновесные потенциалы электродов рассчитываем по уравнению Нернста для металлических электродов (уравнение 1.4 а):



При одинаковой активности потенциалопределяющих ионов в данном ГЭ согласно уравнению Нернста, изменение анодного потенциала больше, чем катодного, ЭДС элемента меньше, чем стандартная ЭДС.
Пример 1.3.Рассчитайте величину максимальной электроэнергии, которая может быть выработана серебряно – цинковым ГЭ при уменьшении массы анода на 1 г в результате протекания электрохимической реакции при условиях заданных в примере 1.2.
Решение. Анодом ГЭ является цинковый электрод. Количество электричества Q, прошедшего через электродную поверхность, рассчитывается из объединенного закона Фарадея:
Максимально вырабатываемая электроэнергия 
Пример 1.4.Рассчитайте ЭДС цинк-хлорного ГЭ, если 
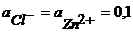
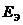
Решение.
Рассчитаем значения равновесных электродных потенциалов для соответствующих электродов по уравнению Нернста.
Для потенциалопределяющей реакции Zn 2+ + 2 


Для потенциалопределяющей реакции Cl2(газ) + 2 


Так как 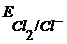

А — : Zn – 2 
К + : Cl2 + 2 
ТОР: Zn + Cl2 → Zn 2+ + 2Cl –
Вычислим значения ЭДС ГЭ: 
Увеличить ЭДС данного ГЭ можно, если: увеличить температуру; уменьшить активность ионов Zn 2+ ; уменьшить активность ионов Cl – ; увеличить парциальное давление Cl2 .
Пример 1.5. Рассчитайте ЭДС щелочноговодородно-кислородного ГЭ, работающего при одинаковых давлениях 

Решение.Для кислой среды уравнения электродных реакций в концентрационном элементе:
А — : H2 +2ОН — → 2Н2О + 2
К + : 1/2О2 + 2 

Величина равновесного потенциала этих электродов определяется по уравнению:

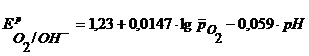

Для кислотноговодородно-кислородного топливного элемента:
на аноде: H2 — 2 
на катоде: 1/2О2 + 2H + + 2 


Электролизом называются электрохимические процессы прямого (непосредственного) преобразования электрической энергии в химическую, протекающие на электродах под действием постоянного тока. Под действием электрического поля беспорядочное движение ионов в электролите превращается в направленное: положительно заряженные ионы (катионы) перемещаются к отрицательному электроду – катоду, отрицательно заряженные ионы (анионы) движутся к положительному электроду – аноду.
При электролизе катод подсоединяется к отрицательному полюсу внешнего источника тока, а анод – к положительному. На катоде ( К – ) происходят процессы восстановления: положительные ионы или нейтральные молекулы принимают электроны и переходят в восстановленную форму. На катоде в первую очередь идут процессы, характеризующиеся более положительным потенциалом, т.е. восстанавливаются более сильные окислители. На аноде (А + ) могут окисляться анионы, нейтральные молекулы и сам материал анода. Анод может быть растворимым, т.е. окисляться в условиях электролиза, и инертным, нерастворимым, т.е. не участвовать в анодном процессе. К растворимым или частично растворимым анодам относятся Zn, Cu, Fe, Cd, Ag, Ni, Co и т.д., к нерастворимым – Pt, Pd и некоторые другие благородные металлы в определенных условиях, а также графит С. На аноде в первую очередь окисляются более сильные восстановители, т.е. идут процессы, характеризующиеся более отрицательным потенциалом.
Для того, чтобы правильно определить процессы электролиза, необходимо рассмотреть ионный состав электролита и определить равновесные потенциалы возможных процессов. Для расчета равновесных потенциалов возможных процессов, используется уравнение Нернста. Если не указаны конкретные условия, то для оценочной характеристики процессов используются стандартные потенциалы материала анода 





При относительно малом отличии равновесных потенциалов (менее 0,8 ¸ 1,0 В) на электродах возможно параллельное протекание нескольких процессов. Если на электроде идут одновременно несколько процессов, то доля количества электричества, пошедшего на каждый из процессов, называется выходом по току (Вj ):

где Qj – количество электричества, пошедшее на конкретный процесс;
Q – общее количество электричества, прошедшее через электрохимическую систему.
Сложные кислородсодержащие ионы, такие как SO4 2- , NO3 — , PO4 3- и др. из водных растворов на аноде не окисляются, т.к. обладают существенно более положительным потенциалом разряда, чем гидроксид-ион OH – .
Ионы элементов (приложение 1, табл. 1), обладающие высоко отрицательным электродным потенциалом (Al 3+ , Na + и др.) из водных растворов на катоде не восстанавливаются. Их разряд на катоде возможен только из расплавов соответствующих солей или из неводных растворов.
Количество вещества, испытавшего электрохимические превращения на электродах, рассчитывается по закону Фарадея.
При электролизе в результате прохождения через систему постоянного электрического тока происходит поляризация электродов (DЕК, DЕА): потенциал анода становится более положительным, а потенциал катода – более отрицательным и возникает омическое падение напряжения на внутреннем сопротивлении электрохимической цепи R (DЕом = R . I). Поэтому напряжение ( U ), которое необходимо подать на электроды от внешнего источника постоянного тока, больше минимальной разности потенциалов (Umin), равной разности равновесных потенциалов процессов :

Ход поляризационных кривых при электролизе показан на рис. 3.1. :
|
|
Рис. 3.1. Поляризационные кривые при электролизе.
Пример 3.1. Рассмотрите электролиз расплава соли хлорида лития LiCl на нерастворимых Pt-электродах. Рассчитайте минимальную разность потенциалов Umin электролиза. Напишите уравнения электродных процессов.
Решение. Запишем ионный состав электролита:
и стандартные потенциалы электродных процессов:
К — : 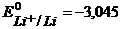
A + : 

K — : Li + + 
A + : 2Cl — → Cl2 + 2 
Данный электролиз можно использовать для получения лития и хлора.
Пример 3.2. Определите минимальную разность потенциалов Umin , которую необходимо подать на Pt-электроды для проведения электролиза водного раствора KOH, рН = 12. Напишите уравнения процессов электролиза. Рассчитайте объемы газов (приведенные к нормальным условиям), которые образуются на электродах за 10 часов при токе 5А.
Решение. Запишем уравнения диссоциации раствора электролита
КОН → К + + ОН — ; H2O 
и определим равновесные потенциалы возможных электродных процессов:
К — : 

А + : 
Так как Е 0 К + /К значительно отрицательнее 
Минимальная разность потенциалов для электролиза данного раствора:

Объем газов, выделившихся на электродах, рассчитаем по закону Фарадея (условия нормальные):


Электролиз водного раствора гидроксида калия широко применяется для электрохимического получения водорода.
Пример 3.3. Рассмотрите электролиз водного раствора CuCl2 на графитовых (нерастворимых) электродах. Напишите электродные процессы, покажите ход поляризационных кривых. Рассчитайте массу меди, образовавшейся на катоде, если за это же время на аноде выделилось 5,6 мл Cl2 и 5,6 мл O2 .
Решение. Определим ионный состав раствора электролита и оценим водородный показатель среды. Запишем уравнения диссоциации молекул соли и воды:
H2O 
Соль CuCl2 образована слабым основанием Cu(OH)2 и сильной кислотой HCl, следовательно, при ее растворении в воде будет протекать процесс гидролиза с образованием избытка ионов Н + , раствор электролита будет иметь слабокислую реакцию среды (примем рН = 5).
Определим потенциалы возможных процессов на аноде и катоде и запишем уравнения электродных процессов:
К — : 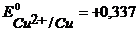

т.к. 

A + : 

т.к. 

K — : Cu 2+ + 2 
A + : 2H2O → O2 + 4H + + 4
2Cl — → Cl2 + 2 
Электролиз данного раствора можно проводить для нанесения медного покрытия на изделие, а также для получения газообразных кислорода и хлора.
 |
Рис. 3.2. Поляризационные кривые процесса электролиза водного раствора хлорида меди на нерастворимых электродах.
Определим массу меди, образовавшейся на катоде, для чего сначала рассчитаем объемы моль эквивалентов газов при н.у. и массу моля эквивалента меди:



По закону Фарадея определим количество электричества, необходимое для выделения заданных объемов кислорода и хлора на аноде (н.у.):


Суммарное количество электричества, прошедшее через анод, равно:

Такое же количество электричества на катоде (QК = QА) пойдет только на один процесс образования меди. По закону Фарадея определим массу выделившейся меди:

Определим выход по току (Bj) для всех процессов электролиза:



Пример 3.4. Рассмотрите электролиз водного раствора CuCl2 на медных электродах. Напишите уравнения электродных процессов, покажите ход поляризационных кривых. Чем отличается ход поляризационных кривых в данном варианте от варианта, рассмотренного в примере 3.3.?
Решение. Ионный состав раствора электролита таков же, как в примере 3.3., поэтому на катоде, как и в случае с электролизом на нерастворимых электродах, пойдет только процесс восстановления ионов меди.
Потенциалы возможных процессов на аноде:
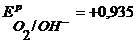

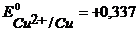


K — : Cu 2+ + 2 
A + : Cu → Cu 2+ + 2 
При больших напряжениях электролизера U , могут быть достигнуты 
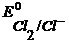

Благодаря растворению под действием тока медного анода запас ионов Cu 2+ в растворе электролита будет восполняться, и процесс образования медного покрытия на катоде будет идти более интенсивно, чем в случае использования инертных электродов (пр. 3.3.).
Рис. 3.3. Поляризационные кривые процесса электролиза водного раствора хлорида меди на медных электродах.
Пример 3.5. Рассмотрите электролиз водного раствора смеси солей Pb(NO3)2 и Sn(NO3)2 на графитовых (нерастворимых) электродах. Напишите уравнения электродных процессов. Рассчитайте выход по току веществ, если на катоде одновременно образовалось 30г Sn, 52г Pb и 2,8л Н2 (условия нормальные).
Решение. Определим ионный состав раствора электролита и оценим водородный показатель среды. Запишем уравнения диссоциации молекул соли и воды:
H2O 
Соли Sn(NO3)2 и Pb(NO3)2 образованы слабыми основаниями и сильной кислотой, следовательно, при их растворении в воде будет протекать процесс гидролиза с образованием избытка ионов Н + , раствор электролита будет иметь слабокислую реакцию среды (примем рН ≈ 5).
Определим равновесные потенциалы возможных процессов на аноде и катоде:
К — : 

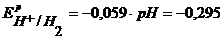
т.к. 


Таким образом, на электродах протекают следующие процессы:
K — : Pb 2+ + 2e → Pb
A + : H2O → O2 + 4H + + 4 
Запишем массы и объем (при нормальных условиях) моль эквивалентов веществ, образовавшихся на катоде:



По закону Фарадея определим количество электричества, необходимое для получения на катоде заданного количества вещества (н.у.):



Суммарное количество электричества, прошедшее через катод:

Определим выход по току (Bj) для всех процессов электролиза:





Рис. 3.4. Поляризационные кривые процесса электролиза водного раствора смеси солей Pb(NO3)2 и Sn(NO3)2 на графитовых (нерастворимых) электродах.
Пример 3.6. Рассмотрите процесс рафинирования никеля, содержащего примеси цинка и меди в водном растворе H2SO4. Какие процессы будут протекать на аноде и катоде? Какое время нужно для проведения рафинирования при токе 500 А для выделения 5 кг никеля при выходе по току 98%?
Решение. Рафинирование – очистка металла от примесей с помощью электролиза. На аноде растворяются основной металл и примеси, потенциал которых отрицательнее основного металла. Примеси, имеющие более положительный потенциал, не растворяются и выпадают из анода в виде шлама. На катоде в первую очередь выделяется металл, имеющий наиболее положительный потенциал.
Анод – очищаемый металл Ni с примесями Zn и Cu. Ионный состав раствора электролита: H + , SO4 2- , OH — . Запишем равновесные потенциалы возможных электродных процессов при рН = 2:
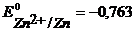
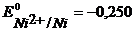
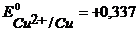


Так как 

Запишем уравнения электродных процессов:
А + : Zn → Zn 2+ + 2e
K — : 2H + + 2e → H2
Время, необходимое для рафинирования, рассчитаем по закону Фарадея ( 

4. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ МЕТАЛЛОВ
Коррозией называют самопроизвольное разрушение металлических материалов под действием компонентов окружающей среды. В результате коррозии протекает суммарная окислительно-восстановительная реакция взаимодействия металла с окислителем:
При этом происходит окисление металла и разрушение металлоконструкций.
Для металла именно окисленное состояние является те
Применение уравнения Нернста в решении задач.
При рассмотрении вопроса об окислительно-восстановительных реакциях часто возникает необходимость расчета электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций. В справочниках обычно приведены таблицы т.н. стандартных потенциалов тех или иных процессов, рассчитанных при р=1 атм, Т=298К и активностях участников равных 1. Однако в реальных задачах условия могут значительно отличаться от указанных выше. Как быть в таком случае? Ответ дает уравнение Нернста. В оригинальном виде оно выглядит так:
Как можно заметить, в уравнении фигурируют несколько постоянных величин. Также температура в подавляющем большинстве случаев равна 298К. Кроме того, можно заменить натуральный логарифм на десятичный. Это можно сделать путем умножения на коэффициент перевода. Если собрать все постоянные в единый множитель, то приходим к несколько иному, но более знакомому по учебным пособиям виду уравнения Нернста:
Такой вариант уравнения сильно облегчает жизнь в ряде случаев, например рассмотрении рН-зависимых процессов. Используя данное уравнение можно провести вычисления в любых условиях, приведенных в задаче. Рассмотрим характерные примеры задания по данной теме.
Пример 1:
Рассчитать ЭДС гальванического элемента, составленного из медной и цинковой пластин, погруженных в растворы 0.1М CuSO4 и 0.01М ZnSO4 соответственно. Коэффициенты активности ионов Cu 2+ и Zn 2+ принять равными единице.
Решение:
Для начала запишем уравнения протекающих процессов:
Далее находим по таблице стандартные потенциалы процессов:
Если в условиях задачи ничего не сказано про коэффициенты активности ионов, то можно считать их равными единице, как и в нашем случае. Тогда активности участников процессов можно принять равными их аналитическим концентрациям.
Найдем реальные потенциалы с учетом нестандартных активностей ионов:
Далее необходимо сравнить полученные величины между собой, чтобы определить, кто из участников процесса – окислитель. Потенциал меди больше, чем у цинка, поэтому она будет окислителем. Тогда найдем ЭДС системы:
Ответ: 1.13 В
Пример 2:
Одним из лабораторных способов получения хлора является действие KMnO4 на концентрированную соляную кислоту. Можно ли провести процесс при рН=4?
Решение:
Для начала запишем уравнения протекающих процессов.
Далее находим по таблице стандартные потенциалы процессов:
Несложно заметить, что от рН в данном случае зависит только потенциал перманганата. Тогда воспользуемся уравнением Нернста и рассчитаем его реальный потенциал в условиях задачи:
Получается, что потенциал KMnO4 стал меньше, чем у хлора, а значит, реакция не пойдет.
Практическое занятие 8: Стандартные электродные потенциалы, уравнение Нернста. Коррозия.
Цель занятия: Формирование необходимого комплекса знаний об электрохимических процессах и их количественных характеристиках. Формирование навыков использования фундаментальных законов и основных понятий химической науки в области электрохимии для понимания характеристик процессов, используемых в современной промышленности и в быту.
Требования к знаниям, которые студент должен приобрести в результате освоения темы:
знать:основные положения теории электрохимических процессов (гальванический элемент, коррозия)
уметь: составлять уравнения процессов, протекающих при работе гальванического элемента, коррозии, рассчитывать их количественные характеристики.
Окислительно-восстановительные процессы, сопровождающиеся взаимными превращениями электрической и химической энергии, называются электрохимическими. Раздел химии, в котором изучаются химические процессы, протекающие с поглощением или выделением электрической энергии, называется электрохимией.
Процессы перехода химической энергии в электрическую характерны для химических источников электрической энергии, к которым относятся гальванические элементы, аккумуляторы, топливные элементы. Превращение химической энергии в электрическую широко используется в энергетике.
Электрохимические реакции протекают на границе раздела фаз металл (электрод) | раствор электролита, металл | металл, электролит | электролит. Поскольку протекание электрохимического процесса сопряжено с обменом заряженными частицами между двумя фазами, то у фаз, участвующих в обмене, возникают электрические заряды и, как следствие, – скачок электрического потенциала на границе раздела фаз.
Скачок потенциала на границе раздела фаз электрод | электролит называется электродным потенциалом (φэ).
При взаимодействии металла с водным раствором его соли (рис.4) полярные молекулы воды, взаимодействуя с катионами металлической решетки на ее поверхности, облегчают переход ионов в раствор и поэтому на границе раздела металл | раствор возможна следующая реакция (реакция окисления):
M +mН2О → M n+ ·mН2О + ne — ,
M n+ · mН2О – гидратированный катион металла.

M → M n+ + ne —
В результате поверхность металла заряжается отрицательно, а слой электролита около него – положительно. На границе раздела фаз формируется двойной электрический слой (ДЭС). Такой процесс возможен при погружении цинкового электрода в раствор соли цинка (например – в сульфат цинка). Металл заряжается отрицательно только в том случае, когда энергия его кристаллической решетки меньше энергии сольватации.
Если кристаллическая решетка металла прочна (Екрист. реш. > Есольв.), происходит обратный процесс – осаждение металла из раствора, сопровождающееся потерей гидратной оболочки катионами металла (реакция восстановления):
M n+ ·mН2О + ne — → M +mН2О
M n+ + ne — → M
Примером такого процесса является пара электрод | электролит, состоящая из медного электрода, погруженного в раствор сульфата меди.
Переход зарядов через границу раздела фаз электрод | электролит в том или ином направлении происходит в зависимости от того, в какой из фаз – в металле или электролите – ионы обладают большим электрохимическим потенциалом. В общем случае возможность протекания реакции на границе раздела фаз в определенном направлении обусловлена разностью химических потенциалов реагирующих частиц в этих фазах.
Процесс обмена приведет к образованию на границе металл | электролит ДЭС, т.е. к разделению электрических зарядов. ДЭС можно сравнить с конденсатором, одна из обкладок которого представляет собой поверхность металла, а другая – слой ионов в растворе у поверхности металла. Между разноименными обкладками возникает скачок потенциала. Скачок потенциала на границе раздела фаз электрод | электролит называется электродным потенциалом (φэ).
|
Если привести во взаимодействие два металла, то на границе раздела металл | металл образуется ДЭС (рис. 5) и происходит скачок потенциала, называемый контактным потенциалом (φк).
При разделении растворов электролита с разными концентрациями полупроницаемой мембраной на границе раздела электролит | электролит также образуется ДЭС. Этот процесс будет обусловлен переходом ионов с размерами, меньшими, чем отверстия мембраны, из области с большей концентрацией в область с меньшей концентрацией. Скачок потенциала в этом случае называют диффузионным потенциалом (φд).
Примером использования электрохимического процесса, в результате которого химическая энергия превращается в электрическую, является гальванический элемент (рис. 6). Электродвижущая сила такого элемента представляет собой разность равновесных потенциалов положительного и отрицательного 
Схему приведенного на рис. 6 гальванического элемента, состоящего из медного и цинкового электродов, погруженных в растворы их солей, можно записать следующим образом:
(–) Zn | Zn 2+ || Cu 2+ | Cu (+)
Этот элемент называется гальваническим элементом Даниэля – Якоби. Принцип записи схемы заключается в следующем: слева записывается анод Zn | Zn 2+ , на котором возникает избыток электронов и происходит процесс окисления – отрицательный полюс или анод (–). Справа записывается катод Cu 2+ | Cu – электрод с недостатком электронов, т.е. положительный полюс (+). Одинарная вертикальная линия изображает границу раздела фаз между электродом (металлом) и раствором электролита. Двойная вертикальная линия отделяет анодное пространство от катодного.
Для характеристики работы гальванического элемента используется разность потенциалов катода и анода, которая должна быть положительной. Значения электродных потенциалов зависят от природы электродов, природы и среды (рН) электролитов, концентрации электролитов и температуры. Зависимость потенциала от условий внешней среды выражается уравнением Нернста:
φ = φ0 +
где φ – электродный потенциал металла при заданных условиях, В;
φ0 – стандартный электродный потенциал металла, В;
R – универсальная газовая постоянная, R = 8,3144 Дж/(моль∙K);
T – абсолютная темперетура, К;
n – число электронов, принимающих участие в электродной реакции;
F – постоянная Фарадея, F = 96485,309 Кл/моль (F ≈ 96500 Кл/моль);
C – молярная концентрация ионов металла в растворе электролита, моль/л.
Используя значение температуры, соответствующее стандартным условиям, Т = 298,15 К, численные значения используемых в уравнении Нернста констант и выполнив переход от натурального логарифма (ln) к десятичному (lg), получим уравнение Нернста в виде:
φ = φ0 +
Основной характеристикой электрода является стандартный электродный потенциал – потенциал, возникающий на границе раздела электрод | электролит, определяемый при стандартных условиях относительно выбранного электрода сравнения. Стандартный потенциал находят при следующих условиях:
Ø металл находится в растворе своей соли;
Ø молярная концентрация ионов металла в растворе электролита составляет 1 моль/л;
Ø измерения производят при температуре 25 0 С (298 К);
Ø для газовых электродов давление газа равно 1,01 • 10 5 Па (1 атм).
Для водных растворов в качестве стандартного электрода используют водородный электрод, потенциал которого при всех температурах принимается равным нулю. Водородный электрод сравнения (рис. 7) состоит из стеклянной емкости, в которую впаивается платиновый электрод, покрытый мелкодисперсной платиной (платиновой чернью). Электрод погружен в раствор кислоты с активностью ионов водорода 1 моль/л и обдувается газообразным водородом, который адсорбируется платиновой чернью. Между водородом, адсорбированным платиновой чернью, и ионами водорода в растворе устанавливается рав 
Ø чем левее расположен металл в ряду напряжений, тем выше его восстановительные свойства;
Ø чем правее расположен металл в ряду напряжений, тем выше его окислительные свойства;
Ø каждый металл способен вытеснять из растворов солей все другие металлы, стоящие в ряду напряжений правее него;
Ø все металлы, расположенные в ряду напряжений левее водорода, способны вытеснять его из кислот;
Ø чем дальше в ряду напряжений расположены друг от друга два металла, тем большее напряжение будет давать построенный из них гальванический элемент.
Устройства, используемые для непосредственного преобразования энергии химического процесса в электрическую энергию, называют химическими источниками тока. Такие источники широко применяются в различных областях техники: в средствах связи, в электроизмерительной аппаратуре, в качестве источников электропитания транспортных средств и др. Химические источники тока представлены двумя типами: обратимые и необратимые. Обратимые химические источники тока – аккумуляторы – используются многократно, поскольку их работоспособность восстанавливается при пропускании тока в обратном направлении от внешнего источника. Основными характеристиками аккумуляторов являются КПД, ЭДС, механическая прочность, срок службы. Эти характеристики зависят от используемых при изготовлении аккумулятора материалов.

Важную роль в группе химических источников тока играют топливные элементы – устройства, преобразующие химическую энергию топлива (водорода) в электрическую в процессе электрохимической реакции напрямую, в отличие от традиционных технологий, при которых используется сжигание твердого, жидкого и газообразного топлива. В топливном элементе (рис. 8) для производства электрической энергии используется топливо, подаваемое от внешнего источника. В качестве окислителя в топливных элементах применяется кислород, топливом является водород. В топливном элементе в общем виде протекает токообразующая реакция, в результате которой в цепи генерируется постоянный ток, и химическая энергия непосредственно превращается в электрическую:
2H2 + O2 → 2H2O + электричество + тепло.
Характеристиками топливных элементов являются ЭДС, напряжение, мощность и КПД.
Для производства электрической энергии может использоваться не только чистый водород, но и другое водородосодержащее сырье, например, природный газ, аммиак, метанол или бензин. В качестве источника кислорода, также необходимого для реакции, используется обычный воздух. Если в качестве топлива выступает водородосодержащее сырье, например, природный газ, побочными продуктами реакции будут и другие газы, например, оксиды углерода и азота, но в количестве гораздо меньшем, чем при прямом сжигании природного газа.
Важное место в электрохимических исследованиях занимает исследование процессов коррозии, поскольку стойкость и надежность конструкционных материалов и разработка методов их защиты определяют, в конечном итоге, эффективность большинства технологий, используемых в промышленности.
Под коррозией (от лат. corrosio – разъедание) понимают самопроизвольное разрушение металлов (и их сплавов) в результате химического и электрохимического взаимодействия с окружающей средой. По механизму взаимодействия металлов с внешней средой различают химическую и электрохимическую коррозию. Химическая коррозия характерна для сред, не проводящих электрический ток: сухих (содержание влаги не более 0,1 %) газов при высокой температуре (HClг, Cl2, SO2, H2S, NOx и др.) – газовая коррозия; газообразных компонентов воздуха (O2, CO2, пары воды) или любого влажного газа – атмосферная коррозия; коррозия в жидких неэлектролитах (нефтепродукты, растворы сахара, спирты и др.). В процессе химической коррозии происходит прямое взаимодействие металла, выступающего в роли восстановителя, с окружающей, не электропроводящей, средой (окислитель):
2Al + 3Cl2 → 2AlCl3
2R–Cl + Me → MeCl2 + R–R
где R – органический радикал.
Электрохимическая коррозия возникает при взаимодействии металлов с растворами электролитов (коррозионной средой), в результате чего образуются локальные гальванические элементы. Электрохимическая коррозия является наиболее распространенным типом коррозии и сопровождается химическими реакциями и переносом электрических зарядов между металлом и окружающей средой при участии воды. При этом взаимодействие металла с окружающей средой протекает на отдельных участках поверхности металла и характеризуется анодным и катодным процессами. Разрушение металла происходит только на анодных участках. Скорость коррозии определяется величиной электродного потенциала металла, состоянием его поверхности, температурой и рН раствора.
Процесс коррозии является анодным растворением металла под влиянием катодного восстановления окислителя. Наиболее распространенными окислителями в коррозионных процессах являются ионы водорода и молекулы кислорода. Коррозия с участием ионов водорода называется коррозией с водородной деполяризацией (выделение водорода) и при ее протекании происходят следующие процессы:
Анод: Me o – nē → Me n + (окисление)
Катод (в кислой среде): 2Н + + 2ē →Н2 0 ↑ (восстановление)
Катод (в щелочной среде): Н2О + 2ē = Н2↑ + 2ОН − (восстановление)
Коррозия с участием растворенного в электролите кислорода называется коррозией с кислородной деполяризацией (поглощение кислорода):
Анод: Me o – nē → Me n + (окисление)
Катод: О2 + 2Н2О + 4ē → 4ОН – (восстановление)
Скорость такой коррозии зависит от природы металла (потенциал кислородного электрода положительнее потенциала металла), от концентрации кислорода в растворе, скорости диффузии кислорода. На скорость коррозии с водородной и кислородной деполяризацией влияет образование на поверхности металла защитных оксидных пленок. К таким металлам относятся алюминий, титан, хром, никель, свинец и др. Замедление или прекращение процессов коррозии называется пассивацией металла.
Значимыми в промышленных масштабах разновидностями электрохимической коррозии являются почвенная коррозия и электрокоррозия. Почвенная (грунтовая) коррозия представляет собой разрушение подземных металлических сооружений под воздействием почвенного электролита и является причиной разрушения таких строительных сооружений как сваи, опоры, подземные трубопроводы. Электрокоррозия или коррозия блуждающими токами – это процесс разрушения протяженных подземных металлических сооружений, вызванный действием проникающих блуждающих токов (токи, ответвляющиеся от своего пути) различных электроустановок. Источниками блуждающих токов чаще всего являются рельсовые пути, сварочные агрегаты и др.
Коррозия является процессом, приносящим немалые убытки сооружениям и оборудованию, используемому в различных отраслях производства. Поэтому одно из главных направлений научных исследований в данной области – защита материалов от коррозии. Коррозию можно затормозить изменением потенциала металла, снижением концентрации окислителя, изменением состава сплава и т.д.
К основным методам защиты от коррозии относятся:
Ø легирование металлов (сплавов), то есть введение в их состав компонентов (хром, никель, кремний, молибден, вольфрам, магний), образующих на поверхности плотные защитные оксидные слои. Легирование используется для повышения коррозионной стойкости металлов, работающих в агрессивных средах при высоких температурах;
Ø изменение свойств коррозионной среды, как правило, с помощью ингибиторов коррозии или при изменении рН среды;
Ø защитные металлические и неметаллические покрытия. По способу действия металлические покрытия разделяют на катодные и анодные. Катодные покрытия предполагают использование менее активного металла для защиты более активного. Примером такого покрытия является луженое (покрытое оловом) железо. Отличительной особенность анодного покрытия является защита менее активного металла более активным, например, использование цинка для защиты железа (оцинкованное железо.) В качестве неметаллических покрытий используют полимерные материалы, лаки, краски, эмали, резины и т.п.
Ø электрохимическая защита предполагает либо использование протектора (присоединение к защищаемой конструкции более активного металла), либо защиту внешним током;
Ø рациональное конструирование и эксплуатация изделий.
Практическая часть (примеры решения задач):
Задача 1: Рассчитайте электродный потенциал железа, погруженного в раствор FeSO4, если концентрация соли равна 0,01 моль/л.
Решение: Поскольку заданная концентрация электролита отличается от стандартной, а другие условия протекания процесса взаимодействия электрод/электролит не указаны, необходимо воспользоваться уравнением Нернста в виде:
φ = φ0 +
Стандартный электродный потенциал железа на основании справочных данных (приложение 8) φ0 = –0,44 В. Электродная реакция имеет вид:
поэтому в процессе участвуют 2 электрона (n = 2)
φ = –0,44 + 
Задача 2: Рассчитайте ЭДС и составьте схему гальванического элемента, электродами для которого являются пластинки из олова и свинца в стандартных условиях. Что изменится в схеме гальванического элемента, если концентрация ионов свинца в растворе составит 0,001 моль/л, а олово останется в стандартных условиях? Составьте схему нового гальванического элемента.
Решение: Разделим решение задачи на 2 части.
Часть 1: Для составления схемы гальванического элемента воспользуемся справочными данными о стандартных электродных потенциалах (приложение 8):
Поскольку окислительно-восстановительная реакция, характеризующая работу гальванического элемента, протекает в направлении, где ЭДС элемента принимает положительное значение, определим значение ЭДС. Так как олово имеет меньший потенциал, оно будет являться анодом, на котором протекает процесс окисления (анодный процесс):
Свинец, потенциал которого больше, будет выполнять роль катода и участвовать в восстановительном процессе (катодный процесс):
Сложение катодного и анодного процесса даст нам уравнение окислительно-восстановительной реакции, характеризующей работу данного гальванического элемента:
Sn 0 + Pb 2+ ⇄ Sn 2+ + Pb 0
Значение ЭДС этого элемента:
Следовательно, схема гальванического элемента будет иметь вид:
(–) Sn | Sn 2+ || Pb 2+ | Pb (+)
Часть 2: Для того чтобы определить, что изменится в схеме гальванического элемента, если концентрация ионов свинца в растворе составит 0,001 моль/л, рассчитаем электродный потенциал свинца в заданных условиях по уравнению Нернста по аналогии с задачей 1:
φ׳(Pb 2+ /Pb) = –0,13 + 
В данном случае, произошло изменение соотношений потенциалов. Теперь свинец имеет меньший потенциал и будет являться анодом, а олово, потенциал которого больше – катодом. Процессы будут иметь вид:
анодный процесс: Pb 0 – 2ē ⇄ Pb 2+ (окисление)
катодный процесс: Sn 2+ + 2ē ⇄ Sn 0 (восстановление)
ЭДС полученного элемента:
Следовательно, схема нового гальванического элемента примет вид:
(–) Pb | Pb 2+ || Sn 2+ | Sn (+)
Задача 3: Как происходит атмосферная коррозия луженого железа и луженой меди? Приведите уравнения процессов; укажите продукты каждой реакции.
Решение: Для решения поставленной задачи воспользуемся справочными данными о стандартных электродных потенциалах, не забывая о том, что термин «луженый» говорит об использовании олова в качестве защитного покрытия:
В паре железо – олово при нарушении защитного покрытия железо, имеющее меньший электродный потенциал, будет являться анодом, а олово – катодом. Поэтому оловянное покрытие на железе является катодным покрытием. Ионы железа будут переходить в раствор (анод, процесс окисления):
Так как в воздухе присутствуют водяные поры, конденсирующие на поверхности металла кислород, на катоде пойдет реакция восстановления кислорода:
Суммарное уравнение коррозионного процесса с учетом числа принятых и отданных электронов:
В результате вторичных процессов на железе образуется ржавчина:
В паре медь – олово при нарушении защитного покрытия олово, имеющее меньший электродный потенциал, будет являться анодом, а медь – катодом. Поэтому оловянное покрытие на меди является анодным покрытием. Оловянное покрытие на меди считается одним из наиболее эффективных, и по ряду данных продлевает срок службы изделий более чем на 100 лет. Но при нарушении целостности покрытия будут протекать следующие процессы:
Анод: Sn – 2ē → Sn 2+ ;
Суммарное уравнение коррозионного процесса с учетом числа принятых и отданных электронов:
1. Какие процессы называются электрохимическими?
2. Какова область приложения электрохимических процессов?
3. Каков механизм протекания электрохимических процессов?
4. Как образуется ДЭС при протекании электрохимического процесса? Приведите примеры для различных фазовых разделов.
5. Как возникают электродные потенциалы?
6. Объясните принцип работы гальванического элемента.
7. Какая величина называется стандартным электродным потенциалом? Как она определяется?
8. Приведите примеры химических источников тока, определите области их применения, проанализируйте достоинства и недостатки.
9. Что называют коррозией металлов?
10. Как классифицируют процессы коррозии?
11. В чем отличие электрохимической коррозии от химической? Приведите примеры.
12. Какие факторы влияют на скорость коррозии?
13. Охарактеризуйте основные методы борьбы с коррозией металлов.
1. Рассчитайте электродный потенциал олова, погруженного в раствор его нитрата с концентрацией соли 0,0001 М.
2. Рассчитайте ЭДС и составьте схему гальванического элемента, электродами для которого являются пластинки из магния и цинка в стандартных условиях.
3. Что изменится в схеме гальванического элемента, приведенного в задании 2, если концентрация ионов магния в растворе составит 0,01 моль/л, а другой элемент останется в стандартных условиях? Составьте схему нового гальванического элемента.
4. Железное изделие покрыли свинцом и кадмием. Укажите тип покрытия в каждом случае и составьте катодные и анодные процессы в кислой среде и среде атмосферного воздуха. Какие вещества будут продуктами коррозии?
5. Какие процессы протекают при коррозии железной пластинки в кислой среде и во влажном воздухе, если пластинка находится в контакте: а) с магниевой пластиной; б) с медной пластиной? Составьте электронные уравнения анодных и катодных процессов. С какой деполяризацией протекает коррозия?
6. В каком случае коррозия цинковой пластинки протекает быстрее: а) при контакте с железной пластинкой; б) при контакте с оловянной пластинкой? Почему?
1. Коровин Н.В. Общая химия: учеб. рек. Мин. обр. РФ/ Н.В. Коровин. – М.: Высшая школа, 2009. – 558 с.
2. Глинка, Н.Л. Задачи и упражнения по общей химии: учеб. пособие: рек. Мин. обр. РФ/ Н.Л. Глинка. – Л.: Химия, 2006. – 240 с.
3. Ахметов, Н.С. Лабораторные и семинарские занятия по общей и неорганической химии: Учеб. пособие: Рек. Мин. обр. РФ / Ахметов Н.С., Азизова М.К., Бадыгина Л.И. — М.: Высш. шк., 2002. — 368с. с.
4. Тестовые задания по общей и неорганической химии с решениями и ответами: учеб. пособие / Р. А. Лидин [и др.]. – М.: БИНОМ; М.: Лаборатория знаний, 2004. – 231 с.
5. Родина, Т.А. Практикум по общей и неорганической химии: учеб. пособие/ Т.А. Родина, А.В. Иванов, В.И. Митрофанова; АмГУ, ИФФ. – Благовещенск: Изд-во Амур. гос. ун-та, 2008. – 208 с.
Практическое занятие 9: Законы электролиза (решение задач)
Цель занятия: Формирование необходимого комплекса знаний об электрохимических процессах и их количественных характеристиках. Формирование навыков использования фундаментальных законов и основных понятий химической науки в области электрохимии для понимания характеристик процессов, используемых в современной промышленности и в быту.
Требования к знаниям, которые студент должен приобрести в результате освоения темы:
знать:основные положения теории электрохимических процессов (электролиз)
уметь: составлять уравнения процессов, протекающих на электродах при электролизе, рассчитывать их количественные характеристики
Превращение электрической энергии в химическую происходит при электролизе. Этот процесс широко используется в металлургии, химической промышленности, при получении гальванопокрытий.
Под электролизом понимают окислительно-восстановительный процесс, протекающий на электродах при пропускании постоянного электрического тока через расплав или раствор электролита.

Количественно процесс электролиза описывается законами М. Фарадея (1833 г.):
Ø Первый закон Фарадея: масса веществ, выделившихся на электродах в процессе электролиза, пропорциональна их эквивалентам и количеству пропущенного электричества. Математически первый закон Фарадея можно выразить формулой:
m =
где m – масса вещества, выделившегося на электроде, г;
МЭ – молярная масса эквивалента вещества, выделившегося на электроде, г/моль;
τ – время протекания процесса, с;
F – постоянная Фарадея, F = 96485,309 Кл/моль (F ≈ 96500 Кл/моль);
I ∙ τ = Q – количество электричества, Кл.
Ø Второй закон Фарадея: при пропускании одного и того же количества электричества массы веществ, выделившихся на электродах, прямо пропорциональны молярным массам их эквивалентов.
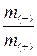
где m(–) и m(+) – массы веществ, выделившихся на катоде и аноде, соответственно, г;
МЭ(–) и МЭ(+) – молярные массы эквивалента веществ, выделившегося на электродах, г/моль.
Если одно из выделяющихся на электроде веществ – газ, законы Фарадея могут иметь вид:
V =
где V – объем вещества, выделившегося на электроде, л;
VЭ – эквивалентный объем вещества, выделившегося на электроде, л/моль.
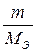
где V и VЭ – объем вещества (л) и эквивалентный объем вещества (л/моль) выделившегося на одном электроде;
m и МЭ – масса (г) и молярная масса эквивалента (г/моль) вещества, выделившегося на другом электроде.
Поскольку в реально протекающих процессах возможны побочные реакции, эффективность процессов электролиза оценивают выходом по току – величиной, выражающей в процентах отношение количества фактически затраченного электричества к теоретически необходимому:
ВТ =
Достаточно часто выход по току определяют как отношение массы фактически выделившегося на электроде вещества к массе, рассчитанной по закону Фарадея:
ВТ =
Так как процессы электролиза расплавов и растворов принципиально отличаются друг от друга, рассмотрим эти процессы.
При электролизе расплавов образуются только ионы вещества, образующего расплав. Например, при расплавлении хлорида кальция происходит процесс его термической диссоциации по схеме:
CaCl2 → Ca 2+ + 2Cl –
При пропускании электрического тока начинается направленное движение ионов к соответствующим (инертным) электродам, в результате чего на электродах будут протекать следующие процессы:
Катод (–): Са 2+ + 2ē → Са 0 (восстановление)
Анод: 2Сl – – 2ē → Cl2↑ (окисление)
При электролизе расплавов оснований и кислородсодержащих солей на инертных электродах будут проходить следующие процессы:
Ø Электролиз расплава NaOH: на катоде будет происходить восстановление металла, на аноде – окисление кислорода гидроксогруппы
Катод (–): Nа + + 1ē → Nа 0 (восстановление)
Анод: 4OH – – 4ē → O2↑ + 2H2O (окисление)
Ø Электролиз расплава Na2SO3: на катоде будет происходить восстановление металла, на аноде – окисление аниона, так как сера в составе аниона находится в промежуточной степени окисления (S +4 ):
Катод (–): Nа + + 1ē → Nа 0 (восстановление)
Анод: SO3 2– – 2ē → SO3↑ 0 (окисление)
Ø Электролиз расплава Na2CO3: на катоде будет происходить восстановление металла, на аноде – окисление кислорода, входящего в состав аниона, так как углерод в составе аниона находится в высшей степени окисления (С +4 ):
Катод (–): Nа + + 1ē → Nа 0 (восстановление)
Анод: 2СО3 2– – 4ē → О2↑+ 2СО2↑ (окисление)
При электролизе растворов помимо ионов вещества, подвергающегося электролизу, в растворе присутствуют молекулы воды, которые также могут участвовать в процессе. Поэтому существует ряд закономерностей, описывающих процессы электролиза растворов. В зависимости от активности металла катодный процесс может выглядеть следующим образом. Катионы активных металлов, расположенных в ряду напряжений металлов включительно до алюминия, на катоде не разряжаются. Вместо этого на катоде происходит восстановление воды:
2Н2О + 2ē → Н2↑ + 2ОН –
Поэтому электролиз, целью которого является получение активного металла, является энергозатратным и дорогостоящим процессом, поскольку необходимо использовать исключительно расплав.
Для менее активных металлов (от марганца до свинца, включительно) катодный процесс зависит от концентрации раствора. Из концентрированных растворов на катоде восстанавливаются металлы, из разбавленных – металл и водород:
Ме n + + nē → Me 0
2Н2О + 2ē → Н2↑ + 2ОН –
Катионы неактивных металлов, расположенных в ряду напряжений металлов правее свинца, легко разряжаются на катоде, и происходит восстановление металла:
Ме n + + nē → Me 0
Протекание анионного процесса тоже имеет свои особенности. Анионы бескислородных кислот (HCl, HBr, HI, H2S) разряжаются на электроде с образованием соответствующих молекул.
2Сl – – 2ē → Cl2↑
Исключение составляет HF.
Анионы кислородсодержащих кислот (и ион F – ) на электроде не разряжаются, вместо этого происходит следующие процессы:
Ø в кислотной и нейтральной средах:
2Н2О – 4ē → O2↑ + 4Н +
Ø в щелочной среде:
4ОН – – 4ē → О2↑ + 2Н2О
Все рассмотренные выше процессы имеют место при использовании инертных электродов. В случае использования растворимого анода металл, из которого выполнен анод, переходит в раствор, а на катоде происходит восстановление такого же количества металла. Окисление металла анода может быть выражено схемой:
Me 0 – nē → Ме n +
Процессы электролиза широко используются как в промышленности, так и в аналитической химии, и других отраслях науки. Электролизом получают многие чистые вещества и соединения. Использование электролиза в цветной металлургии позволяет извлекать металлы из руд и проводить их очистку. Распространенным способом очистки металлов является их электрорафинирование – процесс электролиза с растворимым анодом. Также электролиз широко используется при нанесении металлических покрытий на различные поверхности. В данной области, называемой гальванотехникой, используется два основных метода. Гальваностегия представляет собой осаждение на поверхность материала или изделия металла, гальванопластика – это получение металлических рельефных копий с использованием процесса электролиза. Процессы электролиза положены в основу таких методов исследования, как кулонометрия, кондуктометрия, потенциометрия.
Практическая часть (примеры решения задач):
Задача 1: Составьте уравнения процессов, происходящих на инертных электродах при электролизе расплава и раствора бромида калия.
Решение: При электролизе расплава образуются только ионы вещества, образующего расплав. При расплавлении бромида калия происходит процесс его термической диссоциации по схеме:
В процессе электролиза при пропускании электрического тока начинается направленное движение ионов к соответствующим электродам, то есть положительный ион калия будет двигаться к катоду, а отрицательно заряженный ион хлора – к аноду. Поэтому на электродах будут протекать следующие процессы:
Катод (–): К + + 1ē → К 0 (восстановление)
Анод: Br – – 1ē → Br 0 (окисление)
Суммарное уравнение процесса электролиза расплава будет иметь вид:
Электролиз раствора бромида калия будет выглядеть иначе. В растворе будет происходить диссоциация бромида калия:
Поскольку калий является активным металлом, на катоде будет происходить восстановление молекул воды, а ионы К + останутся в околокатодном пространстве. На аноде будет происходить окисление ионов брома, поскольку Br – является ионом бескислородной кислоты HBr.
Катод: 2Н2О + 2ē → Н2↑ + 2ОН – (восстановление)
Анод: Br – – 1ē → Br 0 (окисление)
Суммарное уравнение процесса электролиза раствора будет иметь вид:

Задача 2: Составьте уравнения процессов, происходящих на инертных электродах при электролизе раствора нитрата меди (II) и рассчитайте массу (объем) веществ, выделившихся на электродах, если процесс электролиза проходил в течение 1,5 часов при силе тока 10А.
Решение: Диссоциация нитрата меди в водном растворе будет происходить по схеме:
Медь является неактивным металлом и располагается в ряду напряжений металлов правее водорода. Поэтому на катоде будет происходить восстановление меди. Анион NO3 – является остатком кислородсодержащей кислоты, поэтому на аноде будет происходить окисление воды:
Катод: C 2+ + 2ē → Cu 0 (восстановление)
Суммарное уравнение процесса электролиза раствора будет иметь вид:
Так как в процессе электролиза на катоде выделяется медь (твердое вещество), а на аноде кислород (газ), рассчитаем соответственно, их массу и объем на основании первого закона Фарадея.
m =
V =
Для выполнения расчетов необходимо определить молярную массу эквивалента меди и эквивалентный объем кислорода, а также привести время к требуемым для расчета единицам измерения (секунды).
τ = 1,5 час = 5400 с
m(Cu) = 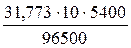
V(О2) = 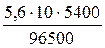
Задача 3: Какое вещество и в каком количестве выделится при электролизе раствора сульфата никеля на аноде, если на катоде выделилось 88,5 г металла?
Решение: Процесс электролиза сульфата никеля в водном растворе будет происходить следующим образом:
Катод: Ni 2+ + 2ē → Ni 0 (восстановление)
Суммарное уравнение процесса электролиза:
Таким образом, веществами, выделяющимися на электродах, будут никель и кислород. Поскольку условия протекания процесса электролиза (время, сила тока) не заданы, воспользуется для расчетов вторым законом Фарадея применительно к газам:
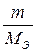
V(О2) = 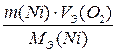
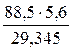
1. Какой процесс называется электролизом?
2. Укажите способы проведения процесса.
3. Опишете принцип работы электролизера.
4. Сформулируйте законы электролиза.
5. Какие процессы происходят при электролизе расплавов?
6. В чем различие электролиза расплавов и электролиза растворов?
7. Запишите процессы, происходящие на инертных электродах при электролизе водных растворов солей металлов с разной активностью.
8. Чем отличаются продукты электролиза водных растворов солей, содержащих анионы бескислородных и кислородсодержащих кислот?
9. В чем разница в процессах электролиза расплава и раствора хлорида натрия, сульфата алюминия, нитрата серебра?
10. Какие процессы происходят при электролизе с растворимым анодом? Как используется данный процесс?
11. Приведите примеры использования процессов электролиза.
1. Составьте уравнения катодных и анодных процессов, происходящих при электролизе гидроксида алюминия (расплав), хлорида меди (раствор), нитрата кобальта (раствор), фторида кальция (расплав).
2. Объясните, чем обусловлены различия между процессами электролиза расплава и электролиза раствора на примере фосфата натрия.
3. Для одной из солей, приведенных в задании 1, рассчитайте количество продуктов, выделившихся на инертных электродах, если процесс электролиза происходил в течение 35 минут при силе тока 15 А.
4. Определите молярную массу эквивалента металла, выделившегося на катоде, если при электролизе водного раствора соли этого металла на аноде выделилось 0,168 л кислорода.
5. Какова сила тока, пропущенного через раствор хлорида меди в течение 1,5 часов, если на аноде выделилось 33,6 л газа? Составьте уравнения процессов, происходящих на инертных катоде и аноде.
1. Коровин Н.В. Общая химия: учеб. рек. Мин. обр. РФ/ Н.В. Коровин. – М.: Высшая школа, 2009. – 558 с.
2. Глинка, Н.Л. Задачи и упражнения по общей химии: учеб. пособие: рек. Мин. обр. РФ/ Н.Л. Глинка. – Л.: Химия, 2006. – 240 с.
3. Ахметов, Н.С. Лабораторные и семинарские занятия по общей и неорганической химии: Учеб. пособие: Рек. Мин. обр. РФ / Ахметов Н.С., Азизова М.К., Бадыгина Л.И. — М.: Высш. шк., 2002. — 368с. с.
4. Тестовые задания по общей и неорганической химии с решениями и ответами: учеб. пособие / Р. А. Лидин [и др.]. – М.: БИНОМ; М.: Лаборатория знаний, 2004. – 231 с.
5. Родина, Т.А. Практикум по общей и неорганической химии: учеб. пособие/ Т.А. Родина, А.В. Иванов, В.И. Митрофанова; АмГУ, ИФФ. – Благовещенск: Изд-во Амур. гос. ун-та, 2008. – 208 с.
http://scienceforyou.ru/jelektrohimija/uravnenie-nernsta
http://helpiks.org/5-17292.html









 Рис.5. Образование контактного потенциала
Рис.5. Образование контактного потенциала