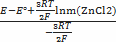Уравнение нернста для концентрационного элемента
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
3.5 ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
3.5.1 Электрические потенциалы на фазовых границах
При соприкосновении проводника первого рода (электрода) с полярным растворителем (водой) либо раствором электролита на границе электрод – жидкость возникает т.н. двойной электрический слой (ДЭС). В качестве примера рассмотрим медный электрод, погруженный в воду либо в раствор сульфата меди.
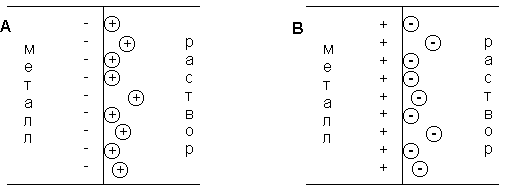
При погружении медного электрода в воду часть ионов меди, находящихся в узлах кристаллической решетки, в результате взаимодействия с диполями воды будет переходить в раствор. Возникающий при этом на электроде отрицательный заряд будет удерживать перешедшие в раствор ионы в приэлектродном пространстве – образуется двойной электрический слой (рис. 3.12а; о моделях строения ДЭС смотрите п. 4.2.4). Отрицательный заряд на электроде будет препятствовать дальнейшему переходу ионов меди в раствор, и через некоторое время установится динамическое равновесие, которое можно однозначно охарактеризовать потенциалом электрического поля ДЭС Φ, зависящего от заряда на электроде, или некоторой равновесной концентрацией ионов в приэлектродном слое Сo. При погружении медного электрода в раствор СuSО4, содержащий ионы меди в концентрации С возможны три случая:
Рис. 3.12 Схема двойного электрического слоя на границе электрод-раствор
1. С Сo. Поскольку концентрация ионов меди в поверхностном слое больше равновесной, начнется переход ионов из раствора в электрод; на электроде возникает положительный заряд и в поверхностном слое преобладают анионы SО4 2- (рис. 3.12b).
3. С = Сo. Поскольку концентрация ионов меди в поверхностном слое равна равновесной (такие растворы называют нулевыми), заряд на электроде не возникает, двойной электрический слой не образуется.
3.5.2 Гальванический элемент. ЭДС гальванического элемента
Рассмотрим простейший гальванический элемент Даниэля – Якоби, состоящий из двух полуэлементов – цинковой и медной пластин, помещенных в растворы сульфатов цинка и меди соответственно, которые соединены между собой посредством электролитического ключа – например, полоски бумаги, смоченной раствором какого-либо электролита. Схематически данный элемент изображается следующим образом:
Zn / Zn 2+ // Cu 2+ / Cu
На поверхности каждого из электродов имеет место динамическое равновесие перехода ионов металла из электрода в раствор и обратно, характеризуемое потенциалом ДЭС (зарядом на электроде q). Если соединить медный и цинковый электроды металлическим проводником, немедленно произойдет перераспределение зарядов – электроны начнут перемещаться с электрода с более отрицательным зарядом (в нашем случае – цинкового) на электрод с более положительным зарядом (медный), т.е. в проводнике возникнет электрический ток. Изменение величины заряда каждого из электродов нарушает равновесие – на цинковом электроде начнется процесс перехода ионов из электрода в раствор (окисление металла), на медном – из раствора в электрод (восстановление металла); при этом протекание процесса на одном электроде обусловливает одновременное протекание противоположного процесса на другом:
Электрод, на котором при работе гальванического элемента протекает процесс окисления, называется анодом , электрод, на котором идет процесс восстановления – катодом . При схематическом изображении гальванических элементов слева записывают анод, справа – катод (стандартный водородный электрод всегда записывают слева). Суммарный окислительно-восстановительный процесс, происходящий в гальваническом элементе, выражается следующим уравнением:
Т.о., гальванический элемент можно определить как прибор для преобразования химической энергии окислительно-восстановительной реакции в электрическую за счет пространственного разделения процессов окисления и восстановления. Работа, которую может совершить электрический ток, вырабатываемый гальваническим элементом, определяется разностью электрических потенциалов между электродами (называемой обычно просто разностью потенциалов) ΔΦ и количеством прошедшего по цепи электричества q:
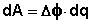
Работа тока гальванического элемента (и, следовательно, разность потенциалов), будет максимальна при его обратимой работе, когда процессы на электродах протекают бесконечно медленно и сила тока в цепи бесконечно мала. Максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента, есть электродвижущая сила (ЭДС) гальванического элемента .
3.5.3 Электродный потенциал. Уравнение Нернста
ЭДС гальванического элемента E удобно представлять в виде разности некоторых величин, характеризующих каждый из электродов – электродных потенциалов; однако для точного определения этих величин необходима точка отсчета – точно известный электродный потенциал какого-либо электрода. Электродным потенциалом электрода ε э называется ЭДС элемента, составленного из данного электрода и стандартного водородного электрода (см. ниже), электродный потенциал которого принят равным нулю. При этом знак электродного потенциала считают положительным, если в таком гальваническом элементе испытуемый электрод является катодом, и отрицательным, если испытуемый электрод является анодом. Необходимо отметить, что иногда электродный потенциал определяют как «разность потенциалов на границе электрод – раствор», т.е. считают его тождественным потенциалу ДЭС, что не вполне правильно (хотя эти величины взаимосвязаны).
Величина электродного потенциала металлического электрода зависит от температуры и активности (концентрации) иона металла в растворе, в который опущен электрод; математически эта зависимость выражается уравнением Нернста (здесь F – постоянная Фарадея, z – заряд иона):
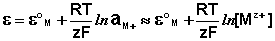
В уравнении Нернста ε ° – стандартный электродный потенциал , равный потенциалу электрода при активности иона металла, равной 1 моль/л. Стандартные электродные потенциалы электродов в водных растворах составляют ряд напряжений. Величина ε ° есть мера способности окисленной формы элемента или иона принимать электроны, т.е. восстанавливаться. Иногда различием между концентрацией и активностью иона в растворе пренебрегают, и в уравнении Нернста под знаком логарифма фигурирует концентрация ионов в растворе. Величина электродного потенциала определяет направление процесса, протекающего на электроде при работе гальванического элемента. На полуэлементе, электродный потенциал которого имеет большее (иногда говорят – более положительное) значение, будет протекать процесс восстановления, т.е. данный электрод будет являться катодом.
Рассмотрим расчёт ЭДС элемента Даниэля – Якоби с помощью уравнения Нернста. ЭДС всегда является положительной величиной и равна разности электродных потенциалов катода и анода:
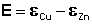
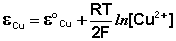
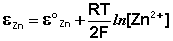
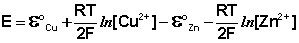
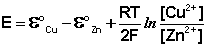
Как видно из уравнения (III.45), ЭДС элемента Даниэля – Якоби зависит от концентрации (точнее говоря, активности) ионов меди и цинка; при их равных концентрациях ЭДС элемента будет равна разности стандартных электродных потенциалов:
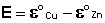
Анализируя уравнение (III.45), можно определить предел необратимой работы гальванического элемента. Поскольку на аноде идет процесс окисления цинка, концентрация ионов цинка при необратимой работе гальванического элемента постоянно увеличивается; концентрация ионов меди, напротив, уменьшается. Отношение концентраций ионов меди и цинка постоянно уменьшается и логарифм этого отношения при [Сu 2+ ] 2+ ] становится отрицательным. Т.о., разность потенциалов при необратимой работе гальванического элемента непрерывно уменьшается; при E = 0 (т.е. ε к = ε а) гальванический элемент не может совершать работу (необратимая работа гальванического элемента может прекратиться также и в результате полного растворения цинкового анода).
Уравнение (III.45) объясняет также и работоспособность т.н. концентрационных цепей – гальванических элементов, состоящих из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными активностями а1 > а2. Катодом в этом случае будет являться электрод с большей концентрацией, т.к. стандартные электродные потенциалы обоих электродов равны; для ЭДС концентрационного гальванического элемента получаем:
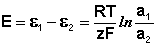
Единственным результатом работы концентрационного элемента является перенос ионов металла из более концентрированного раствора в менее концентрированный. Т.о., работа электрического тока в концентрационном гальваническом элементе – это работа диффузионного процесса, который проводится обратимо в результате пространственного разделения его на два противоположных по направлению обратимых электродных процесса.
Copyright © С. И. Левченков, 1996 — 2005.
Химические цепи без переноса (приведите пример). Зависимость ЭДС
Химических цепей без переноса от активности потенциалопределяющих ионов в
Растворе. Вывод и анализ уравнения Нернста.
Электрохимические цепи по наличию или отсутствию в цепи границы двух различных растворов (а значит и диффузионного потенциала) разделяют на цепи с переносом или без переноса соответственно.
В химических цепях источником электрической энергии является химическая реакция, протекающая в электрохимической системе. Химические цепи могут быть с переносом (имеется граница двух растворов или соединение через солевой мостик) и без переноса, где такой границы нет. Химические цепи построены из электродов различных по химической природе.
В гэ без переноса нет диффузионного потенциала, следовательно его не надо устранять. Точность измерения выше.
Примеры цепей без переноса:
Pt, Cl2 | KCl | AgCl(тв), Ag
Концентрационные цепи без переноса, приведите примеры. Для произвольно выбранного концентрационного элемента названного типа запишите химический процесс, протекающий в элементе. Вывод уравнения Нернста для расчёта ЭДС этого элемента.
Различают концентрационные цепи с переносом и без переноса.
Цепи без переноса строят из двух амальгамных электродов с разной концентрацией амальгам, сплавов или двух газовых электродов с разными давлениями газов, погруженных в один и тот же раствор. В этих цепях на электроде с большей концентрацией амальгамы, сплава или с большим давлением газа происходит ионизация атомов металла или газа, активность металла или газа уменьшается. На электроде с меньшей концентрацией будет происходить образование свободных атомов металла или молекул газа, их активность возрастает. Таким образом, в результате работы концентрационной цепи происходит выравнивание активностей компонентов на обоих электродах. Как и в химических цепях, электрод, на котором идет восстановление (присоединение электронов), будет положительным, где окисление – отрицательным.
Pt | Cl2 | KCl | Cl2 | Pt
71) Классификация гальванических элементов. Примеры концентрационных цепей. Уравнение Нернста для концентрационного элемента, составленного из двух амальгамных электродов. Определение полярности электродов.
Электрические цепи обычно классифицируют по двум признакам:
1) по источнику электрической энергии они делятся на химические и концентрационные;
2) по наличию или отсутствию в цепи границы двух различных растворов (а значит и диффузионного потенциала) на цепи с переносом или без переноса соответственно.
В химических цепях источником электрической энергии является химическая реакция, протекающая в электрохимической системе. Химические цепи могут быть с переносом (имеется граница двух растворов или соединение через солевой мостик) и без переноса, где такой границы нет. Химические цепи построены из электродов различных по химической природе.
В концентрационных цепях оба электрода идентичны как по физической природе, так и по химической природе участников окислительно–восстановительных процессов. Они отличаются только концентрациями компонентов. Знаки электродов определяются по реакциям на электродах, приводящим к выравниванию концентраций (активностей) веществ электродов.
Различают концентрационные цепи с переносом и без переноса.
Цепи без переноса строят из двух амальгамных электродов с разной концентрацией амальгам, сплавов или двух газовых электродов с разными давлениями газов, погруженных в один и тот же раствор. В этих цепях на электроде с большей концентрацией амальгамы, сплава или с большим давлением газа происходит ионизация атомов металла или газа, активность металла или газа уменьшается. На электроде с меньшей концентрацией будет происходить образование свободных атомов металла или молекул газа, их активность возрастает. Таким образом, в результате работы концентрационной цепи происходит выравнивание активностей компонентов на обоих электродах. Как и в химических цепях, электрод, на котором идет восстановление (присоединение электронов), будет положительным, где окисление – отрицательным.
Концентрационная цепь с переносом:
Ag | AgNO3 :: AgNO3 | Ag
Zn (Hg) | ZnSO4 | Zn(Hg)
В процессе выравнивания концентраций на правом электроде будет происходить образование (восстановление) цинка по реакции:
Zn(2+)+2ē = Zn (Hg) (a2)
Следовательно он положительный.
На левом – растворение (окисление) цинка:
Zn (Hg) (a1) = Zn(2+)+2ē
Следовательно он отрицательный.
Zn (Hg) (a1) = Zn (Hg) (a2)
E= -(RT/zF)*ln(a2/a1) > 0
72) . Концентрационные гальванические элементы, составленные из двух электродов первого рода, электрохимическая цепь с переносом. Уравнение Нернста для расчета ЭДС элемента. Дайте обоснование приведенного уравнения.
Концентрационная цепь с переносом:
(-)Ag | AgNO3 :: AgNO3 | Ag (+)
В ходе работы этого элемента активности должны выравниваться, т.е. а1 возрастать, а а2 убывать
E = (RT/zF)*ln(a2/a1) > 0
73) Концентрационные гальванические элементы. Приведите пример концентрационного гальванического элемента, составленного из двух электродов второго рода. Как определить полярность электродов данного элемента? Запишите уравнение Нернста для представленного элемента и дайте необходимые пояснения.
выводила сама, не уверена
(-) Ag | AgBr | Br(-) :: Br (-) | AgBr | Ag (+)
Ag+ (а1) Br (-)= AgBr + ē
AgBr + ē= Ag +(а2) Br(-)
Зависимость ЭДС гальванического элемента от температуры. Определение изменения термодинамических функций окислительно-восстановительных реакций потенциометрическим методом. Проиллюстрируйте процедуру расчета на произвольном примере
Предложите гальванический элемент, с помощью которого возможно определить средний ионный коэффициент активности соли AB (дан конкретный сильный электролит) в водном растворе. Получите выражение для расчета коэффициента активности
Предложите гальванический элемент, с помощью которого возможно определить средний ионный коэффициент активности соли AB (дан конкретный сильный электролит) в водном растворе. Получите выражение для расчета коэффициента активности.
Средний коэффициент активности электролита и, следовательно, среднюю активность электролита можно определить методом измерения электродвижущих сил гальванических элементов без переноса. Для этого используют элемент, составленный из электродов, один из которых обратим по отношению к катионам, а другой – по отношению к анионам соединения. Электроды опускают в один и тот же раствор электролита.
E=E°- 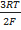
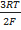
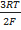
lnγ (ZnCl2) =
Предложите гальванический элемент, с помощью которого можно определить рН исследуемого раствора. Запишите уравнение Нернста для каждого из электродов электрохической цепи. Получите уравнение для расчета рН раствора.
При измерении рН р-ра в качестве индикаторного электрода обычно используют стеклянный, электродом сравнения мб хлорсеребряный или каломельный электрод.
Если в качестве электрода сравнения применить хлорсеребряный, то электрохимическая цепь будет иметь вид:
Cu|Ag,AgCl|HCl(р-р, 0,1M)|стекло|исследуемый р-р(a H+)¦¦KCl|AgCl,Ag|Cu.
Eст = E ст°- 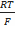
Пример,
Составьте гальванический элемент, по измеренной ЭДС которого возможно определить парциальное давление азота в азот-водородной газовой смеси, находящейся под давлением Р. Запишите уравнение Нернста для используемого гальванического элемента, назовите все входящие в него величины.
Уравнение нернста для концентрационного элемента
Вернемся к «классическому» гальваническому элементу, описанному в первой части статьи. Есть два сосуда. В каждом из сосудов пластинка из металла опущена в раствор соли этого же металла. Эти два сосуда — с разными металлами — соединены солевым мостиком (ионный проводник), а две пластинки из разных металлов — электронным проводником (проводом). Для меди и цинка это выглядит так:
Гальванический элемент Потенциал такого гальванического элемента — электродвижущая сила (ЭДС) равна разнице потенциалов медного и цинкового электродов (полуэлементов): ЭДС = Е(Cu 2+ /Cu) — Е(Zn 2+ /Zn) Потенциал медного и цинкового электродов (полуэлементов), в свою очередь, зависит от концентрации ионов меди (цинка) в растворе. Если концентрация ионов меди (цинка) отличается от стандартной (1 моль/л), потенциал электрода рассчитывают по уравнению Нернста: где: Е 0 — стандартный электродный потенциал в В; R — универсальная газовая постоянная 8.31 Дж/(моль·K); F — постоянная Фарадея 96485.35 Кл/моль; Т — абсолютная температура в К; n — число электронов, которые участвуют в реакции (в нашем случае для меди и цинка n = 2); aox и ared — концентрации (точнее — активности) окислителя и восстановителя. Если подставить в уравнение значения R и F (они ведь константы), принять температуру равной Т= 298К (25°С) и перейти от натуральным логарифмов к десятичным [ lg(X) ≈ 0.43429 ln(X)], уравнение Нернста упростится: уравнение еще больше упростится, поскольку в растворе есть только окислитель (катион Zn 2+ ), но нет восстановителя (восстановитель — металлический цинк Zn, он в твердой фазе — поэтому из уравнения исключается): Аналогично выглядит и уравнение для медного электрода. Зная концентрацию меди и цинка в растворе возле электродов, мы сможем вычислить Е(Cu 2+ /Cu) и Е(Zn 2+ /Zn), затем — ЭДС гальванического элемента. А теперь, внимание: что будет, если в нашем гальваническом элементе заменить цинковый электрод медным? — Т.е. сделать гальванический элемент из двух медных электродов, опущенных в раствор соли меди? Где потенциалы левого и правого медных электродов — Е1(Cu 2+ /Cu) и Е2(Cu 2+ /Cu); их можно рассчитать по уравнению Нернста: Без всяких расчетов видно, что если в обоих сосудах концентрации (активности) ионов меди — a1(Cu 2+ ) и a2(Cu 2+ ) равны, то равны будут и потенциалы обеих электродов Е1(Cu 2+ /Cu) = Е2(Cu 2+ /Cu). Следовательно ЭДС = 0 . Ток в цепи течь не будет. Если же концентрации ионов меди в правом и левом сосудах будут отличаться [ a1(Cu 2+ ) ≠ a2(Cu 2+ ) ] — будут отличаться и потенциалы правого и левого электродов (поскольку потенциал медного электрода зависит от концентрации ионов меди в растворе — что очевидно из уравнения Нернста). Следовательно, ЭДС ≠ 0 — в цепи потечет электрический ток. И хотя обе медных пластинки были одинаковы, одна из них будет растворяться (в сосуде, где концентрация ионов меди меньше), а другая — наращиваться (в сосуде, где концентрация ионов меди больше). Процесс будет идти до тех пор, пока концентрация ионов меди в обоих сосудах не сравняется (или пока один из медных электродов полностью не растворится). |
Концентрационный гальванический элемент ЭДС = Е2(Cu 2+ /Cu) — Е1(Cu 2+ /Cu)= Попробуем рассчитать напряжение концентрационного элемента. Например, a2(Cu 2+ ) = 1 моль/л и a1(Cu 2+ ) = 0.1 моль/л — т.е. концентрации ионов меди в двух стаканах отличаются в 10 раз. Примерно 0.03 В (30 мВ) — немного, но такое напряжение вполне можно измерить тестером. Решил все упростить и провести опыт в мерном цилиндре на 100 мл. Идея такая: оба медных электрода находятся в одном и том же сосуде, но контактируют с раствором сульфата меди разной концентрации. Это очень просто. На дно цилиндра насыпал несколько грамм медного купороса, добавил немного воды, встряхнул — чтобы соль частично растворилась. Воды было заведомо недостаточно, чтобы растворить весь медный купорос и бОльшая его часть осталась в виде осадка на дне. Цилиндр закрепил в штативе. Потом аккуратно, небольшими порциями стал добавлять в цилиндр дистиллированную воду — так, чтобы она стекала вниз по стенкам цилиндра и не смешивалась с раствором на дне. Воду добавил почти доверху. Раствор сульфата меди (вместе с осадком) был на дне, а поверх его — вода. Четкой границы, как между маслом и водой, не получилось: синий раствор плавно переходил в бесцветную воду. Снизу жидкость была синей, выше — бледно-синей, еще выше — чуть заметно синей. Верхние слои жидкости были бесцветными: синей окраски катионов меди в них не было заметно (очень разбавленный раствор катионов меди). На дно раствора нужно было опустить изолированный медный провод, причем с нижней части провода изоляция была снята — в результате медь контактировала бы с кристаллами сульфата меди, с его насыщенным раствором, но не контактировала бы с разбавленным раствором сульфата меди и очень разбавленным раствором сульфата меди — поскольку средняя и верхняя часть провода были заизолированы. Это первый электрод нашего гальванического элемента: медь, опущенная в раствор соли меди с более высокой концентрацией. Сверху цилиндра закрепил расплющенную медную трубку — чтобы она контактировала только с «чистой» водой (очень разбавленный раствор катионов меди). Это второй электрод нашего гальванического элемента: медь, опущенная в раствор соли меди с более низкой концентрацией. Осталось бы только замкнуть цепь — соединить электроды с клеммами тестера. Но я сделал чуть по-другому: поместил медные электроды в цилиндр до того, как долил поверх раствора сульфата меди дистиллированную воду, подключил к электродам клеммы тестера — и только потом долил в цилиндр поверх раствора сульфата меди дистиллированную воду. Когда вода покрыла верхний электрод — цепь замкнулась. Потек электрический ток. Напряжение небольшое: в первые мгновения — 0.10-0.09 В, потом быстро упало до 0.03-0.02 В, но на бОльшее не стоило и надеяться (выше мы уже провели расчет потенциала концентрационного элемента с медными электродами — получилось 0.03 В). Итак, нам удалось сконструировать концентрационный гальванический элемент. Очень примитивный, зато он работает. |
Концентрационный гальванический элемент |
Но это еще не все: можно продемонстрировать зависимость потенциала нашего элемента от разницы концентраций ионов меди возле электродов. В нашем мерном цилиндре концентрация катионов меди падает при движении со дна цилиндра вверх (причем очень неравномерно — большая часть растворенного сульфата меди в самом низу). На дне находится насыщенный раствор сульфата меди, сверху — очень разбавленный раствор сульфата меди. Верхний электрод закреплен прищепкой (он контактирует с очень разбавленным раствором ионов меди). Нижний электрод — изолированный медный провод, который просто лежит на дне. Его можно двигать вверх-вниз (только очень аккуратно, чтобы не перемешать раствор!). Если электрод поднимать вверх, то он будет контактировать с раствором сульфата меди со все более низкой концентрацией — в результате напряжение гальванического элемента будет падать (в идеале — до 0 В, когда он окажется в том же очень разбавленном растворе, что и верхний электрод). Теперь если электрод постепенно опускать вниз (на дно) — разница потенциалов будет расти, пока не вернется к первоначальному значению, поскольку нижний электрод будет контактировать с раствором сульфата меди со все более высокой концентрацией Cu 2+ и, наконец, он снова окажется в насыщенном растворе на дне. Теория — теорией. Теперь — практика. Поскольку напряжение нашего гальванического элемента низкое, переключил шкалу тестера на милливольты (1мВ = 0.001 В). Нужно было это сделать сразу, но лучше поздно, чем никогда. Показания — 22 мВ. Поднимаю нижний электрод верх. На границе, где интенсивно-синий раствор переходит в слегка синий — уже 20 мВ, а дальше падение пошло стремительнее: на полвысоты цилиндра — 6 мВ, еще выше и 0 мВ — напряжение упало до нуля, хотя нижний электрод был все еще на несколько сантиметров ниже верхнего (закрепленного) электрода. Еще выше (уже выше низа верхнего электрода) и разница потенциалов — минус 1 мВ, еще выше — минус 4 мВ — электроны пошли в противоположном направлении! Опускаю электрод вниз. Электроны снова должны потечь в прежнем направлении, а напряжение — снова расти. Но не тут-то было! Да — направление тока изменилось на первоначальное и, по мере опускания электрода, напряжение снова стало расти. Но при поднятии и опускании электрода проявилась сильная асимметрия напряжения. По мере опускания электрода напряжение росло гораздо медленнее, чем до этого падало во время подъема электрода вверх. Например, на половине высоты цилиндра напряжение было все еще минус 4 мВ (электроны текли в обратном направлении), ноль был достигнут только на границе интенсивно-синего и бледно-синего растворов (т.е. почти у самого дна), при дальнейшем погружении электрода постепенно восстановилось прежнее напряжение 23 мВ. Почему наблюдалась такая асимметрия? Одна из явных причин в том, что электродное равновесие достигается далеко не мгновенно, причем явно медленнее, чем я опускал и поднимал электрод. |
Поднимаю электрод |
Опускаю электрод (на дно) |
После напряжения решил измерить силу тока. Когда нижний электрод находился на дне, сила тока составила 15 мкА (микроампер, 1 мкА = 10 -6 А), когда стал поднимать электрод — ток постепенно упал сначала до нуля, а потом электроны потекли в противоположном направлении (знак «-» перед показаниями тестера), сила тока составила 2 мкА. Когда постепенно опустил электрод вниз, электроны снова потекли в первоначальном направлении, сила тока прошла через ноль, затем выросла до первоначального значения. Как и в случае напряжения, наблюдалась асимметрия — при погружении электрода ток рос гораздо медленнее, чем падал при поднятии электрода. источники: http://megaobuchalka.ru/15/3532.html http://chemistry-chemists.com/N7_2014/ChemistryAndChemists_7_2014-P8-7.html |