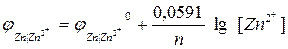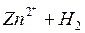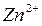Уравнение нернста для медного электрода имеет вид
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
3.5 ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
3.5.1 Электрические потенциалы на фазовых границах
При соприкосновении проводника первого рода (электрода) с полярным растворителем (водой) либо раствором электролита на границе электрод – жидкость возникает т.н. двойной электрический слой (ДЭС). В качестве примера рассмотрим медный электрод, погруженный в воду либо в раствор сульфата меди.
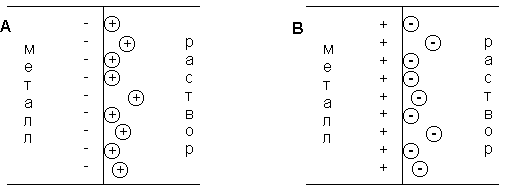
При погружении медного электрода в воду часть ионов меди, находящихся в узлах кристаллической решетки, в результате взаимодействия с диполями воды будет переходить в раствор. Возникающий при этом на электроде отрицательный заряд будет удерживать перешедшие в раствор ионы в приэлектродном пространстве – образуется двойной электрический слой (рис. 3.12а; о моделях строения ДЭС смотрите п. 4.2.4). Отрицательный заряд на электроде будет препятствовать дальнейшему переходу ионов меди в раствор, и через некоторое время установится динамическое равновесие, которое можно однозначно охарактеризовать потенциалом электрического поля ДЭС Φ, зависящего от заряда на электроде, или некоторой равновесной концентрацией ионов в приэлектродном слое Сo. При погружении медного электрода в раствор СuSО4, содержащий ионы меди в концентрации С возможны три случая:
Рис. 3.12 Схема двойного электрического слоя на границе электрод-раствор
1. С Сo. Поскольку концентрация ионов меди в поверхностном слое больше равновесной, начнется переход ионов из раствора в электрод; на электроде возникает положительный заряд и в поверхностном слое преобладают анионы SО4 2- (рис. 3.12b).
3. С = Сo. Поскольку концентрация ионов меди в поверхностном слое равна равновесной (такие растворы называют нулевыми), заряд на электроде не возникает, двойной электрический слой не образуется.
3.5.2 Гальванический элемент. ЭДС гальванического элемента
Рассмотрим простейший гальванический элемент Даниэля – Якоби, состоящий из двух полуэлементов – цинковой и медной пластин, помещенных в растворы сульфатов цинка и меди соответственно, которые соединены между собой посредством электролитического ключа – например, полоски бумаги, смоченной раствором какого-либо электролита. Схематически данный элемент изображается следующим образом:
Zn / Zn 2+ // Cu 2+ / Cu
На поверхности каждого из электродов имеет место динамическое равновесие перехода ионов металла из электрода в раствор и обратно, характеризуемое потенциалом ДЭС (зарядом на электроде q). Если соединить медный и цинковый электроды металлическим проводником, немедленно произойдет перераспределение зарядов – электроны начнут перемещаться с электрода с более отрицательным зарядом (в нашем случае – цинкового) на электрод с более положительным зарядом (медный), т.е. в проводнике возникнет электрический ток. Изменение величины заряда каждого из электродов нарушает равновесие – на цинковом электроде начнется процесс перехода ионов из электрода в раствор (окисление металла), на медном – из раствора в электрод (восстановление металла); при этом протекание процесса на одном электроде обусловливает одновременное протекание противоположного процесса на другом:
Электрод, на котором при работе гальванического элемента протекает процесс окисления, называется анодом , электрод, на котором идет процесс восстановления – катодом . При схематическом изображении гальванических элементов слева записывают анод, справа – катод (стандартный водородный электрод всегда записывают слева). Суммарный окислительно-восстановительный процесс, происходящий в гальваническом элементе, выражается следующим уравнением:
Т.о., гальванический элемент можно определить как прибор для преобразования химической энергии окислительно-восстановительной реакции в электрическую за счет пространственного разделения процессов окисления и восстановления. Работа, которую может совершить электрический ток, вырабатываемый гальваническим элементом, определяется разностью электрических потенциалов между электродами (называемой обычно просто разностью потенциалов) ΔΦ и количеством прошедшего по цепи электричества q:
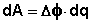
Работа тока гальванического элемента (и, следовательно, разность потенциалов), будет максимальна при его обратимой работе, когда процессы на электродах протекают бесконечно медленно и сила тока в цепи бесконечно мала. Максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента, есть электродвижущая сила (ЭДС) гальванического элемента .
3.5.3 Электродный потенциал. Уравнение Нернста
ЭДС гальванического элемента E удобно представлять в виде разности некоторых величин, характеризующих каждый из электродов – электродных потенциалов; однако для точного определения этих величин необходима точка отсчета – точно известный электродный потенциал какого-либо электрода. Электродным потенциалом электрода ε э называется ЭДС элемента, составленного из данного электрода и стандартного водородного электрода (см. ниже), электродный потенциал которого принят равным нулю. При этом знак электродного потенциала считают положительным, если в таком гальваническом элементе испытуемый электрод является катодом, и отрицательным, если испытуемый электрод является анодом. Необходимо отметить, что иногда электродный потенциал определяют как «разность потенциалов на границе электрод – раствор», т.е. считают его тождественным потенциалу ДЭС, что не вполне правильно (хотя эти величины взаимосвязаны).
Величина электродного потенциала металлического электрода зависит от температуры и активности (концентрации) иона металла в растворе, в который опущен электрод; математически эта зависимость выражается уравнением Нернста (здесь F – постоянная Фарадея, z – заряд иона):
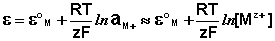
В уравнении Нернста ε ° – стандартный электродный потенциал , равный потенциалу электрода при активности иона металла, равной 1 моль/л. Стандартные электродные потенциалы электродов в водных растворах составляют ряд напряжений. Величина ε ° есть мера способности окисленной формы элемента или иона принимать электроны, т.е. восстанавливаться. Иногда различием между концентрацией и активностью иона в растворе пренебрегают, и в уравнении Нернста под знаком логарифма фигурирует концентрация ионов в растворе. Величина электродного потенциала определяет направление процесса, протекающего на электроде при работе гальванического элемента. На полуэлементе, электродный потенциал которого имеет большее (иногда говорят – более положительное) значение, будет протекать процесс восстановления, т.е. данный электрод будет являться катодом.
Рассмотрим расчёт ЭДС элемента Даниэля – Якоби с помощью уравнения Нернста. ЭДС всегда является положительной величиной и равна разности электродных потенциалов катода и анода:
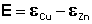
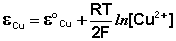
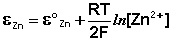
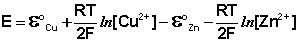
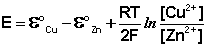
Как видно из уравнения (III.45), ЭДС элемента Даниэля – Якоби зависит от концентрации (точнее говоря, активности) ионов меди и цинка; при их равных концентрациях ЭДС элемента будет равна разности стандартных электродных потенциалов:
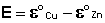
Анализируя уравнение (III.45), можно определить предел необратимой работы гальванического элемента. Поскольку на аноде идет процесс окисления цинка, концентрация ионов цинка при необратимой работе гальванического элемента постоянно увеличивается; концентрация ионов меди, напротив, уменьшается. Отношение концентраций ионов меди и цинка постоянно уменьшается и логарифм этого отношения при [Сu 2+ ] 2+ ] становится отрицательным. Т.о., разность потенциалов при необратимой работе гальванического элемента непрерывно уменьшается; при E = 0 (т.е. ε к = ε а) гальванический элемент не может совершать работу (необратимая работа гальванического элемента может прекратиться также и в результате полного растворения цинкового анода).
Уравнение (III.45) объясняет также и работоспособность т.н. концентрационных цепей – гальванических элементов, состоящих из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными активностями а1 > а2. Катодом в этом случае будет являться электрод с большей концентрацией, т.к. стандартные электродные потенциалы обоих электродов равны; для ЭДС концентрационного гальванического элемента получаем:
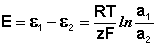
Единственным результатом работы концентрационного элемента является перенос ионов металла из более концентрированного раствора в менее концентрированный. Т.о., работа электрического тока в концентрационном гальваническом элементе – это работа диффузионного процесса, который проводится обратимо в результате пространственного разделения его на два противоположных по направлению обратимых электродных процесса.
Copyright © С. И. Левченков, 1996 — 2005.
Краткие теоретические седения
Федеральное бюджетное образовательное учреждение
Высшего профессионального образования
«САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ
МОРСКОЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Гармашова И.В., Даниловская Л.П.
Методические указания для самостоятельной подготовки студентов к лабораторному занятию по теме
ЭЛЕКТРОХИМИЯ:
Гальванический элемент, электродные потенциалы
Санкт-Петербург
Краткие теоретические седения
Электрохимия — это раздел физической химии, изучающий взаимопревращение химической энергии в электрическую.
В технике применяется два основных электрохимических процесса, имеющих общую природу:
§ получение электрической энергии за счет химических реакций (химические источники тока);
§ протекание химических реакций под действием электрического тока (электролиз).
Взаимное превращение электрической и химической форм энергии происходит в электрохимических системах, состоящих из:
– проводников первого рода – веществ, обладающих электронной проводимостью и находящихся в контакте с электролитом — металлов;
– проводников второго рода – веществ, обладающих ионной проводимостью – электролитов.
ПОНЯТИЕ ОБ ЭЛЕКТРОДНОМ ПОТЕНЦИАЛЕ
При погружении металла в раствор происходит переход катионов с металла в раствор или из раствора на металл. На границе раздела двух фаз (металл-раствор) происходит перенос электрического заряда, т.е. протекает электрохимическая реакция, которая приводит к возникновению скачка потенциала.
Металлическая пластинка, погруженная в раствор электролита, называется электродом.
Переход ионов прекращается после установления динамического равновесия, заключающегося в том, что скорость растворения ионов равна скорости обратного процесса – выделения их на поверхность металла.
Возьмем две металлические пластинки, например, цинковую и медную. При погружении цинковой пластинки, более активного металла, в раствор соли цинка ZnSO4 происходит отрыв ионов цинка Zn 2 + от кристаллической решетки металла под влиянием полярных молекул растворителя (рис.1). В результате перехода катионов в раствор металл приобретает отрицательный заряд за счет оставшихся на нем электронов, а прилежащий к нему слой раствора заряжается положительно за счет катионов, удерживаемых отрицательным зарядом металла. При погружении медной пластинки, менее активного металла, происходит процесс осаждения катионов из раствора на металле. Пластинка приобретает положительный заряд (рис. 1).
Рис. 1. Механизм возникновения электродного потенциала
Схема записи цинкового электрода: Zn|Zn 2+
Реакция, протекающая в элементе: 
Схема записи медного электрода: Cu 2+ |Cu
Реакция, протекающая в элементе: 
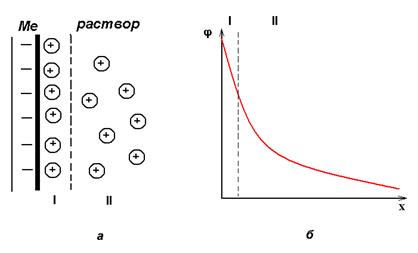
Переход заряженных частиц через границу «раствор-металл» сопровождается возникновением на границе раздела фаз двойного электрического слоя (ДЭС). ДЭС создается электрическими зарядами, находящимися на металле, и ионами противоположного заряда, ориентированными в растворе у поверхности электрода (рис.2).
Рис. 2 Структура двойного электрического слоя
а – строение ДЭС;
б- распределение потенциала в ДЭС.
I – плотная часть ДЭС, II – диффузная часть ДЭС
Между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом или потенциалом электрода (φ). Эти потенциалы ограничивают процесс дальнейшего перемещения ионов с металла на металл. По мере удаления ионов от границы раздела величина потенциала в двойном электрическом слое убывает.
Потенциалы, возникающие на металлах, погруженных в растворы собственных солей, называются равновесными электродными потенциалами(φ р ).
Величина равновесного электродного потенциала зависит от природы электрода, температуры и концентрации ионов металла в растворе и выражается уравнением Нернста:

где j 0 – величина стандартного электродного потенциала, измеренного при Т =298 К в растворе соли этого же металла с концентрацией ионов металла Me n + , равной 1 моль/л (величины стандартных электродных потенциалов металлов указаны в ряду напряжений металлов; см. приложение №1);
R – универсальная газовая постоянная (8,314 Дж/моль·К)
T —температура в Кельвинах (K)
n– число электронов, участвующих в электродном процессе (или заряд катиона);
F – постоянная Фарадея (96,485 Кл/моль);
[Me n + ] – концентрация ионов Me n + в растворе (моль/л)
При температуре 25 0 C и множителя 2,303 для перехода от натуральных логарифмов и десятичным комбинация физических констант в уравнении (1) будет иметь вид:
Таким образом, уравнение Нернста примет вид:

Например, в электродной системе протекает полуреакция

Следовательно, уравнение Нернста для цинкового электрода можно записать как:
На металле, погруженном в электролит, не содержащий ионов этого металла (морская вода, раствор кислоты и т.п.), возникает неравновесный (коррозионный) потенциал ( 
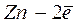


Значения абсолютных величин электродных потенциалов принципиально измерить невозможно. Следовательно, ограничиваются нахождением относительных величин электродных потенциалов по отношению к другому электроду, принятому в качестве стандартного электрода сравнения.
Основным стандартным электродом, потенциал которого условно принят за нуль, является водородный электрод(рис. 3). С ним сравнивают потенциалы других электродов.
Рис. 3. Схема устройства водородного электрода
Водородный электрод состоит из платиновой проволоки с приваренной к ней пластинки, покрытой платиновой чернью, погруженной в раствор кислоты с активностью ионов водорода, равной 1 моль/л. В сосуд подают химически чистый водород под давлением 1 атм.
Схема записи водородного электрода:
2 H + |H2(Pt).
На границе раздела фаз устанавливается равновесие:

Уравнение Нернста для расчета величины водородного электродного потенциала (n=1) имеет вид:
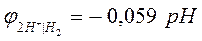
На практике для измерения электродных потенциалов металлов в качестве электрода сравнения не используют водородный электрод, т.к. он сложен в изготовлении и эксплуатации.
В качестве электрода сравнения используют хлорсеребряный электрод (см. приложение 2)
По величине стандартных электродных потенциалов (φ 0 ) металлические электроды располагаются в определенной последовательности, называемой электрохимическим рядом напряжений (см. приложение1).Положительные величины φ 0 указывают на то, что на данном электроде будет протекать реакция восстановления, а отрицательные величины φ 0 соответствуют тому, что на нем пойдет процесс окисления. Чем меньше значение φ 0 – потенциала, тем активнее металл.
Металлы с отрицательным значением потенциала вытесняют водород из растворов разбавленных кислот. Каждый металл способен вытеснять из растворов солей другие, менее активные металлы металлы, которые имеют большее алгебраическое значение потенциала. Так, если погрузить в раствор CuSO4 пластину из цинка, то часть ее растворится, а из раствора на поверхности пластины выделится красноватый слой меди:

Энергия этой окислительно-восстановительной реакции может быть превращена в электрическую энергию. Однако для этого необходимо пространственное разделение процессов окисления и восстановления.
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
Гальванические элементы относятся к химическим источникам электрического тока и позволяют получать ток за счет самопроизвольного протекания химической реакции.
Гальваническим элементомназывается обратимая электрохимическая система, состоящая из двух электродов, погруженных в раствор электролита, в которой энергия окислительно-восстановительного процесса превращается в электрическую.
Гальванический элемент состоит из двух электродов, различающихся величиной φ-потенциалов. Электрод с меньшим значением φ-потенциала является анодом, а электрод с бỏльшим значением потенциала – катодом.
Устройство и принцип работы гальванического элемента можно рассмотреть на примере электрохимического элемента Якоби-Даниэля (рис. 4).
Рис. 4. Устройство элемента Якоби-Даниэля
Такой элемент имеет электроды из цинка и меди, погруженные в сернокислые растворы этих металлов. Емкости соединены между собой солевым мостиком, заполненным раствором хлорида калия (KCl).
При замыкании цепи гальванического элемента между цинковым электродом и раствором электролита идет реакция окисления, т.е. цинковая пластинка растворяется:

Ионы цинка из электрода переходят в раствор, а на электроде остаются электроны. Следовательно, цинковая пластинка заряжается отрицательно и становится анодом.
Между медным электродом и окружающим его раствором CuSO4 идет реакция восстановления:

Ионы меди из раствора осаждаются на медном электроде, который приобретает положительный заряд и становится катодом.
ЗАПОМНИТЕ!О к и с л е н и е – отдача электронов – происходит н а а н о д е, в о с с т а н о в л е н и е – приобретение электронов – н а к а т о д е. В гальваническом элементе анод имеет знак «-», а катод имеет знак «+».
Для гальванического элемента принята следующая форма записи:
 |
А(-) Zn | ZnSO4 || CuSO4 | Cu (+)К,
где вертикальная линия | обозначает границу раздела фаз, а двойная вертикальная линия || — солевой мостик. Гальванический элемент принято записывать так, чтобы анод находился слева.
Источником электрической энергии в элементе служит окислительно-восстановительная реакция, называемая суммарной или разрядной:
Cu 2+ + Zn = Cu + Zn 2+
Важнейшей характеристикой гальванического элемента является электродвижущая сила (ЭДС), которая определяется как предельная разность потенциалов, возникающая на границе раздела фаз в разомкнутой цепи элемента.
Э Д С – количественная характеристика эффективности работы гальванического элемента – она показывает, насколько полно осуществляется процесс перехода химической энергии в электрическую.
Величина Е всегда положительна (Е>0).
Для медно-цинкового гальванического элемента ЭДС равна:

Работа гальванического элемента связана с уменьшением энергии Гиббса 
А = — 



Применение уравнения Нернста в решении задач.
При рассмотрении вопроса об окислительно-восстановительных реакциях часто возникает необходимость расчета электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций. В справочниках обычно приведены таблицы т.н. стандартных потенциалов тех или иных процессов, рассчитанных при р=1 атм, Т=298К и активностях участников равных 1. Однако в реальных задачах условия могут значительно отличаться от указанных выше. Как быть в таком случае? Ответ дает уравнение Нернста. В оригинальном виде оно выглядит так:
Как можно заметить, в уравнении фигурируют несколько постоянных величин. Также температура в подавляющем большинстве случаев равна 298К. Кроме того, можно заменить натуральный логарифм на десятичный. Это можно сделать путем умножения на коэффициент перевода. Если собрать все постоянные в единый множитель, то приходим к несколько иному, но более знакомому по учебным пособиям виду уравнения Нернста:
Такой вариант уравнения сильно облегчает жизнь в ряде случаев, например рассмотрении рН-зависимых процессов. Используя данное уравнение можно провести вычисления в любых условиях, приведенных в задаче. Рассмотрим характерные примеры задания по данной теме.
Пример 1:
Рассчитать ЭДС гальванического элемента, составленного из медной и цинковой пластин, погруженных в растворы 0.1М CuSO4 и 0.01М ZnSO4 соответственно. Коэффициенты активности ионов Cu 2+ и Zn 2+ принять равными единице.
Решение:
Для начала запишем уравнения протекающих процессов:
Далее находим по таблице стандартные потенциалы процессов:
Если в условиях задачи ничего не сказано про коэффициенты активности ионов, то можно считать их равными единице, как и в нашем случае. Тогда активности участников процессов можно принять равными их аналитическим концентрациям.
Найдем реальные потенциалы с учетом нестандартных активностей ионов:
Далее необходимо сравнить полученные величины между собой, чтобы определить, кто из участников процесса – окислитель. Потенциал меди больше, чем у цинка, поэтому она будет окислителем. Тогда найдем ЭДС системы:
Ответ: 1.13 В
Пример 2:
Одним из лабораторных способов получения хлора является действие KMnO4 на концентрированную соляную кислоту. Можно ли провести процесс при рН=4?
Решение:
Для начала запишем уравнения протекающих процессов.
Далее находим по таблице стандартные потенциалы процессов:
Несложно заметить, что от рН в данном случае зависит только потенциал перманганата. Тогда воспользуемся уравнением Нернста и рассчитаем его реальный потенциал в условиях задачи:
Получается, что потенциал KMnO4 стал меньше, чем у хлора, а значит, реакция не пойдет.
http://poisk-ru.ru/s35030t11.html
http://scienceforyou.ru/jelektrohimija/uravnenie-nernsta