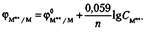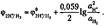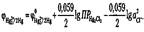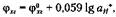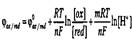рН-зависимые электродные потенциалы
ЭЛЕКТРОДЫ 1-ГО ПОРЯДКА
Металлический электрод
Металлический электрод является электродом первого рода и представляет собой металл, погруженный в раствор его соли. Уравнение Нернста для металлического электрода приобретает следующий вид (при 298,15 К)
где ам и а m n + — активности металла и его ионов, соответственно.
Принято, что активность любого чистого кристаллического вещества равна единице (ам = 1), и, таким образом, она устраняется из формулы. Это вполне согласуется с тем, что скорость любой химической реакции не зависит от концентрации твердого вещества в объеме фазы, а может зависеть лишь от площади поверхности. В данном случае, чем больше поверхность металла, тем больше скорость ухода ионов в раствор и скорость их обратного перехода в кристаллическую решетку металла. Таким образом,
В очень разбавленном растворе, где активности мало отличаются от концентраций (ам п+ = См n + ) вместо активной концентрации можно подставить молярную концентрацию:
В этой формуле ф°м n + /м — стандартный потенциал металлического электрода при активности катионов, равной 1 моль/л, который зависит от температуры и природы металла.
По мере роста величины потенциала металлического электрода падает восстановительная активность металла. Эта зависимость известна как ряд напряжений металлов, впервые сформулированный Н. Н. Бекетовым.
Потенциал металлического электрода зависит только от концентрации катионов металла и не зависит от концентрации анионов. Следовательно, металлический электрод относится к электродам первого рода.
Водородный электрод
К числу электродов первого рода принадлежит и водородный электрод, стандартный потенциал которого условно принят за ноль.
Водородный электрод представляет собой пластинку из инертного металла (платины), погруженную в раствор, содержащий ионы водорода, например, в раствор Н25О4(рис. 12.1). Предварительно электролизом раствора хлорида платины на пластинку наносится слой платиновой черни. Такая платинированная пластинка обладает большой активной поверхностью и способна поглощать большое количество водорода. Через раствор пропускают ток чистого газообразного водорода при постоянном давлении (100 кПа).
Газообразный водород адсорбируется на платине и затем, распадаясь на атомы, переходит в раствор в виде ионов. Таким образом, между атомами водорода на платине и ионами водорода в растворе в водородном электроде устанавливается равновесие:
Схематически водородный электрод записывается так:
Очевидно, что он аналогичен металлическому электроду.
Применяя уравнение Нернста при 298,15 К для водородного электрода, получим:
Активность газа ан2 равна его давлению ан2 = рн2 , тогда при давлении ри2 = 100 кПа
Таким образом, потенциал водородного электрода зависит от активности ионов водорода и, следовательно, его можно применять для измерения рН . При отсутствии посторонних окислителей и восстановителей водородный электрод является самым точным электродом для измерения кислотности среды в широком интервале рН — от сильнокислой до сильнощелочной среды.
Посторонними окислителями могут быть многие органические вещества, способные восстанавливаться водородом в присутствии платины. Платина легко отравляется галогенами, соединениями серы, ртути и мышьяка, которые уменьшают ее способность поглощать водород. Установка для измерения рН с водородным электродом включает электролизер для получения водорода и систему поглотительных склянок для тщательной очистки водорода от других газов и потому является громоздкой. Кроме того, перед измерением рН требуется длительное насыщение раствора водородом.
Поэтому вместо водородного в качестве электродов сравнения, как правило, использл’ ют каломельный и хлорсеребряный электроды.
ЭЛЕКТОРОДЫ 2-ГО ПОРЯДКА
Каломельный электрод
К электродам второго рода, как уже отмечено, принадлежат электроды, обратимые относительно катиона и аниона. В электродах второго рода металл погружен в раствор своей труднорастворимой соли и хорошо растворимого электролита с одноименным анионом.
Так, каломельный электрод состоит из металлической ртути, которая находится на дне сосуда, а сверху покрыта пастой из каломели Hg2Cl2. Сосуд наполняется раствором КС1 определенной концентрации, насыщенным Hg2Cl2.
Схема записи каломельного электрода: Hg | Hg2Cl2, KC1. На каломельном электроде устанавливаются равновесия:
Рассматривая этот электрод как обратимый относительно катиона, применим к нему уравнение Нернста для металлического ртутного электрода (при 298,15 К):
Активная концентрация ионов Hg2 2+ в растворе, возникающая за счет незначительной растворимости каломели, связана с активной концентрацией ионов С1 — :
Подстановка величины aHg 2 2+ в формулу приводит к выражению:
Как видно из формул, потенциал каломельного электрода действительно зависит и от концентрации катиона Hg2 2+ , и от концентрации аниона Cl — . Вообще, если металлический электрод находится в насыщенном растворе своей соли, то его потенциал определяется концентрацией катионов в растворе, но изменение концентрации анионов влияет на концентрацию катионов и в результате вызывает изменение потенциала электрода. Сумма постоянных величин
Обозначая ее ф 0 клм, получим:
Суммарная концентрация ионов хлора в растворе практически равна концентрации раствора КС1 в каломельном электроде.
Избыток КС1 гарантирует, что раствор остается насыщенным при значительных изменениях температуры. Наиболее удобен и устойчив, а потому чаще применяется на практике насыщенный каломельный электрод, содержащий насыщенный раствор хлорида калия.
Хлорсеребряный электрод
Другим электродом второго рода является хлорсеребряный электрод, простой в изготовлении и дающий хорошо воспроизводимую величину потенциала.
Он применяется как внутренний вспомогательный электрод в стеклянных электродах, а также в качестве внешнего стандартного электрода сравнения при измерении рН .
Хлорсеребряный электрод обычно получают осаждением серебра на платиновую проволоку с последующим переведением поверхностного слоя осажденного серебра в хлорид серебра электролизом в растворе хлорида. Эта проволока погружена в раствор хорошо растворимого электролита, содержащего ионы С1 — (например, раствор КС1, насыщенный AgCl).
Схема хлорсеребряного электрода: Ag | AgCl, KC1.
На рис. 12.3 приведена одна из конструкций хлорсеребряного электрода. Этот электрод состоит из стеклянного корпуса 1 с впаянной асбестовой нитью 2, по которой просачивается раствор хлорида калия (насыщ.), создавая электролитический ключ. Внутри электрода находятся серебряная проволока 5 и паста из хлорида серебра 4. Корпус полностью заполняется насыщенным раствором хлорида калия 3, контакт которого с парой Ag | AgCl осуществляется при помощи асбестового фитиля 6. На электроде происходит реакция:
Потенциал хлорсеребряного электрода, выведенный из уравнения Нернста так же, как и для каломельного, имеет вид:
На практике, как и в случае каломельного, чаще используется насыщенный хлорсеребряный электрод, потенциал которого при данной температуре постоянен, и при 298 К равен 0,202 В.
Сурьмяный электрод
Сурьмяный электрод является одним из наиболее употребимых металлоксидных электродов, которые обычно относятся к электродам второго рода, только в отличие от каломель ного и хлорсеребряного электродов, здесь металл (Sb) погружен в концентрированный раствор труднорастворимого оксида Sb2O3.
Для бруска сурьмы, отлитого на воздухе, электрохимический процесс протекает с участием сурьмы и тонкого слоя ее малорастворимого оксида на поверхности металла:
Сурьма и ее оксид находятся в кристаллическом состоянии, и, следовательно, их активности не изменяются. Активная концентрация воды в разбавленных растворах также приблизительно постоянна. Поэтому потенциал электрода зависит только от активной концентрации ионов водорода, и, следовательно, сурьмяный электрод можно использовать для измерения рН :
Потенциал сурьмяного электрода зависит от состояния поверхности металла. Кроме того, на его величину влияют окислители и восстановители. Поэтому с его помощью измеряют рН в тех случаях, когда не требуется высокая точность. Однако сурьмяный электрод имеет очень простое устройство, легко может быть выполнен в виде электрода очень малых размеров, и потенциал его устанавливается очень быстро.
Сурьмяный электрод нашел, в частности, применение при изучении изменений рН в желудке в процессе пищеварения. Он представляет собой брусок сурьмы длиной 5 мм и диаметром 1 мм с трехжильным медным проводом, который можно легко проглотить. Вспомогательный сурьмяный электрод можно включать в цепь, например, с помощью солевого раствора, в который помещены ноги пациента.
Хингидронный электрод
Хингидронный электрод является представителем окислительно-восстановительных электродов.
Как известно, многие окислительно-восстановительные реакции в водных растворах протекают с участием ионов водорода. В этом случае потенциал редокс-электрода зависит от концентрации ионов Н*. Такие электроды в принципе можно использовать для измерения рН . Из них наибольшее практическое применение нашел Хингидронный электрод.
Для приготовления этого электрода исследуемый раствор взбалтывают со щепоткой хин-гидрона (труднорастворимого темно-зеленого порошка) и таким образом получают его насыщенный раствор. Хингидрон является молекулярным соединением хинона и гидрохинона и при растворении в воде частично диссоциирует на хинон и гидрохинон:
В полученный раствор погружают платиновую пластинку. Хинон и гидрохинон участвуют в окислительно-восстановительном равновесии, от положения которого зависит потенциал платиновой пластинки:
Схема хингидронного электрода: Pt | X, ГХ, Н + .
Применение формулы Нернста для этой окислительно-восстановительной реакции позволяет получить потенциал хингидронного электрода:
Активные концентрации хинона ( a х ) и гидрохинона (агх) в растворе примерно равны, так как они образуются эквимолярно в результате диссоциации хингидрона. Поэтому
где ф 0 гх— величина стандартного потенциала хингидронного электрода при а + н = 1, равная 0,699 В. Отсюда
Хингидронный электрод удобен в работе и позволяет определять рН кислых и слабощелочных растворов с достаточной точностью. В щелочных растворах (при рН > 8) он не дает точных показаний из-за диссоциации гидрохинона, в результате чего концентрация гидрохинона меняется:
Присутствие в растворах окислителей и восстановителей влияет на потенциал хингидронного электрода. Кроме того, при измерении рН в исследуемый раствор приходится вносить постороннее вещество — хингидрон.
Поэтому хингидронный электрод в отличие от более совершенного и универсального стеклянного электрода нельзя применять для измерения рН многих биологических жидкостей.
Вообще хинонные и гидрохинон-
ные структуры широко распространены в живой клетке: их имеют, например, такие важные для жизнедеятельности вещества, как витамины Е и К.
рН-зависимые электродные потенциалы
Полуреакция, происходящая на хингидронном электроде, протекает с участием ионов гидроксония. Существует большая группа полуреакций, в которых участвуют протоны или гидроксильные ионы. В таких случаях концентрация этих ионов входит в уравнение Нернста и рН раствора влияет на потенциал полуреакции.
Например, потенциал редокс-пары
будет вычисляться по уравнению:
Для водных растворов активную концентрацию воды можно считать величиной постоянной и потому ее значение учитывается в постоянной величине стандартного потенциала.
В общем виде зависимость окислительно-восстановительного потенциала от рН для уравнения
можно записать так:
Из этого уравнения следует, что по мере подкисления раствора окислительно-восстановительный потенциал будет увеличиваться.
Величина сдвига ФОХ/RED при изменении концентрации ионов водорода зависит от числа электронов п и протонов т, участвующих в реакции, т.е. от отношения т/п. Такую разновидность окислительно-восстановительных полуреакций называют рH-зависимыми.
рH-зависимые полуреакции (и не только они) нашли широкое применение в клинической диагностике, являясь основой аналитических редокс-методов, прежде всего редоксимет-рии — метода объемного анализа, основанного на применении окислительно-восстановительных реакций. В зависимости от примененяемого титранта различают перманганатометрию, бихроматометрию, иодометрию, периметрию и др.
Перманганатометрия — метод, базирующийся на применении в качестве титранта-окислителя перманганата калия в сильно кислой среде. В связи с высоким значением стандартного потенциала перманганата калия (ф°MnO4- + 8h/Mn2+ = +1,51 В) его можно применять для определения широкого набора веществ, способных окисляться — сульфит-, сульфид-, нитрит-, арсенит-анионов, катиона Fe 2+ , гидразина, ряда органических кислот (лимонной, винной, яблочной, щавелевой, аскорбиновой и др.).
В гигиенической практике его используют для нахождения важной характеристики воды — ее окисляемости, которая определяется количеством миллиграммов пермангана-та калия, идущих на окисление восстановителей, содержащихся в литре воды. Окисляемость обусловлена присутствием гуминовых веществ, сероводорода, солей двухвалентного железа и др. примесей, в основном бытовых или промышленных. Загрязненные воды имеют окис-ляемость до 400 мг на литр воды, а незагрязненные — не более 4 мг на литр. Наименее загрязнены артезианские воды (окисляемость менее 2 мг на литр).
Бихроматометрия также основана на достаточно высокой величине редокс-потенци-ала бихромат-иона в сильно кислой среде. Значение ф° для полуреакции
составляет +1,33 В. Бихроматометрию используют для определения многих восстановителей, а в гигиенической практике она нашла применение для определения химического потребления кислорода — оценки содержания всех органических веществ, которые растворены в воде. Они при кипячении в избытке бихромата калия в присутствии серной кислоты окисляются до углекислоты.
Применение уравнения Нернста в решении задач.
При рассмотрении вопроса об окислительно-восстановительных реакциях часто возникает необходимость расчета электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций. В справочниках обычно приведены таблицы т.н. стандартных потенциалов тех или иных процессов, рассчитанных при р=1 атм, Т=298К и активностях участников равных 1. Однако в реальных задачах условия могут значительно отличаться от указанных выше. Как быть в таком случае? Ответ дает уравнение Нернста. В оригинальном виде оно выглядит так:
Как можно заметить, в уравнении фигурируют несколько постоянных величин. Также температура в подавляющем большинстве случаев равна 298К. Кроме того, можно заменить натуральный логарифм на десятичный. Это можно сделать путем умножения на коэффициент перевода. Если собрать все постоянные в единый множитель, то приходим к несколько иному, но более знакомому по учебным пособиям виду уравнения Нернста:
Такой вариант уравнения сильно облегчает жизнь в ряде случаев, например рассмотрении рН-зависимых процессов. Используя данное уравнение можно провести вычисления в любых условиях, приведенных в задаче. Рассмотрим характерные примеры задания по данной теме.
Пример 1:
Рассчитать ЭДС гальванического элемента, составленного из медной и цинковой пластин, погруженных в растворы 0.1М CuSO4 и 0.01М ZnSO4 соответственно. Коэффициенты активности ионов Cu 2+ и Zn 2+ принять равными единице.
Решение:
Для начала запишем уравнения протекающих процессов:
Далее находим по таблице стандартные потенциалы процессов:
Если в условиях задачи ничего не сказано про коэффициенты активности ионов, то можно считать их равными единице, как и в нашем случае. Тогда активности участников процессов можно принять равными их аналитическим концентрациям.
Найдем реальные потенциалы с учетом нестандартных активностей ионов:
Далее необходимо сравнить полученные величины между собой, чтобы определить, кто из участников процесса – окислитель. Потенциал меди больше, чем у цинка, поэтому она будет окислителем. Тогда найдем ЭДС системы:
Ответ: 1.13 В
Пример 2:
Одним из лабораторных способов получения хлора является действие KMnO4 на концентрированную соляную кислоту. Можно ли провести процесс при рН=4?
Решение:
Для начала запишем уравнения протекающих процессов.
Далее находим по таблице стандартные потенциалы процессов:
Несложно заметить, что от рН в данном случае зависит только потенциал перманганата. Тогда воспользуемся уравнением Нернста и рассчитаем его реальный потенциал в условиях задачи:
Получается, что потенциал KMnO4 стал меньше, чем у хлора, а значит, реакция не пойдет.
ОCНОВНЫЕ ПОНЯТИЯ. ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ. ЗАКОНЫ ФАРАДЕЯ.
Одним из важнейших элементов внутренней цепи является граница раздела электрод-ионный проводник. На этой границе возникает так называемый двойной электрический слой, характеризуемый сложным взаимодействием металла с компонентами раствора, которое приводит к скачку потенциала, который называют электродным потенциалом. Величина этого скачка потенциала зависит от природы электрода, состава электролита и температуры. Абсолютное значение электродного потенциала определить нельзя, но можно измерить разность потенциалов между двумя электродами. Такой электродный потенциал принято обозначать 
Ox + n 

Электродный потенциал в отсутствии тока в цепи при равновесии потенциалопределяющей реакции называется равновесным и обозначается 




В электрохимии общепринятой является водородная шкала потенциалов, в которой за нуль принят потенциал стандартного водородного электрода при 298 К; 


Потенциалопределяющей на таком электроде является реакция
2H + (p) + 2 

Значения стандартных потенциалов электродов в водных растворах при 298 К, определенные по водородной шкале представлены в таблице 1 Приложения.
Значения равновесных потенциалов для условий, отличительных от стандартных, рассчитывают по уравнению Нернста, которое в общем случае для потенциалопределяющей реакции (1.1) имеет вид:

где – R – универсальная газовая постоянная, 8,31Дж/моль . К; n – число электронов, принимающих участие в реакции (равно числу моль эквивалентов в моль вещества); F – число Фарадея, 96500 Кл/моль-экв (26,8А . ч/моль-экв); T – температура, К.
Существует 3 различных типов электродов: 1) металлические (металлы в растворе собственных ионов); 2) газовые (на основе Pt в растворе электролита, через который пропускает соответствующий газ); 3) окислительно-восстановительные (инертный электрод в растворе, содержащей окисленную и восстановленную формы в ионном виде – редокс-электроды).
Для металлических электродов потенциалопределяющей является реакция :
M(р) n + + n 

Уравнение Нернста для расчета потенциала металлического электрода, поскольку активность твердой фазы принимают равной единице, имеет вид:

Для 298 К, переходя к десятичному логарифму, имеем

Для водородного электрода потенциалопределяющая реакция (1.2), уравнение Нернста запишем в виде:

Поскольку, как указано выше, 


Газовый кислородный электрод представляет собой Pt – электрод, на котором осуществляется потенциалопределяющая реакция
О2 + 4 

Уравнение Нернста для такого электрода запишется в виде:

Стандартный потенциал кислородного электрода 





Законы Фарадея. Количественно электрохимические превращения веществ подчиняются двум законам Фарадея:
1) масса или количество вещества, претерпевшего превращение на электроде при протекании постоянного тока, прямо пропорционально количеству прошедшего электричества;
2) при прохождении через различные электролиты одного и того же количества электричества массы различных веществ, участвующих в электродных реакциях, пропорциональны молярным массам их эквивалентов. Из этого следует, что для электрохимического превращения 1 моль эквивалента вещества требуется одинаковое количество электричества F, называемое числом Фарадея.
Оба эти закона можно объединить следующими выражениями:
— для массы вещества: 
— для объема газообразных веществ: 
где МЭ – молярнаямасса эквивалента вещества, г/моль, 
VЭ – объем моль-эквивалента газа, л/моль; 
Q – количество электричества, прошедшего через систему, Кл,

( При нормальных условиях (н.у.) 1 моль любого газа занимает объем



Количество моль-эквивалентов веществ, испытавших электрохимические превращения на катоде и аноде, выраженные в моль-эквивалентах, равны между собой
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
Гальваническим элементом (ГЭ) называется электрохимическая система, в которой химическая энергия превращается в электрическую.
Рис. 1.1. Схема гальванического элемента
Представленный на рисунке 1.1. ГЭ состоит из двух электродов 1 (катода К и анода А), погруженных в растворы собственных солей (2) и разделенных диафрагмой (3) проницаемой для ионов. Электроды через внешнюю цепь (4) соединены между собой металлическими проводниками.
При разомкнутой цепи в ГЭ на обоих электродах устанавливается равновесие, характеризуемое величиной соответствующих равновесных электродных потенциалов (ЭП). Разность равновесных ЭП катода и анода называется электродвижущей силой ГЭ:

Разность стандартных ЭПназывается стандартной ЭДС ГЭ:


При замыкании цепи равновесие нарушается, во внешней цепи возникает самопроизвольное направленное движение электронов от анода – электрода с меньшим потенциалом, к катоду – электроду с большим потенциалом.
Электродные реакции, например, для серебряно-цинкового элемента записываются следующим образом:


Суммируя анодную и катодную реакции, получаем уравнение токообразующей реакции (ТОР):
Zn + 2Ag + → 2Ag + Zn 2+ , (2.3).
Электродвижущая сила элемента связана с энергией Гиббса ТОР 

где п — количество моль-эквивалентов вещества.
В общем случае, для ТОР реакции:
bB + dD → lL + mM, (2.5),
протекающей в ГЭ при стандартных состояниях веществ при Т = 298 К, энергия Гиббса 

Таким образом стандартную ЭДС ГЭ можно определить двумя способами:
— первый способ по уравнению 
— второй способ по уравнению (2.1а), используя табличные значения стандартных потенциалов.
ЭДС гальванического элемента для ТОР при активности ионов отличных от 1 моль/л можно рассчитать из выражения:

где аВ, аD, аL , aM, – активности веществ; b, d, l, m – стехиометрические коэффициенты ТОР (2.5). Для твердых веществ активности принимают равными единице.
Максимальная электрическая работа ГЭ определяется соотношением 

В работающем ГЭ при прохождении тока I напряжение U меньше ЭДС из-за явления поляризации катода (DEК) и анода (DЕА) и омического падения напряжения на сопротивлении r1 в проводниках с электронной проводимостью (проводниках первого рода) и на сопротивлении r2 в электролите (проводнике второго рода)

Поляризацией называется изменение потенциала электрода при прохождении электрического тока: 
Зависимость потенциала электрода от тока графически изображается поляризационной кривой. В гальваническом элементе при прохождении электрического тока потенциал анода становится более положительным, а потенциал катода – более отрицательным, что приводит к уменьшению напряжения U. Поляризационные кривые ГЭ представлены на рисунке 1.2.
Рис. 1.2. Поляризационные кривые ГЭ.
Пример 1.1.Рассмотрите работу серебряно-цинкового гальванического элемента. Напишите катодные и анодные процессы, рассчитайте стандартную ЭДС элемента при 298 К двумя способами.
Решение.Выпишем из таблицы 1 приложения значения стандартных электродных потенциалов Zn и Ag:


Т.к. 
1 способ: рассчитаем 

2 способ: по уравнению (2.6) рассчитываем

По уравнению 2.4 : 
Значения 
Пример 1.2.Рассчитать ЭДС серебряно – цинкового ГЭ при Т = 298 К, если активность Zn 2+ и Ag + равны по 0,01 моль/л.
Решение. Процессы, протекающие в ГЭ, и стандартная ЭДС элемента те же, что в примере 1.1. Рассчитаем величины электродных потенциалов.
Равновесные потенциалы электродов рассчитываем по уравнению Нернста для металлических электродов (уравнение 1.4 а):



При одинаковой активности потенциалопределяющих ионов в данном ГЭ согласно уравнению Нернста, изменение анодного потенциала больше, чем катодного, ЭДС элемента меньше, чем стандартная ЭДС.
Пример 1.3.Рассчитайте величину максимальной электроэнергии, которая может быть выработана серебряно – цинковым ГЭ при уменьшении массы анода на 1 г в результате протекания электрохимической реакции при условиях заданных в примере 1.2.
Решение. Анодом ГЭ является цинковый электрод. Количество электричества Q, прошедшего через электродную поверхность, рассчитывается из объединенного закона Фарадея:
Максимально вырабатываемая электроэнергия 
Пример 1.4.Рассчитайте ЭДС цинк-хлорного ГЭ, если 


Решение.
Рассчитаем значения равновесных электродных потенциалов для соответствующих электродов по уравнению Нернста.
Для потенциалопределяющей реакции Zn 2+ + 2 


Для потенциалопределяющей реакции Cl2(газ) + 2 


Так как 

А — : Zn – 2 
К + : Cl2 + 2 
ТОР: Zn + Cl2 → Zn 2+ + 2Cl –
Вычислим значения ЭДС ГЭ: 
Увеличить ЭДС данного ГЭ можно, если: увеличить температуру; уменьшить активность ионов Zn 2+ ; уменьшить активность ионов Cl – ; увеличить парциальное давление Cl2 .
Пример 1.5. Рассчитайте ЭДС щелочноговодородно-кислородного ГЭ, работающего при одинаковых давлениях 

Решение.Для кислой среды уравнения электродных реакций в концентрационном элементе:
А — : H2 +2ОН — → 2Н2О + 2
К + : 1/2О2 + 2 

Величина равновесного потенциала этих электродов определяется по уравнению:



Для кислотноговодородно-кислородного топливного элемента:
на аноде: H2 — 2 
на катоде: 1/2О2 + 2H + + 2 


Электролизом называются электрохимические процессы прямого (непосредственного) преобразования электрической энергии в химическую, протекающие на электродах под действием постоянного тока. Под действием электрического поля беспорядочное движение ионов в электролите превращается в направленное: положительно заряженные ионы (катионы) перемещаются к отрицательному электроду – катоду, отрицательно заряженные ионы (анионы) движутся к положительному электроду – аноду.
При электролизе катод подсоединяется к отрицательному полюсу внешнего источника тока, а анод – к положительному. На катоде ( К – ) происходят процессы восстановления: положительные ионы или нейтральные молекулы принимают электроны и переходят в восстановленную форму. На катоде в первую очередь идут процессы, характеризующиеся более положительным потенциалом, т.е. восстанавливаются более сильные окислители. На аноде (А + ) могут окисляться анионы, нейтральные молекулы и сам материал анода. Анод может быть растворимым, т.е. окисляться в условиях электролиза, и инертным, нерастворимым, т.е. не участвовать в анодном процессе. К растворимым или частично растворимым анодам относятся Zn, Cu, Fe, Cd, Ag, Ni, Co и т.д., к нерастворимым – Pt, Pd и некоторые другие благородные металлы в определенных условиях, а также графит С. На аноде в первую очередь окисляются более сильные восстановители, т.е. идут процессы, характеризующиеся более отрицательным потенциалом.
Для того, чтобы правильно определить процессы электролиза, необходимо рассмотреть ионный состав электролита и определить равновесные потенциалы возможных процессов. Для расчета равновесных потенциалов возможных процессов, используется уравнение Нернста. Если не указаны конкретные условия, то для оценочной характеристики процессов используются стандартные потенциалы материала анода 





При относительно малом отличии равновесных потенциалов (менее 0,8 ¸ 1,0 В) на электродах возможно параллельное протекание нескольких процессов. Если на электроде идут одновременно несколько процессов, то доля количества электричества, пошедшего на каждый из процессов, называется выходом по току (Вj ):

где Qj – количество электричества, пошедшее на конкретный процесс;
Q – общее количество электричества, прошедшее через электрохимическую систему.
Сложные кислородсодержащие ионы, такие как SO4 2- , NO3 — , PO4 3- и др. из водных растворов на аноде не окисляются, т.к. обладают существенно более положительным потенциалом разряда, чем гидроксид-ион OH – .
Ионы элементов (приложение 1, табл. 1), обладающие высоко отрицательным электродным потенциалом (Al 3+ , Na + и др.) из водных растворов на катоде не восстанавливаются. Их разряд на катоде возможен только из расплавов соответствующих солей или из неводных растворов.
Количество вещества, испытавшего электрохимические превращения на электродах, рассчитывается по закону Фарадея.
При электролизе в результате прохождения через систему постоянного электрического тока происходит поляризация электродов (DЕК, DЕА): потенциал анода становится более положительным, а потенциал катода – более отрицательным и возникает омическое падение напряжения на внутреннем сопротивлении электрохимической цепи R (DЕом = R . I). Поэтому напряжение ( U ), которое необходимо подать на электроды от внешнего источника постоянного тока, больше минимальной разности потенциалов (Umin), равной разности равновесных потенциалов процессов :

Ход поляризационных кривых при электролизе показан на рис. 3.1. :
|
|
Рис. 3.1. Поляризационные кривые при электролизе.
Пример 3.1. Рассмотрите электролиз расплава соли хлорида лития LiCl на нерастворимых Pt-электродах. Рассчитайте минимальную разность потенциалов Umin электролиза. Напишите уравнения электродных процессов.
Решение. Запишем ионный состав электролита:
и стандартные потенциалы электродных процессов:
К — : 
A + : 

K — : Li + + 
A + : 2Cl — → Cl2 + 2 
Данный электролиз можно использовать для получения лития и хлора.
Пример 3.2. Определите минимальную разность потенциалов Umin , которую необходимо подать на Pt-электроды для проведения электролиза водного раствора KOH, рН = 12. Напишите уравнения процессов электролиза. Рассчитайте объемы газов (приведенные к нормальным условиям), которые образуются на электродах за 10 часов при токе 5А.
Решение. Запишем уравнения диссоциации раствора электролита
КОН → К + + ОН — ; H2O 
и определим равновесные потенциалы возможных электродных процессов:
К — : 

А + : 
Так как Е 0 К + /К значительно отрицательнее 
Минимальная разность потенциалов для электролиза данного раствора:

Объем газов, выделившихся на электродах, рассчитаем по закону Фарадея (условия нормальные):


Электролиз водного раствора гидроксида калия широко применяется для электрохимического получения водорода.
Пример 3.3. Рассмотрите электролиз водного раствора CuCl2 на графитовых (нерастворимых) электродах. Напишите электродные процессы, покажите ход поляризационных кривых. Рассчитайте массу меди, образовавшейся на катоде, если за это же время на аноде выделилось 5,6 мл Cl2 и 5,6 мл O2 .
Решение. Определим ионный состав раствора электролита и оценим водородный показатель среды. Запишем уравнения диссоциации молекул соли и воды:
H2O 
Соль CuCl2 образована слабым основанием Cu(OH)2 и сильной кислотой HCl, следовательно, при ее растворении в воде будет протекать процесс гидролиза с образованием избытка ионов Н + , раствор электролита будет иметь слабокислую реакцию среды (примем рН = 5).
Определим потенциалы возможных процессов на аноде и катоде и запишем уравнения электродных процессов:
К — : 

т.к. 

A + : 

т.к. 

K — : Cu 2+ + 2 
A + : 2H2O → O2 + 4H + + 4
2Cl — → Cl2 + 2 
Электролиз данного раствора можно проводить для нанесения медного покрытия на изделие, а также для получения газообразных кислорода и хлора.
 |
Рис. 3.2. Поляризационные кривые процесса электролиза водного раствора хлорида меди на нерастворимых электродах.
Определим массу меди, образовавшейся на катоде, для чего сначала рассчитаем объемы моль эквивалентов газов при н.у. и массу моля эквивалента меди:



По закону Фарадея определим количество электричества, необходимое для выделения заданных объемов кислорода и хлора на аноде (н.у.):


Суммарное количество электричества, прошедшее через анод, равно:

Такое же количество электричества на катоде (QК = QА) пойдет только на один процесс образования меди. По закону Фарадея определим массу выделившейся меди:

Определим выход по току (Bj) для всех процессов электролиза:



Пример 3.4. Рассмотрите электролиз водного раствора CuCl2 на медных электродах. Напишите уравнения электродных процессов, покажите ход поляризационных кривых. Чем отличается ход поляризационных кривых в данном варианте от варианта, рассмотренного в примере 3.3.?
Решение. Ионный состав раствора электролита таков же, как в примере 3.3., поэтому на катоде, как и в случае с электролизом на нерастворимых электродах, пойдет только процесс восстановления ионов меди.
Потенциалы возможных процессов на аноде:





K — : Cu 2+ + 2 
A + : Cu → Cu 2+ + 2 
При больших напряжениях электролизера U , могут быть достигнуты 


Благодаря растворению под действием тока медного анода запас ионов Cu 2+ в растворе электролита будет восполняться, и процесс образования медного покрытия на катоде будет идти более интенсивно, чем в случае использования инертных электродов (пр. 3.3.).
Рис. 3.3. Поляризационные кривые процесса электролиза водного раствора хлорида меди на медных электродах.
Пример 3.5. Рассмотрите электролиз водного раствора смеси солей Pb(NO3)2 и Sn(NO3)2 на графитовых (нерастворимых) электродах. Напишите уравнения электродных процессов. Рассчитайте выход по току веществ, если на катоде одновременно образовалось 30г Sn, 52г Pb и 2,8л Н2 (условия нормальные).
Решение. Определим ионный состав раствора электролита и оценим водородный показатель среды. Запишем уравнения диссоциации молекул соли и воды:
H2O 
Соли Sn(NO3)2 и Pb(NO3)2 образованы слабыми основаниями и сильной кислотой, следовательно, при их растворении в воде будет протекать процесс гидролиза с образованием избытка ионов Н + , раствор электролита будет иметь слабокислую реакцию среды (примем рН ≈ 5).
Определим равновесные потенциалы возможных процессов на аноде и катоде:
К — : 


т.к. 


Таким образом, на электродах протекают следующие процессы:
K — : Pb 2+ + 2e → Pb
A + : H2O → O2 + 4H + + 4 
Запишем массы и объем (при нормальных условиях) моль эквивалентов веществ, образовавшихся на катоде:



По закону Фарадея определим количество электричества, необходимое для получения на катоде заданного количества вещества (н.у.):



Суммарное количество электричества, прошедшее через катод:

Определим выход по току (Bj) для всех процессов электролиза:





Рис. 3.4. Поляризационные кривые процесса электролиза водного раствора смеси солей Pb(NO3)2 и Sn(NO3)2 на графитовых (нерастворимых) электродах.
Пример 3.6. Рассмотрите процесс рафинирования никеля, содержащего примеси цинка и меди в водном растворе H2SO4. Какие процессы будут протекать на аноде и катоде? Какое время нужно для проведения рафинирования при токе 500 А для выделения 5 кг никеля при выходе по току 98%?
Решение. Рафинирование – очистка металла от примесей с помощью электролиза. На аноде растворяются основной металл и примеси, потенциал которых отрицательнее основного металла. Примеси, имеющие более положительный потенциал, не растворяются и выпадают из анода в виде шлама. На катоде в первую очередь выделяется металл, имеющий наиболее положительный потенциал.
Анод – очищаемый металл Ni с примесями Zn и Cu. Ионный состав раствора электролита: H + , SO4 2- , OH — . Запишем равновесные потенциалы возможных электродных процессов при рН = 2:





Так как 

Запишем уравнения электродных процессов:
А + : Zn → Zn 2+ + 2e
K — : 2H + + 2e → H2
Время, необходимое для рафинирования, рассчитаем по закону Фарадея ( 

4. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ МЕТАЛЛОВ
Коррозией называют самопроизвольное разрушение металлических материалов под действием компонентов окружающей среды. В результате коррозии протекает суммарная окислительно-восстановительная реакция взаимодействия металла с окислителем:
При этом происходит окисление металла и разрушение металлоконструкций.
Для металла именно окисленное состояние является те
http://scienceforyou.ru/jelektrohimija/uravnenie-nernsta
http://poisk-ru.ru/s43388t8.html