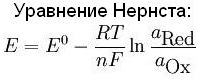Уравнение нернста для перманганата калия
4.4.1. Построение кривой окислительно-восстановительного титрования
Построение кривой титрования дает возможность оценить, насколько успешным будет титрование, и позволяет выбрать индикатор. При построении кривой окислительно – восстановительного титрования по оси ординат откладывают потенциал системы, а по оси абсцисс – объем титранта или степень оттировывания.
Рассмотрим в качестве примера титрование 100 мл 0,1 н. раствора FeSO 4 0,1 н. раствором KMnO 4 в кислой среде ( [ H + ] = 1 моль/л):
5Fe 2+ + MnO4 — + 8H + = 5Fe 3+ + Mn 2+ + 4H2O.
Запишем уравнения полуреакций для данной окислительно-восстановительной реакции и найдем для них стандартные потенциалы в табл. 5 Приложения:
MnO4 — + 8H + + 5e → Mn 2+ + 4H2O, E o = 1,51 В;
Fe 2+ — 2e → Fe 3+ , E o = 0,77 В.
lg К = (1,51-0,77)∙5 / 0,059 = 62 и К = 10 62 .
Очень большое численное значение К показывает, что равновесие реакции, протекающей при титровании, практически целиком сдвинуто вправо. При расчете кривых окислительно-восстановительного титрования обычно не приводят значение потенциала для точки, соответствующей моменту, когда в исследуемый раствор еще не добавлен титрант.
После добавления первых же капель перманганата калия в растворе образуются две окислительно-восстановительные пары: MnO 4 — / Mn 2+ и Fe 3+ / Fe 2+ , потенциал каждой из которых можно вычислить по уравнению Нернста:
При расчете по любому из этих уравнений получится одно и то же значение потенциала, поскольку в каждый момент титрования система находится в равновесии. Однако из соображений простоты расчета до точки эквивалентности потенциал следует рассчитывать по второму из них, а после точки эквивалентности – по первому. Количество вещества Fe 3+ до точки эквивалентности будет равно количеству вещества эквивалента добавленного KMnO 4, поскольку высокое численное значение константы равновесия говорит о практически полном сдвиге равновесия вправо.
В уравнение Нернста входит соотношение концентраций окисленной и восстановленной форм, поэтому при [Н + ] = 1 моль/л изменение объема не влияет на результаты расчета. Следовательно, при построении кривой титрования можно условно считать, что объем титруемого раствора не изменяется и остается равным 100 мл.
Если к 100,0 мл 0,1 н. FeSO 4 добавить 1,0 мл 0,1 н. KMnO 4 ( f экв= 1/5), то в результате реакции образуется эквивалентное количество вещества Fe 3+ , концентрация которого в растворе будет равна [ Fe 3+ ] = 0,1∙1,0/100,0=1,0∙10 -3 моль-экв/л, а концентрация ионов Fe 2+ составит 0,099 моль-экв/л. Окислительно-восстановительный потенциал раствора составит:
Е = 0,77 + 0,059 lg (1,0∙10 -3 /0,099)= 0,65 В.
Остальная часть кривой титрования до точки эквивалентности рассчитывается аналогично; результаты приведены в таблице 4.1.
Потенциал в точке эквивалентности можно рассчитать по уравнению:
где Е1 ° и Е2 ° — стандартные потенциалы окислительно-восстановительных пар, участвующих в данной реакции;
Таблица 4.1 – Изменение Е при добавлении 0,1 н. KMnO 4 ( f экв= 1/5) к 100 мл 0,1 н. FeSO 4 при [Н + ] = 1 моль/л
Уравнение Нернста
Зависимость окислительно-восстановительного потенциала, отвечающего полуреакции восстановления перманганат-иона в кислой среде (и, как уже отмечалось, одновременно полуреакции окисления катиона Mn 2+ до перманганат-иона в кислой среде) от перечисленных выше определяющих его факторов количественно описывается уравнением Нернста
φ(MnO4–, H+ / Mn2+) = φ o (MnO4–, H+ / Mn2+) + RT / 5Fln[MnO4 – ][H + ] 8 / [Mn 2+ ].
В общем случае уравнение Нернста принято записывать в так:
φ(Ox/Red) = φ o (Ox/Red) + RT/(nF) ln [Ox]/[Red],
отвечающей записи полуреакции восстановления окислителя
Каждая из концентраций под знаком натурального логарифма в уравнении Нернста возводится в степень, соответствующую стехиометрическому коэффициенту данной частицы в уравнении полуреакции, n – число принимаемых окислителем электронов, R – универсальная газовая постоянная, T – температура, F – число Фарадея.
Измерить окислительно-восстановительный потенциал в реакционном сосуде во время протекания реакции, т.е. в неравновесных условиях, невозможно, так как при измерении потенциала электроны должны передаваться от восстановителя к окислителю не непосредственно, а через соединяющий электроды металлический проводник. При этом скорость передачи электронов (силу тока)нужно поддерживать очень малой за счет приложения внешней (компенсирующей) разности потенциалов. Иначе говоря, измерение электродных потенциалов возможно только в равновесных условиях, когда прямой контакт между окислителем и восстановителем исключен.Поэтому квадратными скобками в уравнении Нернста обозначены, как обычно, равновесные (в условиях измерения) концентрации частиц. Хотя потенциалы окислительно-восстановительных пар во время протекания реакции нельзя измерить, их можно вычислить, подставляя в уравнение Нернста текущие, т.е. отвечающие данному моменту времени концентрации. Если рассматривается изменение потенциала по мере протекания реакции, то сначала это начальные концентрации, затем концентрации, зависящие от времени, и, наконец, после прекращения реакции, равновесные. По мере протекания реакции вычисляемый по уравнению Нернста потенциал окислителя уменьшается, а отвечающий второй полуреакции потенциал восстановителя, напротив, увеличивается. Когда эти потенциалы выравниваются, реакция прекращается, и система приходит в состояние химического равновесия.
Дата добавления: 2015-07-30 ; просмотров: 1268 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Применение уравнения Нернста в решении задач.
При рассмотрении вопроса об окислительно-восстановительных реакциях часто возникает необходимость расчета электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций. В справочниках обычно приведены таблицы т.н. стандартных потенциалов тех или иных процессов, рассчитанных при р=1 атм, Т=298К и активностях участников равных 1. Однако в реальных задачах условия могут значительно отличаться от указанных выше. Как быть в таком случае? Ответ дает уравнение Нернста. В оригинальном виде оно выглядит так:
Как можно заметить, в уравнении фигурируют несколько постоянных величин. Также температура в подавляющем большинстве случаев равна 298К. Кроме того, можно заменить натуральный логарифм на десятичный. Это можно сделать путем умножения на коэффициент перевода. Если собрать все постоянные в единый множитель, то приходим к несколько иному, но более знакомому по учебным пособиям виду уравнения Нернста:
Такой вариант уравнения сильно облегчает жизнь в ряде случаев, например рассмотрении рН-зависимых процессов. Используя данное уравнение можно провести вычисления в любых условиях, приведенных в задаче. Рассмотрим характерные примеры задания по данной теме.
Пример 1:
Рассчитать ЭДС гальванического элемента, составленного из медной и цинковой пластин, погруженных в растворы 0.1М CuSO4 и 0.01М ZnSO4 соответственно. Коэффициенты активности ионов Cu 2+ и Zn 2+ принять равными единице.
Решение:
Для начала запишем уравнения протекающих процессов:
Далее находим по таблице стандартные потенциалы процессов:
Если в условиях задачи ничего не сказано про коэффициенты активности ионов, то можно считать их равными единице, как и в нашем случае. Тогда активности участников процессов можно принять равными их аналитическим концентрациям.
Найдем реальные потенциалы с учетом нестандартных активностей ионов:
Далее необходимо сравнить полученные величины между собой, чтобы определить, кто из участников процесса – окислитель. Потенциал меди больше, чем у цинка, поэтому она будет окислителем. Тогда найдем ЭДС системы:
Ответ: 1.13 В
Пример 2:
Одним из лабораторных способов получения хлора является действие KMnO4 на концентрированную соляную кислоту. Можно ли провести процесс при рН=4?
Решение:
Для начала запишем уравнения протекающих процессов.
Далее находим по таблице стандартные потенциалы процессов:
Несложно заметить, что от рН в данном случае зависит только потенциал перманганата. Тогда воспользуемся уравнением Нернста и рассчитаем его реальный потенциал в условиях задачи:
Получается, что потенциал KMnO4 стал меньше, чем у хлора, а значит, реакция не пойдет.
http://helpiks.org/4-38701.html
http://scienceforyou.ru/jelektrohimija/uravnenie-nernsta