электродные системы для потенциометрических измерений, аналитические лабораторные и промышленные измерительные приборы
Аналитические приборы для контроля и регулирования технологических процессов, мониторинга окружающей среды
Производство лабораторных измерительных приборов было организовано в конце 1950-х годов предприятием специализирующееся на выпуске специализированных аналитических приборов. Оборудование предназначенное для контроля и регулирования технологических процессов, мониторинга окружающей среды, а также электродных систем для потенциометрических измерений.
Предприятие приборостроительной отрасли специализирующимся на выпуске лабораторных электродов и промышленных электродов.
Электроды для потенциометрических измерений
Проектирование, изготовлением различных моделей электродов для потенциометрических измерений.
При потенциометрическом (электрометрическом) методе определения активности ионов в растворе необходима электродная система, состоящая из двух электродов:
- измерительный (стеклянный) электрод, который погружается в исследуемый раствор, изменение состава которого сказывается на потенциале этого электрода,
- вспомогательный электрод (сравнения), имеющий постоянный потенциал.
Потенциал стеклянного электрода определение активности ионов водорода
Теория возникновения потенциала на примере стеклянного электрода при определении активности ионов водорода.
Стеклянный (измерительный) электрод — это система, включающая небольшой сосуд из стекла с помещенным в него внутренним буферным раствором и токоотводом . Сосуд имеет горловину из изолирующего стекла, на конце которой напаян шарик (мембрана) из специального электродного стекла, обладающего заметной электропроводностью. Токоотводом может служить внутренний хлорсеребряный электрод.
Стекло проводит электричество благодаря тому, что в нем могут мигрировать ионы щелочных металлов (натрия или лития), входящие в состав при его синтезе.
Внутренний хлорсеребряный электрод и буферный раствор — определенный потенциал
- На границе токоотвода (внутренний хлорсеребряный электрод) и внутреннего буферного раствора возникает совершенно определенный потенциал.
- Потенциал возникает и на границе стеклянной мембраны с внутренним раствором.
- В ходе измерений внутренний раствор, а значит, и сумма внутренних потенциалов остаются постоянными.
Потенциал стеклянного электрода, анализируемый раствор
Происхождение потенциала стеклянного электрода можно представить так. Когда электрод помещается в анализируемый раствор, в поверхностные слои электродного стекла из анализируемого раствора интенсивно проникают ионы водорода, вытесняя ионы содержащегося в стекле щелочного металла. Энергетическое состояние ионов в стекле и в растворе различно. Это приводит к тому, что ионы водорода так распределяются между стеклом и раствором, что поверхности этих сред (фаз) приобретают противоположные заряды, а между стеклом и анализируемым раствором возникает разность потенциалов.
Величина этой разности потенциалов зависит от рН, потому что стремление ионов водорода перейти в стекло зависит от их концентрации в растворе. Чем она больше, тем больше это стремление. Возникающая разность потенциалов так направлена, что она уменьшает стремление ионов водорода переходить в стекло. При определенной концентрации ионов водорода в растворе между стремлением их переходить в стекло и электрическим силами, которые приходится преодолевать, установится равновесие. При этом переход ионов Н + из раствора в стекло будет осуществляться с той же скоростью, что и обратный переход из стекла в раствор.
Для измерения величины потенциала стеклянного электрода используется вспомогательный электрод (сравнения).
Потенциал вспомогательного электрода при измерении рН практически не меняется, так он зависит от концентрации ионов хлора, которая около системы Ag / AgCL (если электрод хлорсеребряный) задана и остается постоянной. Вспомогательный электрод соединен с анализируемым раствором электролитическим ключом с раствором хлористого калия. Роль этого ключа — обеспечивать проведение тока между исследуемым раствором и вспомогательным электродом, стабилизировать и свести к минимуму потенциал на этой границе.
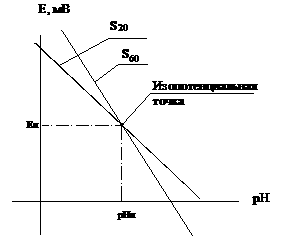
Графически зависимость э.д.с. электродной системы, состоящей из стеклянного и вспомогательного электродов, от величины рН представляет собой прямую линию (рисунок 1).
В очень кислых растворах могут наблюдаться «кислотные ошибки», в очень щелочных — «щелочные ошибки», т.е. кривая отклоняется от линейного хода. Положение этих отклонений зависит от состава стекла и природы ионов.
На кривой зависимости э.д.с. от величины рН имеется точка (область), соответствующая такой концентрации определяемого иона, при которой потенциал электрода не зависит от температуры. Это изопотенциальная точка (рисунок 1).
Рисунок 1. График зависимости э.д.с. электродной системы от величины рН
Уравнение этой прямой (Нернста)
Е — разность потенциалов между измерительным (стеклянным) электродом и вспомогательным электродом, мВ;
Е0 — константа, зависящая в основном от свойств электрода сравнения (стандартный потенциал электрода), мВ;
S — крутизна электродной функции электрода (Нернстовский угловой коэффициент наклона)

R — газовая постоянная, Дж?моль –1 ? К –1 ;
n — заряд иона с учетом его знака;
F — Число Фарадея, Кл/моль;
N — абсолютная температура, ºК;
а — активность соответствующего иона.
Уравнение Нернста для измерения рН можно записать в виде
Еи, рНи — номинальные значения координат изопотенциальной точки электродной системы, состоящей из стеклянного (измерительного) и вспомогательного электродов, соответственно, мВ, рН;
рН t — значение рН буферного раствора при температуре t , ºС;
St — крутизна водородной характеристики в мВ/рН при температуре t ºС, рассчитанная по формуле

t — температура анализируемой среды, ºС;
Крутизна электродной системы St зависит от температуры; при температуре 25ºС и десятикратном изменении активности определяемого иона она равна 59,16 мВ для однозарядных ионов и 29,56 для двухзарядных ионов. Однако обычно крутизна электродной функции меньше теоретического значения, что обусловлено присутствием мешающих примесей или старением жидкостного электрода.
Для удобства оценки реальной крутизны электродной системы St реал, как правило, используют безразмерный коэффициент К S , учитывающий отклонение реальной величины крутизны от теоретического значения;

St реал — реальное значение крутизны электродной функции, мВ/рН;
St — теоретическое значение крутизны электродной функции, рассчитанное по формуле (4), мВ/рН.
Коэффициент К S , в основном равный 0,8…1,2, позволяет учитывать отклонение крутизны электродной системы St реал от теоретического значения.
pH электроды не запаянной конструкции
Производство и выпуск простейших электродов не запаянной конструкции (рисунок 2) только для измерения величины рН в узком диапазоне.
Рисунок 2. Электрод не запаянной конструкции
В лабораторных стеклянных электродах не запаянной конструкции, особенно при перепадах температур анализируемой среды, может нарушаться герметичность, внутренний буферный раствор взаимодействует не только со стеклом корпуса электрода, но и и другими материалами, которые обеспечивают герметичность (резина, смола и др.). В результате этого внутренний раствор меняет свой состав, что ведет к быстрому изменению контрольного потенциала электрода и изменению координат изопотенциальной точки.
В настоящее время мы выпускаем более сложные стеклянные электроды запаянной конструкции не только для измерения величины рН в широком диапазоне от -0,5 до 14 рН, но и для измерения других ионов.
pH электроды запаянной конструкции
Выпуск электродов запаянной конструкции.
Рисунок 3. Электрод запаянной конструкции
Преимущества электродов запаянной конструкции (рисунок 3). Внутренний буферный раствор, заполняющий корпус электрода, находится в запаянной стеклянной колбе, он не соприкасается ни с какими другими материалами, кроме стекла, и поэтому сохраняет свой состав даже при резких перепадах температур анализируемой среды, в результате чего потенциал электрода длительное время остается практически без изменений, что положительно сказывается на работоспособности электродов.
электроды измерительные (стеклянные, мембранные, редоксметрические) и вспомогательные (сравнения).
Проектирование и выпуск электродов для потенциометрических измерений как измерительные (стеклянные, мембранные, редоксметрические), так и вспомогательные (сравнения).
Для измерения величины рН предлагаем использовать модели электродов по области назначения в лабораторных условиях, в промышленных условиях, специальные электроды:
в лабораторных условиях:
- электроды запаянной конструкции ЭСЛ-43-07, ЭСЛ-43-07СР, ЭСЛ-45-11 для температур от 0 до 40 ºС;
- электроды запаянной конструкции ЭСЛ-63-07, ЭСЛ-63-07СР, ЭСЛ-15-11 для температур от 25 до 100 ºС;
- комбинированные стеклянные лабораторные электроды ЭСКЛ-08М.1 , ЭСКЛ-08М для температур от 0 до 50 ºС, изменение диффузионного потенциала на электролитическом ключе вспомогательного электрода при переносе электрода из кислоты в щелочь не превышает ±1 В;
в промышленных условиях:
- электроды запаянной конструкции ЭСП-04-14 для температур от 0 до 40 ºС;
- электроды запаянной конструкции ЭСП-01-14 для температур от 25 до 100 ºС;
- электрод запаянной конструкции ЭСП-31-06 для температур от 70 до 150 ºС;
- электрод запаянной конструкции ЭС-71-11 — стерилизуемый, диапазон измерения величины рН от -0,5 до 12 рН при 25 ºС (электрод без стерилизации можно использовать для температур от 15 до 80 ºС). Электродное стекло, используемое для изготовления электрода ЭС-71-11, позволяет производить измерения в растворах с величиной рН до -0,5 рН (в растворах, содержащих серную кислоту);
специальные электроды:
- электрод 5М2.840.019 запаянной конструкции — для анализаторов АН-72529/60,
- электрод 5М2.840.074 запаянной конструкции — для анализаторов АС-7932.
Осуществляется продажа ионоселективных стеклянных электродов:
- электроды стеклянные ЭСЛ-51-07, ЭСЛ-51-07СР запаянной конструкции — для измерения активной концентрации ионов натрия Na + и ионов серебра Ag + ,
- электрод стеклянный ЭС-10-07 запаянной конструкции — для измерения активной концентрации ионов натрия Na + , в комплекте с приборами типа р N а-205 измеряет активную концентрацию ионов натрия в химически обессоленной воде и конденсате пара котлов высокого давления ;
- электрод сульфидсеребряный ЭСС-01 — для определения концентрации сульфид-иона S –2 в промышленных условиях, в том числе в сульфатных щелоках целлюлозно-бумажного производства, а также для измерения активной концентрации ионов серебра Ag + ,
- и ионоселективные мембранные электроды:
- электрод аргентитовый ЭА-2 — для измерения активности сульфидных ионов (величины р S ) и может быть применен в промышленных датчиках при автоматическом контроле концентрации сульфидных ионов р S в водных растворах; применяется в выпускаемых нами сигнализаторах СЦ-2,
- электроды мембранные ЭМ- I -01, ЭМ- I -01СР — для измерения активной концентрации ионов I – ,
- электроды мембранные ЭМ- CN -01, ЭМ- CN -01СР — для измерения активной концентрации ионов CN – ; могут применяться в химической и золотодобывающей промышленности, при анализе и очистки сточных вод гальванических цехов, на обогатительных фабриках, в процессах флотации с применением цианистых солей; применяется в выпускаемых нами сигнализаторах СХ-2,
- электроды мембранные ЭМ- Cl -01, ЭМ- Cl -01СР — для измерения активной концентрации ионов Cl ; могут применяться в химической промышленности при контроле технологических процессов, при анализе и очистке сточных вод гальванических цехов, в научных исследованиях, медицине,
- электроды мембранные ЭМ- NO 3-07, ЭМ- NO 3-07СР — для измерения активной концентрации ионов NO – 3; могут применяться для анализа почв, продукции растениеводства, пищевой промышленности; могут быть использованы в лабораторной практике в различных отраслях промышленности, биологии, медицины, охраны окружающей среды,
Для измерения окислительно-восстановительных потенциалов выпускаем электроды, как с использованием драгоценных металлов, так и со специальным электродным стеклом: ЭПВ-1, ЭПВ-1СР, ЭТП-02, ЭПЛ-02, ЭО-01 .
- Электроды ЭПВ-1, ЭПВ-1СР, ЭПЛ-02 являются наиболее распространенными электродами. В обратимых окислительно-восстановительных системах позволяют проводить определение концентраций компонентов до 10 –5 н. В сравнении с электродом ЭТП-02 имеют меньшую чувствительность к примесям и большой срок службы, в особенности при повышенных температурах и в средах, содержащих твердые частицы. Однако газообразные кислород и водород, каталитические яды оказывают влияние на потенциал электрода. Электроды имеют ограничения по шкале окислительных потенциалов, прежде всего в области сред с низкими окислительными потенциалами из-за обратимой системы Н2 / Н + на платине.
- Электрод ЭТП-02 обладает высокой чувствительностью и малой поляризуемостью за счет того, что индикаторная часть выполнена из мелкодисперсной платины. Это позволяет в ряде случаев проводить измерения в малобуферных растворах систем. Высокая чувствительность электрода из-за активности мелкодисперсной платины к газообразным водороду и кислороду, а также к ядам (соединениям серы, мышьяка, ртути) ограничивает его использование в разбавленных растворах и растворах, содержащих газообразные водород и кислород, каталитические яды.
- Электрод ЭО-01 (с электронно-проводящим электродным стеклом) в большинстве растворов обратимых редокс систем имеет меньшие токи обмена, чем платиновая проволока. Как и с электродами ЭПВ-1, с электродом ЭО-01 можно проводить определение концентраций в обратимых системах вплоть до концентраций 10 –5 н, но время установления равновесных потенциалов несколько больше. Для электрода ЭО?01 не характерны каталитические эффекты, не проявляется влияние газообразных кислорода и водорода. Электрод позволяет производить измерения в растворах со слабо выраженными окислительно-восстановительными свойствами (в растворах с относительно низкой буферной емкостью). Из-за сравнительно невысокой химической устойчивости электродного стекла ограничена область применения электрода ЭО-01 по величине рН (от 3 до 11 рН при прямых потенциометрических измерениях).
Преимущества стеклянных электродов
Измерительные стеклянные электроды с внутренним заполнением — запаянной конструкции , о преимуществах электродов запаянной конструкции говорилось ранее.
Кроме того, для исключения влияния статического электричества на показания измерительных высокоомных лабораторных электродов: ЭСЛ-43-07, ЭСЛ-43-07СР,
ЭСЛ-63-07, ЭСЛ-63-07СР, ЭСЛ-45-11, ЭСЛ-15-11, ЭСЛ-51-07, ЭСЛ-51-07СР, ЭС-10-07, а также ЭСП-31-06, ЭС-71-11 мы используем не только бесшумный экранированный коаксиальный кабель с сопротивлением изоляции более 10 12 Ом, но и экранируем внутреннюю часть электрода металлическим экраном, что уменьшает дрейф потенциала.
В эксплуатационных документах мы указываем линейный диапазон ионной характеристики электродов не только для температур 25 ºС (20 ºС), но и для максимальных температур анализируемой среды (требование государственных стандартов) , что позволяет потребителю правильно выбрать необходимый для своих условий электрод, в то время как другие изготовители нормируют линейный диапазон ионной характеристики только для температуры 25 ºС.
В нормативных и эксплуатационных документах на измерительные электроды мы указываем оптимальные диапазоны по температуре анализируемой среды и пределам измерений, что позволяет потребителю правильно выбрать электрод для обеспечения длительной эксплуатации электродов без ухудшения их характеристик.
Для всех стеклянных рН — электродов мешающими ионами являются ионы щелочных металлов — в основном ион натрия, поэтому мы нормируем верхние значения линейного диапазона водородной характеристики рН-электродов при мешающем влиянии ионов натрия, равном 0,1 моль/л (требование государственных стандартов) .
В отсутствии мешающих ионов большинство стеклянных рН электродов имеют линейную функцию вплоть до рН = 14.
Кроме измерительных электродов предлагаются вспомогательные электроды (сравнения) как для промышленных условий, так и для лабораторных.
Это лабораторные электроды ЭВЛ-1М3.1, ЭВЛ-1М4 , электроды промышленные ЭВП-08 , ЭХСВ-1 , электроды 5М2.840.072 5М2.840.072 для лабораторных анализаторов АН?7529/60 и АС-7932.
Электрод сравнения 2-го разряда ЭСО-01
Осущетствляется выпуск единственного на постсоветском пространстве образцового электрода сравнения 2-го разряда ЭСО-01 .
Вспомогательные электроды (сравнения): ЭВЛ-1М3.1, ЭВЛ-1М4, ЭВП-08,
ЭХСВ-1, ЭСО-01 , выпускаемые заводом, являются насыщенными хлорсеребряными, поэтому потенциал электродов стабильный, не зависит от изменения концентрации внутреннего раствора при изменении температуры, температурный коэффициент потенциала электродов не меняет свой знак в зависимости от температуры раствора.
Потенциалообразующая часть лабораторных электродов расположена в верхней части корпуса электродов и не погружается в контролируемый раствор, поэтому влияние температуры контролируемого раствора минимально.
Через электролитический ключ вспомогательного электрода осуществляется связь вспомогательного электрода с анализируемым раствором. На электролитическом ключе возникает диффузионный потенциал. Диффузионный потенциал вспомогательного электрода различается в зависимости от конструкции электролитического ключа и скорости истечения электролита через электролитический ключ. При низкой или неравномерной скорости истечения электролита через ключ меняется диффузионный потенциал, что приводит к неправильным измерением. При проведении точных измерений надо заботиться о постоянстве диффузионных потенциалов.
Практика утверждает, что при использовании ключей с небольшой скоростью истечения диффузионный потенциал нестабилен. Причиной нестабильности диффузионного потенциала керамических ключей моет быть также закупорка пор солевого мостика грязью, осадками или кристаллами хлористого калия. Изменение диффузионного потенциала на керамическом ключе может достигать 12 мВ.
Электролитический ключ: изменение диффузионного потенциала при переносе из кислоты в щелочь не превышает ± 1 мВ
В лабораторных вспомогательных электродах ЭВЛ-М3.1, ЭВЛ-1М4, а также комбинированных лабораторных электродах ЭСКЛ-08М, ЭСКЛ-08М.1 электролитический ключ выполнен таким образом, что изменении диффузионного потенциала на ключе при переносе электрода из кислоты в щелочь (и наоборот) не превышает ± 1 мВ , что важно при проведении точных анализов.
Использование электродов с керамическими ключами при проведении анализов с использованием магнитной мешалки и потенциометрическом титровании также проблематично, так как наблюдается дрейф потенциала и невозможно определить конечную точку титрования.
При использовании электродов: вспомогательных ЭВЛ-1М3.1, ЭВЛ-1М4 и комбинированных электродов ЭСКЛ-08М, ЭСКЛ-08М.1 указанные дефекты не наблюдаются.
Если вытекающий из вспомогательных лабораторных электродов раствор КС l является мешающим (например, для измерения ионов Cl – ), то предприятие выпускает:
- специальный электролитический ключ 1Е5.184.412 для электрода ЭВЛ-1М3.1;
- электролитическую ячейку 1Е5.184.307 для электрода ЭВЛ-1М4.
Конструкция ключа (ячейки) практически исключает попадание в исследуемые растворы хлористого калия, вытекающего из вспомогательных электродов. Эти ключи (ячейки) очень просто отмыть от заливаемого в них раствора и можно использовать для многих вспомогательных электродов.
При таких измерениях в соответствии с рисунком 4 измерительный электрод (1) помещается в стакан (3) с анализируемым раствором (2) непосредственно, а вспомогательный электрод (4) — через электролитический ключ (ячейку) (5). Тип раствора, заливаемого при этом в электролитический ключ (ячейку) (5), определяется указаниями в паспортах на применяемые измерительные ионоселективные электроды или исследователем.
Рисунок 4. Проведение измерений в растворах, если вытекающий раствор К Cl является мешающим
- Измерительный электрод;
- Анализируемый раствор;
- Стакан;
- Вспомогательный электрод ЭВЛ-1М3.1 или ЭВЛ-1М4;
- Электролитический ключ 1Е5.184.412 для электрода ЭВЛ-1М3.1 или электролитическая ячейка 1Е5.184.307 для электрода ЭВЛ-1М4.
При проведении измерений необходимо соблюдать следующие условия:
- уровень раствора в электролитическом ключе (5) должен быть выше уровня анализируемого раствора (2) в стакане (3),
- уровень раствора KCl в электроде (4) должен быть выше уровня раствора в электролитическом ключе (5).
Серийно выпускаемые электроды можно использовать и для проведения измерений в пробах малого объема .
Для этого мы выпускаем специальные ячейки для микроизмерений (рисунок 5), которые входят в комплект поставки приборов таких приборов, как И-160.
Рисунок 5. Проведение измерений в пробах малого объема (микроизмерения)
- Вспомогательный электрод ЭВЛ-1М3.1 или ЭВЛ-1М4;
- Специальная крышка;
- Стакан;
- Измерительный электрод;
- Микродоза — анализируемый раствор;
- Электролитический ключ 5М5.129.001.
Они представляют собой стакан (3) с крышкой (2), в которой имеются отверстия для установки вспомогательного электрода (1), термометра или термокомпенсатора и электролитического ключа (6).
Электролитический ключ для микроизмерений (6) имеет форму цилиндра со сферическим дном, в нижней части которого имеется небольшое удлинение с впаянной нитью, обеспечивающей электрическую связь электролитического ключа со вспомогательным электродом.
В соответствии с рисунком 5 микродоза (анализируемый раствор) и рабочая часть измерительного электрода помещаются в полую часть ключа (6), а вспомогательный электрод погружается в стакан (3), заполненный насыщенным раствором KCl. Уровень раствора KCl в стакане (3) должен быть таким, чтобы обеспечивать надежный контакт с нитью электролитического ключа (6), а уровень анализируемого раствора в ключе (6) — выше уровня раствора КС l в стакане.
- Электроды соответствуют основополагающим стандартам по электродной продукции:
- Все электроды внесены в реестры средств измерений республики Беларусь и Российской Федерации, многие электроды внесены в реестры средств измерений Украины и Казахстана.
- Осущетслена большая работа по созданию и внедрению на предприятии системы высокоэффективных методов управления производством и получен Сертификат соответствия международным стандартам серии ИСО 9000.
Наличие собственных уникальных производств изготовления электродов, основанных на современных технологиях, процесс подготовки производства, выбора материалов, строжайшее соблюдение техпроцессов, отработанных в течение десятилетий, пооперационный контроль каждой операции при изготовлении электродов, тщательный подбор кадров позволяет изготавливать продукцию высокого качества.
Отлаженное производство как измерительных, так и вспомогательных электродов для потенциометрических измерений с технологией, отработанной и усовершенствованной в течение десятилетий
Практически все производители электродной продукции на территории Российской Федерации регулярно закупают различные модели электродов.
Применение уравнения Нернста в решении задач.
При рассмотрении вопроса об окислительно-восстановительных реакциях часто возникает необходимость расчета электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций. В справочниках обычно приведены таблицы т.н. стандартных потенциалов тех или иных процессов, рассчитанных при р=1 атм, Т=298К и активностях участников равных 1. Однако в реальных задачах условия могут значительно отличаться от указанных выше. Как быть в таком случае? Ответ дает уравнение Нернста. В оригинальном виде оно выглядит так:
Как можно заметить, в уравнении фигурируют несколько постоянных величин. Также температура в подавляющем большинстве случаев равна 298К. Кроме того, можно заменить натуральный логарифм на десятичный. Это можно сделать путем умножения на коэффициент перевода. Если собрать все постоянные в единый множитель, то приходим к несколько иному, но более знакомому по учебным пособиям виду уравнения Нернста:
Такой вариант уравнения сильно облегчает жизнь в ряде случаев, например рассмотрении рН-зависимых процессов. Используя данное уравнение можно провести вычисления в любых условиях, приведенных в задаче. Рассмотрим характерные примеры задания по данной теме.
Пример 1:
Рассчитать ЭДС гальванического элемента, составленного из медной и цинковой пластин, погруженных в растворы 0.1М CuSO4 и 0.01М ZnSO4 соответственно. Коэффициенты активности ионов Cu 2+ и Zn 2+ принять равными единице.
Решение:
Для начала запишем уравнения протекающих процессов:
Далее находим по таблице стандартные потенциалы процессов:
Если в условиях задачи ничего не сказано про коэффициенты активности ионов, то можно считать их равными единице, как и в нашем случае. Тогда активности участников процессов можно принять равными их аналитическим концентрациям.
Найдем реальные потенциалы с учетом нестандартных активностей ионов:
Далее необходимо сравнить полученные величины между собой, чтобы определить, кто из участников процесса – окислитель. Потенциал меди больше, чем у цинка, поэтому она будет окислителем. Тогда найдем ЭДС системы:
Ответ: 1.13 В
Пример 2:
Одним из лабораторных способов получения хлора является действие KMnO4 на концентрированную соляную кислоту. Можно ли провести процесс при рН=4?
Решение:
Для начала запишем уравнения протекающих процессов.
Далее находим по таблице стандартные потенциалы процессов:
Несложно заметить, что от рН в данном случае зависит только потенциал перманганата. Тогда воспользуемся уравнением Нернста и рассчитаем его реальный потенциал в условиях задачи:
Получается, что потенциал KMnO4 стал меньше, чем у хлора, а значит, реакция не пойдет.
Электрохимические методы исследования. Потенциометрия
Электрохимические методы исследования.
Биомедицинская значимость темы
Методы потенциометрии используются в клиническом анализе и в практике санитарно-гигиенических исследований. С помощью потенциометрических методов возможно определение концентрации физиологически активных ионов (H3O+, K+, Na+, Ca2+,
Изучение механизмов возникновения электродных и окислительно-восстановительных потенциалов (ОВ-потенциалов) позволяет разобраться в закономерностях многих биохимических процессов в организме, в частности, процессов биологического окисления и установить последовательность и энергетические значения ОВ-процессов. Метод регистрации биопотенциалов используется при исследовании деятельности различных органов, например, при диагностике сердечных заболеваний (электрокардиография). Регистрация биопотенциалов мозга (электроэнцефалограмма) в ряде случаев позволяет судить о патологических нарушениях центральной нервной системы. При изучении явлений возбуждения в мышцах и координации мышечной деятельности у спортсменов применяется метод последовательной регистрации ряда отдельных токов действия мышцы (электромиография). Наряду с этим в медицинской практике широко используют материалы, в частности, металлы при эндопротезировании костных тканей, зубов, при введении которых в организм на границе металл – раствор образуется скачок потенциала и развиваются электрохимические процессы.
Потенциометрическое титрование применяется для определения концентрации биологически активных и лекарственных веществ.
Равновесные электродные процессы
и электродвижущие силы
Электрод — это система, состоящая из проводника I рода, контактирующего с проводником II рода, например, металлическая пластинка, опущенная в раствор соли этого металла. В такой системе на границе металл-раствор (твердая фаза – жидкость) возникает двойной электрический слой, которому соответствует скачок потенциала, называемый электродным потенциалом.
Механизм возникновения электродного потенциала
Теоретической основой объяснения возникновения электродных потенциалов является сольватационная теория — . Согласно этой теории при погружении металлической пластинки в раствор собственной соли имеют место два основных процесса. Первый процесс – это ионизация металла пластинки, где в узлах кристаллической решетки находятся ионы – атомы:
Ионизация происходит под действием полярных молекул растворителя (воды). Образующиеся при этом электроны концентрируются на пластинке, заряжая ее отрицательно, а образующиеся катионы металла переходят с пластинки в раствор и концентрируются возле пластинки (рис.1).

При погружении пластинки металла в раствор вначале преобладает процесс ионизации металла:
но со временем скорость прямой реакции уменьшается, а растет скорость обратной реакции:
пока между этими процессами не установится динамическое равновесие:
Ме + mH2O ⇄ Меn+ × mH2O + nē
или упрощенно Ме ⇄ Меn+ + nē
При этом на границе металл – раствор (твердая фаза – жидкость) устанавливается равновесный двойной электрический слой (ДЭС), т. е. упорядоченное распределение противоположно заряженных частиц на границе раздела фаз (рис 1). ДЭС будет соответствовать скачок потенциала называемый электродным потенциалом. Потенциал, возникающий в условиях равновесия электродной реакции, называется равновесным электродным потенциалом. Абсолютное значение электродного потенциала экспериментально определить невозможно. Однако можно определить разность электродных потенциалов. Поэтому для характеристики электродных процессов пользуются относительными значениями электродных потенциалов. Для этого находят разность потенциалов измеряемого электрода и электрода, потенциал которого условно принимают равным нулю. На величину электродного потенциала влияют природа металла и растворителя. Чем меньше активность металла, тем меньшее количество электронов образуется на пластинке и тем меньший отрицательный заряд возникает на ней. Например, отрицательный заряд медной пластинки в растворе своей соли будет меньше заряда цинковой пластинки, помещенной в раствор собственной соли. Поэтому по отношению к цинковой пластинке (более активный металл) заряд медной пластинки принято считать «положительным». Кроме природы металла электродный потенциал зависит от температуры, активности ионов металла в растворе, а также величины заряда иона металла в растворе. Например, потенциал железного электрода в растворе FeCl3 будет больше потенциала этого же электрода в растворе FeCl2.
Влияние всех перечисленных факторов на величину электродного потенциала металлического электрода выражается уравнением Нернста:
j 


где j0 Меn+/Ме – стандартный электродный потенциал, значение которого определяется природой металла и растворителя, R – универсальная газовая постоянная, равная 8,31 Дж/моль×К; Т – температура в Кельвинах; n – заряд ионов металла; F – число Фарадея, равное 96500 Кл/моль; ln – натуральный логарифм; аМеn+ – активность (концентрация) потенциалопределяющих ионов металла в растворе, моль/л.
Гальванические элементы
Гальванический элемент (химический источник тока) — это устройство, в котором химическая энергия окислительно-восстановительной реакции превращается в электрическую. Гальванический элемент состоит из двух электродов (полуэлементов). Между растворами отдельных электродов устанавливается контакт с помощью электролитического мостика, заполненного насыщенным раствором KCl (солевой мостик) или с помощью мембраны. Они обеспечивают электрическую проводимость между растворами, но препятствуют их взаимной диффузии и являются вместе с электродами внутренней цепью гальванического элемента. Внешняя цепь гальванического элемента – это выводы электродов. По внешней цепи осуществляется переход электронов от одного металла к другому.
Различают гальванические элементы химические (биметаллические) и концентрационные.
Химические гальванические элементы состоят из двух металлов, опущенных в растворы своих солей.
Примером химического гальванического элемента может служить элемент Якоби-Даниэля (рис.2.).
Он состоит из медного электрода (т. е. медной пластинки, погруженной в раствор CuSO4) и цинкового электрода (цинковой пластинки, погруженной в раствор ZnSO4). На поверхности цинковой пластинки возникает ДЭС и устанавливается равновесие Zn ⇄ Zn2+ + 2ē. При этом возникает электродный потенциал цинка. Схема электрода будет иметь вид Zn|ZnSO4 или Zn|Zn2+, где вертикальная черта обозначает границу раздела фаз, на которой возникает ДЭС. Аналогично на медной пластинке также возникает ДЭС и устанавливается равновесие Cu ⇄ Cu2+ + 2ē. Поэтому возникает электродный потенциал меди. А схема электрода будет Cu|CuSO4 или Cu|Cu2+. Соединенные солевым мостиком (мембраной), но разомкнутые во внешней цепи оба электрода (гальванический элемент) могут находится сколько угодно времени не изменяясь. Но при замыкании внешней цепи начинают протекать термодинамически необратимые процессы. На Zn-электроде (как электрохимически более активном), протекает процесс окисления: Zn + 2ē ®Zn2+
Процессы окисления в электрохимии называются анодными процессами, а электроды, на которых идут процессы называются анодами.
На Cu-электроде (электрохимически менее активном) протекает процесс восстановления: Cu2+ + 2ē ®Cu.
Процессы восстановления в электрохимии называются катодными процессами, а электроды, на которых идут процессы восстановления, называются катодами.
При этом электроны, образующиеся на аноде, по внешней цепи двигаются к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Суммарное уравнение электрохимической реакции : Zn + Cu2+ ®Zn2+ + Cu
или Zn + CuSO4 ® ZnSO4 + Cu
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов по внутренней цепи элемента, т. е. электрический ток, поэтому суммарная химическая реакция, протекающая в гальваническом элементе, называется токообразующей.
Схема химического гальванического элемента записывается по правилу «правого плюса». То есть электрод, являющийся катодом (+), пишется справа и его роль играет менее активный металл (в ряду напряжения металлов находящейся правее), Поэтому схема элемента Якоби–Даниэля будет иметь вид:
Двойная черта в схеме обозначает электролитический контакт между электродами, осуществляемый обычно посредством солевого мостика. Он препятствует смешиванию электролитов и обеспечивает протекание электрического тока по внутренней цепи элемента.
В гальваническом элементе между двумя электродами возникает электродвижущая сила, равная разности двух электродных потенциалов. Электродвижущая сила гальванического элемента — величина всегда положительная и рассчитывается по формуле (без учета диффузного потенциала):
Е = j катода – j анода, где j катода > j анода
Отсюда ЭДС медноцинкового гальванического элемента равна:
Е = j Cu2+/Cu – j Zn2+/Zn = j0Cu2+/Cu + 

Гальванический элемент служит источником тока до тех пор, пока весь цинковый электрод (анод) не растворится или не израсходуются из раствора катионы Сu2+, которые разряжаются на катоде.
Концентрационные гальванические элементы состоят из двух одинаковых электродов (например, серебряных), опущенных в растворы одного и того же электролита (например, AgNO3), но разных концентраций. Источником электрического тока в таком элементе служит работа переноса электролита из более концентрированного раствора в более разбавленный. Элемент работает до тех пор, пока сравняются концентрации катионов у анода и катода. Концентрационный гальванический элемент изображают схематически следующим образом:
⊝Ag½AgNO3(C1) ║AgNO3(C2) ½⊕Ag , где С2 > C1
Уравнение для вычисления ЭДС концентрационных гальванических элементов имеет вид: Е = j к – j а = j0Ag+/Ag + 

Е = 
Стандартные электродные потенциалы. Стандартный водородный электрод
Абсолютное значение электродного потенциала в настоящее время измерить или рассчитать невозможно. Но можно определить значение электродного потенциала относительно какого-либо электрода, выбранного в качестве стандарта. Согласно международному соглашению таким стандартом служит стандартный (нормальный) водородный электрод, потенциал которого условно принят за нуль:
j0 

Стандартный электродный потенциал представляет собой электродвижущую силу гальванического элемента, составленного из металла, погруженного в раствор своей соли, и стандартного водородного электрода. Измерения проводят в стандартных условиях: температура – 298К, давление – 101,3 кПа и активность (концентрация) ионов металла в растворе – 1 моль/л.
Если равновесие H2 ⇄ 2Н+ + 2е– смещено вправо и атомы водорода с платиновой пластинки переходят в виде ионов Н+ в раствор, то знак водородного электрода в гальваническом элементе будет отрицательным, а схема гальванической цепи:
ЭДС такой цепи равна: Е= j0 

т. е. для электродов с более высоким значением электродного потенциала, чем у водородного, стандартный электродный потенциал будет величиной положительной (например, j0 Сu2+/Cu= +0,34 В).
Если же в гальваническом элементе к водородному электроду будет направлен поток электронов, то реакция Н2 ⇄ 2Н+ + 2ē будет сдвинута влево, а схема гальванического элемента:
Тогда ЭДС: Е = j0

т. е. для электродов с более низким значением электродного потенциала, чем у водородного, стандартные электродные потенциалы будут отрицательными величинами (например, j0 Zn2+ /Zn = –0,76В).
Если все металлы расположить последовательно по возрастающей величине их стандартных электродных потенциалов, получим ряд напряжений металлов, который широко используется при изучении окислительно-восстановительных свойств металлов и их катионов и в практике составления гальванических элементов.
На величину ЭДС гальванического элемента влияют природа электродов, активность ионов в растворе, температура. Из перечисленных факторов наибольшее влияние на величину ЭДС оказывает природа электродов. Чем дальше друг от друга удалены металлы в ряду напряжений (т. е. чем больше разница между стандартными потенциалами металлов), тем больше ЭДС гальванического элемента, в котором эти металлы использованы.
ЭДС химического гальванического элемента, измеренная при 298К и активной концентрации ионов металла в растворе их солей 1 моль/л называется стандартной ЭДС и равна: Е0 = j0 катода – j0 анода
Например, для медноцинкового элемента стандартная ЭДС будет равна :
Е0 = j0 Cu2+/Cu – j0 Zn2+/Zn = + 0,34 – (–0,76) = 1,1B
Окислительно-восстановительные потенциалы
Электродный потенциал любого металла является окислительно-восстановительным потенциалом (ОВ-потенциал). Однако, в химии принято называть ОВ-потенциалами лишь те, которые возникают на инертных электродах (Рt, Pd и т. д.), помещенных в раствор, содержащий окисленную и восстановленную формы вещества. Например, платиновая пластинка погруженная в раствор содержащий FeCI2 и FeCI3. Схема ОВ-электрода в этом случае будет записывается следующим образом: Pt½ FeCI3, FeCI2 или Pt½Fe3+, Fe2+. Наличие запятой между окисленной и восстановленной формами показывает, что между ними в растворе нет поверхности раздела. Окислитель Fe3+ и восстановитель Fe2+ в растворе непрерывно взаимодействуют друг с другом. Этот обменный процесс описывается уравнениями:
Fe2+ ® Fe3+ + ē и Fe3+ + ē ® Fe2+ .
В присутствии платины, которая в электродном процессе не участвует, обмен электронами между ионами Fe3+ и Fe2+ ускоряется. При этом происходит появление на металле электрического заряда и образование на границе раздела ДЭС. Постепенно происходит выравнивание скоростей окисления и восстановления и в системе инертный металл (Pt) – раствор (Fe3+/Fe2+) устанавливается в ДЭС равновесие, которое характеризуется определенным значением ОВ-потенциала.
Стандартный ОВ-потенциал представляет собой электродвижущую силу гальванического элемента, составленного из ОВ-электрода, в котором активности (концентрации) окисленной и восстановленной форм вещества равны 1 моль/л, и нормального водородного электрода. Значения стандартных ОВ-потенциалов некоторых систем приведены в таблице:
Мn
Мn 
Cr2O 
Cr2O 
Стандартные ОВ-потенциалы являются количественной мерой окислительно-восстановительной способности системы. Чем выше значение j0, тем большей окислительной способностью обладает окисленная форма данной пары. Восстановительные свойства сильнее выражены у восстановленной формы в паре с меньшим значением j0.
Величина ОВ-потенциала в реальных условиях рассчитывается по уравнению Нернста-Петерса (Петерса): j (ок., вос.) = j0 (ок., вос.) + 
где n — число электронов, участвующих в ОВ реакции; аокисл и авосст — активности окисленной и восстановленной форм в растворе. Например, для выше взятого электрода уравнение имеет вид:
j Fе3+/Fе2+ = j0 Fе3+/Fе2+ + 
Если в сопряженную ОВ-систему входят ионы Н+ или ОН— , то потенциал такой системы зависит и от их активности.
Например, для системы МnО





Таким образом, на значение ОВ-потенциала влияет природа сопряженной ОВ-пары, соотношение активностей (концентраций) окисленной и восстановленной форм в растворе, температура и рН раствора. Из уравнения Петерса следует, что чем выше температура, больше концентрация окисленной формы и меньше концентрация восстановленной формы в растворе, тем больше значение ОВ-потенциала и выше окислительная способность системы.
Все используемые в потенциометрии электроды классифицируются по назначению и по механизму возникновения потенциала.
По своему назначению все электроды делятся на электроды сравнения, потенциалы которых не зависят от концентрации исследуемого раствора и электроды определения, на потенциал которых влияет концентрация ионов.
По механизму возникновения электродного потенциала различают обратимые и необратимые электроды.
Обратимыми называются электроды, в которых реакция может идти как в прямом, так и в обратном направлении. Если изменить направление движения тока, то реакция Zn + Cu2+ ⇄ Zn2+ + Cu пойдет в обратном направлении. Металлические электроды (Zn|Zn2+, Cu|Cu2+ и др.) являются обратимыми. Необратимыми электродами являются электроды, на которых при изменении направления тока идет не обратная, а побочная реакция.
Обратимые электроды делят на электроды первого рода, электроды второго рода, окислительно-восстановительные электроды и ионноселективные электроды.
Электроды I рода обратимы только по отношению к одному виду иона — катиона или аниона. К ним относятся, например, рассматриваемые выше металлические электроды, обратимые относительно катиона (Zn|Zn2+, Cu|Cu2+ и др.). Они применимы как электроды определения (индикаторные электроды). Потенциал такого электрода зависит по уравнению Нернста от концентрации (активности) одного иона.
К электродам первого рода относятся также газовые электроды, которые могут быть обратимы по отношению к катиону или аниону. Их создают по схеме
(Ме) газ|раствор. Металл должен быть инертным по отношению в веществам, находящимся в растворе и необходим для создания поверхности, на которой протекает реакция. Типичным примером газового электрода является водородный электрод
(Pt)H2|2H+. Водородный электрод используется как стандартный электрод сравнения, но может служить и электродом определения (когда аН+ ¹ 1 моль/л). Если перейти от натурального логарифма ln к десятичному lg, то уравнение Нернста для водородного электрода примет вид:
j

Так как при 298К сомножитель 

то j 


Отсюда, рН = – 
Электроды II рода обратимы по отношению к двум видам ионов, т. е. их потенциал зависит от активности (концентрации) катиона металла в растворе и аниона труднорастворимой соли этого металла.
Электрод II рода состоит из металла, покрытого слоем его труднорастворимой соли, погруженного в раствор электролита, содержащий анион одноименный с труднорастворимой солью. Примером такого электрода является хлорсеребряный электрод (рис.4), который состоит из серебряной проволоки (1) с нанесенным слоем АgCI (2), погруженной в раствор, содержащий CI–-ионы (HCl, KCl) определенной концентрации, (4) – микрощель для контакта с исследуемым раствором.
Основному химическому процессу
Ag+ + ē ⇄ Ag сопутствует реакция растворения-осаждения труднорастворимого электролита AgCI: AgCI ⇄ Ag++ CI–
В присутствии CI– –ионов растворимость AgCI снижается. При данной температуре и данной концентрации KCI концентрация ионов Ag+ практически постоянна. Потенциал возникает на границе Ag½Ag+ вследствие протекания электродной реакции:
AgCI (т. в.) + ē ⇄ Ag + CI– .
Этот потенциал может быть выражен уравнением Нернста:
j х. с. = j0 Ag+/ Ag +
Для AgCI термодинамическая константа растворимости равна:


Подставляя значение aAg+ в уравнение Нернста, получим:
j х. с. = j0 Ag+/Ag + 



Соединяя постоянные при данной температуре величины j0 Ag+/Ag и 
j х. с. = j0х. с. – 
В конечном итоге потенциал хлорсеребряного электрода зависит от активности (концентрации) ионов хлора в растворе, связанной с активностью катионов серебра через величину 
Используя хлорсеребрянный электрод как электрод сравнения, проще всего поддерживать постоянную активность Cl– – ионов, используя насыщенный раствор KCl. Схема такого электрода Ag½AgCI, KCI.
Ионоселективные электроды — это электроды, потенциал которых зависит от концентрации только одного какого-то иона в растворе. Они служат электродами определения. При помощи ионоселективных электродов можно определить концентрацию ионов Н+, Na+, K+, Ca2+, 

Одним из важнейших представителей группы ионоселективных электродов является стеклянный электрод, потенциал которого зависит только от активности ионов водорода Н+.
Стеклянный электрод (рис.6) представляет собой тонкостенный шарик (мембрана) из специального сорта токопроводящего литиевого стекла (1), наполненный раствором 0,1М HCI (2). В раствор соляной кислоты погружен внутренний хлорсеребряный электрод сравнения (3). Электродная реакция сводится к обмену ионами Н+ между двумя фазами: стеклянной мембраной (1) и исследуемым раствором (4), которая протекает на поверхности стекла: R (Na+, Li+) + H+⇄ R(H+) + (Na+, Li+)
Состояние поверхности стекла определяется главным образом активностью ионов Н+. Стеклянный электрод с водородной функцией схематически записывается:
Ag½AgCI, 0,1M HCI½стекло ½Н+, раствор
Потенциал стеклянного электрода складывается из нескольких потенциалов:
j стекл. = j1 + j2 + j3,
где j1 – потенциал внутреннего хлорсеребряного электрода сравнения (величина постоянная); j2 — потенциал внутренней поверхности стеклянной мембраны (величина постоянная); j3 — потенциал наружной поверхности стеклянной мембраны (величина переменная, зависящая от активности Н+ в исследуемом растворе).Объединяя постоянные величины под К получим уравнение потенциала стеклянного электрода:
j стекл. = К + 0,059 lg aH+ или j стекл = К – 0,059 рН, где К = j1 + j2.
Потенциометрический анализ
Различают прямую потенциометрию (ионометрию) и потенциометрическое титрование.
Потенциометрические методы анализа основаны на определении зависимости между электрохимическим потенциалом индикаторного электрода, погруженного в исследуемый раствор и концентрацией определяемого вещества в этом растворе. Эта зависимость описывается уравнением Нернста. В разбавленных растворах коэффициенты активности ионов близки к единице, а активность близка к концентрации, поэтому можно пользоваться уравнением Нернста в концентрационной форме:
Е = Е0 +
где Е – ЭДС цепи; Е0 – стандартное значение ЭДС гальванической цепи. При измерении ЭДС в окислительно-восстановительных системах применяют уравнение.
Е = Е0 +
где [окисл.], [восст.] – концентрации окисленной и восстановленной форм в растворе, Е0 – значение ЭДС стандартной окислительно-восстановительной цепи. В этом случае применяют инертный металлический электрод, чаще всего платиновый, потенциал которого зависит от соотношения концентраций окисленной и восстановленной форм веществ. Используя газовый электрод в паре с электродом сравнения возможно прямое потенциометрическое определение содержания газа в образце, т. к. в этом случае ЭДС цепи будет определятся уравнением:
Е = const + 
Вышеуказанные уравнения лежат в основе потенциометрических методов анализа.
Потенциометрическое определение рН. Для измерения рН в исследуемый раствор с неизвестной концентрацией ионов Н+ помещают электрод сравнения (например, хлорсеребряный) и стеклянный электрод, являющийся ионноселективным электродом определения. Стеклянный электрод и хлорсеребрянный электрод присоединяют к разным полюсам. Образуется гальваническая цепь, которая условно записывается так:
Ag½AgCI, HCI½стекло ½Н+, раствор║KCl, AgCl½Ag
ЭДС такой цепи равна разности потенциалов хлорсеребряного электрода сравнения и стеклянного электрода определения:
E = j х. с. – jстекл.
Подставим значение j ст. в выражение, получим:
E = j х. с.– (К – 0,059 рН)
Обозначим постоянные j х. с. и К постоянной const, получим:
Е = const + 0,059 рН, откуда
рН =
Потенциометрическое титрование. Потенциометрическим титрованием называют метод определения концентрации или количества вещества по потенциометрическим кривым титрования. В анализируемый раствор опускают электроды определения и сравнения, которые составляют гальваническую цепь. После каждого добавления малых порций титранта (по 0,1 – 0,2 мл) из бюретки в анализируемый раствор измеряют ЭДС или рН. По результатам титрования строят кривую потенциометрического титрования, представляющую собой график зависимости ЭДС в милливольтах от объема раствора титранта в случае окислительно-восстановительного титрования или рН от объема раствора титранта в случае кислотно-основного титрования (рис.6). Кривая потенциометрического титрования характеризуется наличием почти вертикального отрезка кривой, называемой скачком титрования. Скачок титрования свидетельствует о резком изменении потенциала индикаторного электрода (скачок потенциала), а это достигается в том случае, когда в области точки эквивалентности наблюдается резкое изменение концентрации титруемых ионов. Середина скачка титрования соответствует точке эквивалентности, для нее V(титр.) = Vэкв. Потенциометрическое титрование основано на реакциях нетрализации, окисления-восстановления, комплексообразования, осаждения, при этом фиксирование рН или окислительно-восстановительного потенциала по мере прибавления титранта проводится безиндикаторным способом.
Рис.6. Кривые потенциометрического титрования.
1 – сильной кислоты; 2 – слабой кислоты
В зависимости от реакций, лежащих в основе титрования, подбирают титранты, способы определения точки эквивалентности. Типом протекающей реакции определяется и выбор электрода определения. При кислотно-основном титровании рН раствора измеряется с помощью стеклянного электрода определения. При окислительно-восстановительном титровании применяют окислительно-восстановительный платиновый электрод определения. В случае комплексометрического титрования в качестве электрода определения используют ионоселективный электрод, чувствительный к концентрации анализируемого иона, участвующего в реакции комплексообразования.
Потенциометрическое титрование имеет ряд преимуществ по сравнению с другими методами анализа. Относительная погрешность при проведении потенциометрического титрования составляет 0,5 – 1%, что меньше, чем при титровании с индикаторами (1 – 2%). Потенциометрия выгодно отличается от кондуктометрии тем, что присутствующие в растворе электролиты, как правило, не мешают титрованию. Измеряемая ЭДС не обладает тем свойством аддитивности, которое присуще электрической проводимости.
Метод потенциометрического титрования позволяет определить концентрацию веществ в мутных и окрашенных растворах, допускает автоматизацию титрования и определение концентрации нескольких веществ в одной порции исследуемого раствора. Этот метод используется для определения констант диссоциации и констант гидролиза биологически активных веществ(аминокислот, полисахаридов, белков, жиров, нуклеиновых кислот); для определения констант равновесия отдельных стадий биологического окисления; для определения констант нестойкости и состава хелатных комплексных соединений биометаллов с аминокислотами, белками, ферментами. Этот метод используют для изучения кинетики и механизма биохимических реакций, для контроля за физиологическими процессами, связанными с переносом, либо электронов, либо ионов. Потенциометрическое титрование применяют в санитарной практике для анализа и контроля за состоянием окружающей среды.
Основные вопросы темы
1. Электродные и окислительно-восстановительные (ОВ) потенциалы, механизм их возникновения и зависимость от различных факторов. Уравнения Нернста и Петерса для вычисления значений потенциалов.
2. Гальванические элементы (химические и концентрационные): механизм действия и расчет ЭДС. Измерение электродных и ОВ-потенциалов.
3. Обратимые электроды первого и второго рода (водородный и хлорсеребряный). Ионоселективные электроды (стеклянный электрод). Устройство и механизм возникновения потенциала.
4. Электроды сравнения и электроды определения (индикаторные), применяемые в потенциометрии.
5. Сущность потенциометрического определения рН.
6. Потенциометрическое титрование, его сущность и использование в количественном анализе и медико-биологических исследованиях.
Экспериментальные работы
Работа №1. Определение концентрации раствора слабой кислоты и ее
константы диссоциации методом потенциометрического титрования
Цель работы. Научиться определять концентрацию слабой кислоты в растворе и ее константу диссоциации методом потенциометрического титрования.
Приборы и реактивы. Иономер, магнитная мешалка, бюретка для титрования, пипетка Мора на 10 мл, стакан для титрования, раствор уксусной кислоты неизвестной концентрации, 0,1000н раствор гидроксида натрия.
Задание 1. Определить концентрацию уксусной кислоты в растворе.
В стакан для титрования с помощью пипетки Мора отмерить 10 мл исследуемого раствора уксусной кислоты, а затем 10 мл воды. С помощью магнитной мешалки перемешать раствор и измерить значение рН исходного раствора на ионометре, работая строго по инструкции. Далее титровать раствор кислоты, добавляя щелочь из бюретки порциями, объем которых указан в таблице:
http://scienceforyou.ru/jelektrohimija/uravnenie-nernsta
http://pandia.ru/text/78/039/30406.php