Гальванические элементы. ЭДС гальванического элемента
Гальванические элементы – это устройства для получения электрического тока за счет химических реакций, протекающих на электродах. При этом на электродах возникают разные по величине равновесные потенциалы, разность которых определяет электродвижущую силу (ЭДС) данного элемента.
Действие любого гальванического элемента основано на протекании в нем окислительно-восстановительной реакции. В простейшем случае гальванический элемент состоит из двух металлических пластин, погруженных в раствор электролита. В такой системе окисление протекает на одном металле, а восстановление на другом. Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление – катодом.
В качестве примера рассмотрим медно-цинковый гальванический элемент, который называют элемент Даниэля-Якоби. Этот элемент состоит из медной пластины, погруженной в раствор сульфата меди, и цинковой пластины, погруженной в раствор сульфата цинка. Для предупреждения смешивания (диффузии) растворов между ними помещают солевой мостик (концентрированный раствор нейтральной соли, например КСl)
Чтобы выяснить какой из электродов будет анодом, а какой катодом, надо сравнить значения их стандартных электродных потенциалов (Е 0 ). Электрод, у которого Е 0 меньше, будет анодом. В гальваническом элементе Даниэля-ЯкобиЕ 0 Zn2+/Zn 0 Cu2+/Cu, поэтому цинковый электрод будет анодом.
Поэтому на цинковом электроде происходит окисление, а на медном электроде происходит восстановление:
Zn — 2е – → Zn 2+ (3.3)
Сu 2+ + 2е – → Cu (3.4)
Гальванический элемент принято записывать в виде электрохимической схемы (на примере элемента Даниэля-Якоби):
Сплошная вертикальная линия | обозначает границу металл – раствор, а двойная вертикальная || обозначает границу раздела между разными растворами электролитов, т.е. в данном случае солевой мостик. Гальванический элемент принято записывать так, чтобы анод находился слева.
Потенциал электрода рассчитывают по формуле Нернста:

где 

R – универсальная газовая постоянная, Дж/(моль×К);
Т — термодинамическая температура, К;
n – число электронов, участвующих в электродном процессе;
F — число Фарадея, Кл/моль;
а 
Если в уравнение (3.5) подставить значения постоянных R, F, принять температуру для стандартных условий (Т 0 = 298К) и перейти от натуральных к десятичным логарифмам, получим:

Из уравнения (3.6) следует, что стандартный электродный потенциал (E 0 ) – это потенциал электрода при стандартных условиях: 
Стандартные потенциалы 
При расчете ЭДС гальванического элемента от большего электродного потенциала вычитают меньший. Например, ЭДС элемента Даниэля-Якоби:

Рассмотрим пример решения задачи по расчету ЭДС гальванического
элемента (в контрольной работе № 1 это задача № 2)
Задача №2 (а) Вычислите ЭДС цинково-оловянного гальванического элемента, если образующие его электроды опущены в растворы солей с одинаковой активностью катиона.
Решение. Для решения задачи воспользуемся уравнением (3.7). Из этого уравнения ЭДС рассматриваемого гальванического элемента:
Поскольку электроды, образующие гальванический элемент опущены в растворы солей с одинаковой активностью катиона, то 

Задача №2 (б)Вычислите ЭДС серебряно-кадмиевого гальванического элемента, в котором активности ионов Ag + и Cd + соответственно равны 0,1 и 0,005 моль/дм 3 .
Решение. Для нахождения ЭДС серебряно-кадмиевого гальванического элемента необходимо вычислить потенциалы отдельных электродов. Их можно найти с помощью уравнения Нернста (3.6).
В соответствии с уравнением Нернста потенциал серебряного электрода:
Значение 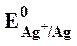
Для кадмиевого электрода можно записать уравнение:
Значение 
При расчете ЭДС гальванического элемента от большего электродного потенциала вычитают меньший:
Вопросы к контрольной работе №2
1. Дисперсность и классификация коллоидных систем.
2. Поверхностное натяжение и смачивание. Адгезия.
3. Адсорбция. Изотерма адсорбции. Природа адсорбционных сил. Теория
4. Адсорбция на границе раствор- газ. Уравнение Гиббса. Правило Дюкло-
5. Адсорбция на границе твердое тело – раствор. Молекулярная, ионная и
6. Седиментационный анализ суспензий. Теоретические основы седимента-
7. Электрокинетические свойства коллоидных систем.
8. Двойной электрический слой и строение мицеллы.
9. Электрофоретический метод определения электрокинетического
10.Теоретические основы адсорбции на границе жидкость-газ.
Перечень вопросов к контрольной работе № 2 для каждого варианта
Применение уравнения Нернста в решении задач.
При рассмотрении вопроса об окислительно-восстановительных реакциях часто возникает необходимость расчета электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций. В справочниках обычно приведены таблицы т.н. стандартных потенциалов тех или иных процессов, рассчитанных при р=1 атм, Т=298К и активностях участников равных 1. Однако в реальных задачах условия могут значительно отличаться от указанных выше. Как быть в таком случае? Ответ дает уравнение Нернста. В оригинальном виде оно выглядит так:
Как можно заметить, в уравнении фигурируют несколько постоянных величин. Также температура в подавляющем большинстве случаев равна 298К. Кроме того, можно заменить натуральный логарифм на десятичный. Это можно сделать путем умножения на коэффициент перевода. Если собрать все постоянные в единый множитель, то приходим к несколько иному, но более знакомому по учебным пособиям виду уравнения Нернста:
Такой вариант уравнения сильно облегчает жизнь в ряде случаев, например рассмотрении рН-зависимых процессов. Используя данное уравнение можно провести вычисления в любых условиях, приведенных в задаче. Рассмотрим характерные примеры задания по данной теме.
Пример 1:
Рассчитать ЭДС гальванического элемента, составленного из медной и цинковой пластин, погруженных в растворы 0.1М CuSO4 и 0.01М ZnSO4 соответственно. Коэффициенты активности ионов Cu 2+ и Zn 2+ принять равными единице.
Решение:
Для начала запишем уравнения протекающих процессов:
Далее находим по таблице стандартные потенциалы процессов:
Если в условиях задачи ничего не сказано про коэффициенты активности ионов, то можно считать их равными единице, как и в нашем случае. Тогда активности участников процессов можно принять равными их аналитическим концентрациям.
Найдем реальные потенциалы с учетом нестандартных активностей ионов:
Далее необходимо сравнить полученные величины между собой, чтобы определить, кто из участников процесса – окислитель. Потенциал меди больше, чем у цинка, поэтому она будет окислителем. Тогда найдем ЭДС системы:
Ответ: 1.13 В
Пример 2:
Одним из лабораторных способов получения хлора является действие KMnO4 на концентрированную соляную кислоту. Можно ли провести процесс при рН=4?
Решение:
Для начала запишем уравнения протекающих процессов.
Далее находим по таблице стандартные потенциалы процессов:
Несложно заметить, что от рН в данном случае зависит только потенциал перманганата. Тогда воспользуемся уравнением Нернста и рассчитаем его реальный потенциал в условиях задачи:
Получается, что потенциал KMnO4 стал меньше, чем у хлора, а значит, реакция не пойдет.
Определение термодинамических характеристик электрохимических цепей
Лабораторная работа № 1
Определение термодинамических характеристик электрохимических цепей.
Система, состоящая из двух электродов, помещенных в раствор электролита, которая при соединении электродов вне электролита каким-либо металлическим проводником создает во внешней цепи электрический ток, называется гальваническим (или электрохимическим) элементом.
Условная запись (схема) гальванического элемента
Для описания гальванических элементов применяется условная запись, в соответствии с которой сначала указывается материал одного из электродов, далее – раствор, в который помещен этот электрод, затем раствор, в который погружен второй электрод, и, наконец, материал другого электрода. Электроды отделяются от раствора сплошной вертикальной линией, а растворы разделяются либо двумя вертикальными линиями, когда считают, что на границе растворов нет скачка потенциала, либо пунктирной линией, когда таким скачком пренебречь нельзя. Так, медно-цинковый элемент может быть записан следующим образом:
где знаки + и – указывают полярность электродов; c1 и c2 – концентрации растворов.
При большой разнице между c1 и c2, когда нельзя пренебречь скачком потенциала на границе двух растворов, этот элемент записывают в другом виде:
(-)Zn½ZnSO4
В тех же случаях, когда хотят указать только участвующие в электродных реакциях ионы, запись упрощают:
Для обратимо работающего гальванического элемента ток всегда должен идти слева направо, а на концах быть один и тот же металл.
Устройство медно-цинкового гальванического элемента (элемента Даниэля-Якоби) показано на рисунке.
Рисунок — Медно-цинковый элемент (элемент Даниэля-Якоби):
1 – пористая диафрагма; 2 – цилиндрический электрод из листового цинка; 3 – медный электрод.
При замыкании электродов через внешнюю цепь на медном электроде пойдет процесс восстановления меди:
а на цинковом электроде – процесс окисления цинка:
Электроны, остающиеся на электроде при реакции окисления, будут перетекать во внешней цепи от цинка к меди, где будут участвовать в процессе восстановления меди. В растворе при работе гальванического элемента ток будет переноситься ионами меди и цинка, движущимися к цинковому электроду, и сульфат-ионами, движущимися к медному электроду.
Равновесные потенциалы медного и цинкового электродов связаны с активностями ионов меди и цинка в растворе уравнением Нернста:
Электродвижущая сила (ЭДС) гальванического элемента. Стандартная ЭДС
Разность равновесных потенциалов электродов гальванического элемента называется электродвижущей силой этого элемента. Для элемента Даниэля-Якоби это можно выразить:

где 
Стандартная ЭДС обратимо работающего гальванического элемента равна разности стандартных потенциалов отдельных электродов гальванического элемента, причем, так как ЭДС всегда положительная величина, от положительного потенциала отнимается отрицательный потенциал.
Вывод уравнения Нернста для гальванического элемента
Если в электрохимической системе обратимо и изотермически протекает следующая реакция:

при 
и обратимая ЭДС ( ЕP, T) системы определяется как:
В то же время изменение энергия Гиббса реакции определяется формулой:
и так как 
где 
В состоянии равновесия при данных давлении и температуре 
Если активности всех компонентов равны единице (аi=1), то 


где Ка — константа равновесия реакции. Из этого следует, что:
Если аi = 1, то 
где Е0 — стандартная ЭДС. Полученное после подстановки уравнение называется уравнением Нернста:


Обратимые и необратимые гальванические элементы
Гальванические элементы могут быть обратимыми и необратимыми. Гальванический элемент является обратимым, если токообразующая реакция в элементе может быть обращена в противоположном направлении при приложении к нему извне ЭДС, превышающей собственную ЭДС элемента на бесконечно малую величину. Примером обратимых гальванических элементов может служить элемент Даниэля-Якоби (если пренебречь переходом ионов через границу растворов):
В этом элементе при его работе будет иметь место реакция:
Zn + CuSO4 ® Cu + ZnSO4
Если к элементу приложить внешнюю ЭДС, противоположно направленную относительно ЭДС элемента, то в нем будет идти реакция:
Cu + ZnSO4 ® CuSO4+ Zn,
т. е. в отличие от токообразующей реакции в элементе медь начнет растворяться, а цинк – выделяться из раствора.
Примером необратимого элемента может служить цепь:
В этом элементе при его работе будет идти процесс:
Zn + CuSO4 ® ZnSO4+Cu
Если приложить к нему внешнюю противоположно направленную ЭДС, то будет происходить процесс растворения меди на медном электроде и ее выделение на цинковом, т. е. этот процесс не будет обратным процессу при работе такого гальванического элемента.
Термодинамические характеристики гальванического элемента
Работа какого-либо обратимого процесса при определенных ограничениях, налагаемых на условия осуществления процесса, например при постоянстве температуры и давления, будет максимальной полезной работой, поэтому термодинамический расчет ЭДС возможен только в случае обратимых гальванических элементов. Зависимость максимальной полезной работы химической реакции в гальваническом элементе от температуры можно связать с уравнениями Гиббса-Гельмгольца:
Максимальная полезная работа электрохимической реакции равна
Подставляя в уравнения Гиббса-Гельмгольца вместо DG и DF их значения, выраженные через ЭДС, можно получить эти уравнения в форме, связывающей ЭДС с тепловым эффектом реакции и температурой:
где ¶Е/¶T – температурный коэффициент, который показывает во сколько раз изменяется ЭДС при увеличении температуры на 1 К.
Или, учитывая, что — DН=Qp – тепловой эффект реакции при постоянном давлении, а — DU=Qv — тепловой эффект реакции при постоянном объеме, можно получить уравнения Томсона, являющиеся частным случаем уравнений Гиббса-Гельмгольца:
В том случае, когда ЭДС гальванического элемента не зависит от температуры, т. е. (¶Е/¶T)р=0 или (¶Е/¶T)v=0, эти уравнения переходят в:
Если ¶Е/¶T > 0, то 
http://scienceforyou.ru/jelektrohimija/uravnenie-nernsta
http://pandia.ru/text/80/353/3320.php



























