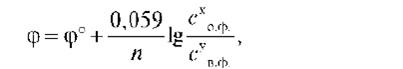Молекулярно-кинетические свойства коллоидно-дисперсных систем
Молекулярно-кинетические свойства называют свойства, обусловленные хаотическим тепловым движение частиц.
Броуновское движение — это непрерывное беспорядочное движение частиц микроскопических и коллоидных размеров не затухающее во времени. Это движение тем интенсивнее, чем выше температура и чем меньше масса частицы и вязкость среды. Броуновское движение присуще частицам, размеры которых не превышают 10 -6 м.
Диффузия– самопроизвольное выравнивание концентрации молекул, ионов или коллоидных частиц под влиянием их теплового движения. Это самопроизвольный процесс, т.к. сопровождается изменением энтропии. С повышением температуры скорость диффузии возрастает. А с повышением вязкости – снижается.
Осмотическое давление.Диффузия может стать односторонней, если растворы разделить полупроницаемой перегородкой, пропускающей только молекулы растворителя.Такая односторонняя диффузия растворителя через полупроницаемую перегородку называется осмосом. Количественно осмос характеризуется осмотическим давлением, равным силе, приходящейся на единицу площади полупроницаемой перегородки, заставляющей молекулы растворителя проникать через нее.Осмотическое давление возрастает с увеличением концентрации растворенного вещества и температуры Растворы с одинаковым осмотическим давлением называются изотоническими. Если осмотическое давление выше внутриклеточного, то оно называется гипертоническим, если ниже внутриклеточного – гипотоническим.
Седиментационное равновесие. Коллоидные частицы в растворе подвергаются действию сил тяжести. В грубодисперсных системах, где размеры частиц велики и они малоподвижны (практически нет броуновского движения), силы тяжести приобретают большое значение, приводя к оседанию (редко к всплыванию) частиц ДФ. Это явление называется седиментация. Высокодисперсные системы (газы или истинные растворы) обладают высокой кинетической устойчивостью, т.к. их частицы маленькие и довольно легкие и подвержены броуновскому движению. В таких системах преобладают процессы диффузии. Коллоидные системы по степени дисперсности занимают промежуточное положение. Действие силы тяжести для коллоидных частиц невелико и уравновешивается броуновским движением и диффузией. Такое состояние называется седиментационным равновесием.
Для истинных растворов характерно пропускание, они являются оптически прозрачными. Грубодисперсные
– оптически мутные (размеры больше длины волны). Для золей характерно рассеивание света в результате
огибания частиц световой волной. Луч света в таких растворах становится видимым ( явление конуса
Тиндаля). Закон светорассеивания(закон Рэлея):
I=I0k * (Cчаст V2 / λ 4),
Где I – интенсивность рассеянного
I0 – интенсивность падающего света
K – константа Рэлея, зависящая от соотношения показателей преломления среду и фазы
Cчаст – частичная концентрация
V – объем частицы дисперсной фазы
Λ – длина волны падающего света
1) интенсивность рассеянного света прямо пропорциональна концентрации частиц.
2) интенсивность рассеянного света прямо пропорциональна квадрату объема частицы.
3) в большей степени при прохождении через золи рассеивается коротковолновое излучени
Электрокинетические свойства:
Электрофорез – движение частиц в электрическом поле, т.е. перемещение частиц дисперсной фазы относительно неподвижной дисперсионной среды под действие внешнего электрического поля.
Электроосмос – движение растворителя в электрическом поле, т.е. перемещение дисперсионной среды относительно неподвижной дисперсной фазы в электрическом поле.
Электроосмос и электрофорез обусловлены наличием двойного электрического поля на поверхности частицы золя. Потенциал протекания— возникновение разности потенциалов при перемещение дисперсной среды относительно неподвижной фазы. Потенциал седиментации – возникновение разности потенциалов при перемещении дисперсной фазы относительно неподвижной дисперсионной среды.
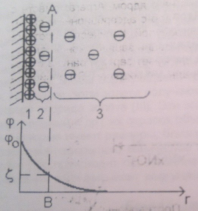
Двойной электрический слой состоит из достаточно прочно связанных с поверхностью дисперсной фазы потенциалопределяющих ионов и эквивалентного количества противоположно заряженных ионов- противоионов, находящихся в дисперсной среде. Потенциалобразующие ионы вместе со связанными противоионами образуют адсорбционный слой. Возникает разность потенциалов.
1 – потенциалопределяющие ионы
2 – адсорбционный слой противоионов
3 – диффузный слой противоионов
АВ- плоскость скольжения
Вопрос 26.
Устойчивость дисперсных систем. Седиментационная, агрегативная и конденсационная устойчивость лиозолей. Факторы, влияющие на устойчивость лиозолей. Коагуляция.
Под устойчивостью дисперсных систем понимают постоянство во времени их свойств, в первую очередь постоянство дисперсности и постоянство равновесного распределения частиц дисперсной фазы в среде.
Седиментационная устойчивость— устойчивость частиц дисперсной системы к оседанию под действием сил тяжести.
агрегативная устойчивость — способность системы противостоять агрегации (укрупнению) частиц дисперсной фазы.
конденсацион. устойчивость характеризует способность ДС сохранять удельную поверхность неизмененной с течением времени
Факторы, определяющие устойчивость систем: броуновское движение, дисперсность частиц дисперсной фазы, вязкость и ионный состав дисперсионной среды и т.д.
Золи являются термодинамически неустойчивыми системами. Частицы дисперсной фазы золей стремятся к уменьшению свободной поверхностной энергии за счет сокращения удельной поверхности коллоидных частиц, что происходит при их объединении. Процесс объединения коллоидных частиц в более крупные агрегаты, и в конечном итоге выпадение их в осадок, называется коагуляцией.
Коагуляцию вызывают различные факторы: механическое воздействие, изменение температуры (кипячение и вымораживание), излучение, посторонние вещества, особенно электролиты, время (старение), концентрация дисперсной фазы.
Билет 27.
Окислительно-восстановительные реакции (редокс).
Окисли́тельно-восстанови́тельные реа́кции(редокс) — это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается.
Окислительно-восстановительные реакции часто сопровождаются высоким энерговыделением, поэтому их используют для получения теплоты или электрич. энергии.
Редокс-системы делят на два типа:
1) в системе осуществляется только перенос электронов Fe 3 + + ē = = Fe 2 +, Sn 2 + — 2ē = Sn 4 +. Это изолированное окислительно-восстановительное равновесие;
2) системы, когда перенос электронов дополняется переносом протонов, т.е. наблюдается совмещенное равновесие разных типов: протолитическое (кислотно-основное) и окислительно-восстановительное с возможной конкуренцией двух частиц протонов и электронов. В биологических системах важные редокс-системы относятся к этому типу.
Механизм возникновения электродного и редокс- потенциалов. Уравнения Нернста.
Скачок потенциала, возникающий на границе раздела металл-раствор его соли, называется электродным или редокс-потенциалом (Фм).
Количественная характеристика, равная разности двух электродных потенциалов получила название электродвижущей силой (ЭДС)
Для электродного потенциала количественная характеристика выражается уравнением Нернста.
гдеz- зарядное число иона, Е0 -электродный потенциал при активности ионов в растворе = 1 и называется стандартным или нормальным потенциалом.
Эффективность окислительных или восстановительных свойств вещества (сила окислителя или восстановителя) зависит:
— от природы вещества
— от условий протекания ОВР и определяется величиной окислительно-восстановительного потенциаласопряженной редокс-пары.
Гальванический элемент— это система, в которой химическая энергия окислительно-восстановительного процесса превращается в электрическую.
Билет 28.
Прогнозирование направления редокс-процессов.
О направлении окислительно-восстановительной реакции можно судить по изменению изобарно-изотермического потенциала системы (энергии Гиббса), свободной энергии (ΔG) процесса. Реакция принципиально возможна при ΔG o o — величина разности стандартных окислительно-восстановительных потенциалов двух сопряженных пар системы, которую называют электродвижущей силой реакций (ЭДС). Данное уравнение отражает физический смысл взаимосвязи Е o и свободной энергии Гиббса реакции.
Для самопроизвольного протекания окислительно-восстановительной реакции необходимо, чтобы разность потенциалов сопряженных пар была величиной положительной, что следует из уравнения, т.е. пара, потенциал которой выше, может выполнять роль окислителя. Реакция идет до тех пор, пока потенциалы обеих пар не станут равными. Следовательно, чтобы ответить на вопрос, будет ли данный восстановитель окисляться данным окислителем или, наоборот, нужно знать ΔE o : ΔE o = φ°окисл. — φ°восстан. Реакция протекает в направлении, которое приводит к образованию более слабого окислителя и более слабого восстановителя. Таким образом, сравнивая потенциалы двух сопряженных пар, можно принципиально решить вопрос направления процесса.
Билет 29.
Лигандообменные реакции.Основные понятия теории строения комплексных соединений: центральный атом, лиганды, координационное число.
Лигандообменные реакции.
К таковым относят реакции, в ходе которых происходит перенос электронной пары с образованием ковалентной связи по донорно-акцепторному механизму. Например:
Характерной особенностью лиганднообменных реакций является то, что образование новых соединений, называемых комплексными, происходит без изменения степени окисления.
А.Вернер был первым из химиков, кто понял, что для объяснения строения и свойств этих необычных соединений необходимо отказаться от представлений о постоянстве валентности. Им была создана так называемая координационная теория, в основу которой было положено следующее:
Введены понятия комплексообразователя (центрального атома) и окружающих его лигандов;
·Описано понятие координационного числа, которое определяется пространственными соотношениями между центральным атомом, и координационной емкости лигандов;
·Расшифрована природа связей центрального атома с лигандами внутренней и внешней сферы (неионогенная и ионогенная);
·На основании этого разработан вопрос о реакционной способности атомов и групп, находящихся во внешней сфере;
·Дана рациональная классификация огромного количества комплексных соединений;
·Предложена теория пространственного строения комплексов;
·Позже введены понятия первичной и вторичной валентности и описано различие между ними.
Комплексообразователь — центральный атом комплексной частицы. Обычно комплексообразователь — атом элемента, образующего металл, но это может быть и атом кислорода, азота, серы, йода и других элементов, образующих неметаллы.
Лиганды(Адденты)— атомы или изолированные группы атомов, располагающиеся вокруг комплексообразователя. Лигандами могут быть частицы, до образования комплексного соединения представлявшие собой молекулы (H2O, CO, NH3 и др.), анионы (OH − , Cl − , PO4 3− и др.), а также катион водорода H + .
Координационное число— число связей, образуемых центральным атомом с лигандами.
Дентатность лиганда определяется числом координационных мест, занимаемых лигандом в координационной сфере комплексообразователя.
Редокс-потенциалов. Уравнения Нернста-Петерса
Мерой окислительно-восстановительной способности веществ служат окислительно-восстановительные потенциалы. Рассмотрим механизм возникновения потенциала. При погружении химически активного металла (Zn, Al) в раствор его соли, например Zn в раствор ZnSO4, происходят дополнительное растворение металла в результате процесса окисления, образование пары, двойного электрического слоя на поверхности металла и возникновение потенциала пары Zn 2+ /Zn ° .
Металл, погруженный в раствор своей соли, например цинк в растворе сульфата цинка, называют электродом первого рода. Это двухфазный электрод, который заряжается отрицательно. Потенциал образуется в результате реакции окисления (рис. 5.1).
Рис. 5.1. Окисление цинка
При погружении в раствор своей соли малоактивных металлов (Cu) наблюдается противоположный процесс. На границе металла с раствором соли происходит осаждение металла в результате процесса восстановления иона, обладающего высокой акцепторной способностью к электрону, что обусловлено высоким зарядом ядра и малым радиусом иона. Электрод заряжается положительно, в приэлектродном пространстве избыточные анионы соли формируют второй слой, возникает электродный потенциал пары Cu 2+ /Cu ° . Потенциал образуется в результате процесса восстановления (рис. 5.2). Механизм, величина и знак электродного потенциала определяются строением атомов участников электродного процесса.
Рис. 5.2. Восстановление меди
Итак, потенциал, который возникает на границе раздела металла с раствором в результате окислительного и восстановительного процессов, протекающих с участием металла (электрода) и образованием двойного электрического слоя называют электродным потенциалом.
Если отводить электроны с цинковой пластины на медную, то равновесие на пластинках нарушается. Для этого соединим цинковую и медную пластины, погруженные в растворы их солей, металлическим проводником, приэлектродные растворы — электролитным мостиком (трубка с раствором K2SO4), чтобы замкнуть цепь. На цинковом электроде протекает полуреакция окисления: Zn 0 (т) — 2ē → Zn 2+ (р-р), а на медном — полуреакция восстановления: Cu 2+ (р-р) + 2ē → Cu 0 (т)
Электрический ток обусловлен суммарной окислительно-восстановительной реакцией:
Zn 0 (т) + Cu 2+ (р-р) → Zn 2+ (р-р) + Cu 0 (т)
Окислительно-восстановительные потенциалы пары зависят от природы участников электродного процесса и соотношения равновесных концентраций окисленной и восстановленной форм участников электродного процесса в растворе, температуры раствора и описываются уравнением Нернста.
Количественной характеристикой окислительно-восстановительной системы является редокс-потенциал, возникающий на границе раздела фаз платина — водный раствор. Величина потенциала в единицах СИ измеряется в вольтах (В) и рассчитывается по уравнению Нернста-Петерса:
где а(Oх) и a(Red) — активность окисленной и восстановленной форм соответственно; R — универсальная газовая постоянная; Т — термодинамическая температура, К; F — постоянная Фарадея (96500 Кл/моль); n — число электронов, принимающих участие в элементарном редокс-процессе; а — активность ионов гидроксония; m — стехиометрический коэффициент перед ионом водорода в полуреакции. Величина φ° — стандартный редокс-потенциал, т.е. потенциал, измеренный при условиях а(Oх) = a(Red) = a(H + ) = 1 и данной температуре.
Стандартный потенциал системы 2Н + /Н2 принят равным 0 В. Стандартные потенциалы являются справочными величинами, табулируются при температуре 298К. Сильнокислая среда не характерна для биологических систем, поэтому для характеристики процессов, протекающих в живых системах, чаще используют формальный потенциал, определяемый при условии а(Oх) = a(Red), pH 7,4 и температуре 310К (физиологический уровень). При записи потенциала пара указывается в виде дроби, причем окислитель записывается в числителе, а восстановитель в знаменателе.
Для 25°С (298К) после подстановки постоянных величин (R = 8,31 Дж/моль×град; F = 96500 Кл/моль) уравнение Нернста принимает следующий вид:
где φ°- стандартный окислительно-восстановительный потенциал пары, В; Со.ф. и Св.ф. — произведение равновесных концентраций окисленной и восстановленной форм соответственно; х и у — стехиометрические коэффициенты в уравнении полуреакций.
Редокс-системы делят на два типа:
1. в системе осуществляется только перенос электронов: Fe 3+ +ē = Fe 2+ , Sn 2+ — 2ē = Sn 4+ . Это изолированное окислительно-восстановительное равновесие;
2. системы, когда перенос электронов дополняется переносом протонов, т.е. наблюдается совмещенное равновесие разных типов: протолитическое (кислотно-основное) и окислительно-восстановительное с возможной конкуренцией двух частиц протонов и электронов. В биологических системах важные редокс-системы относятся к этому типу.
Примером системы второго типа является процесс утилизации перекиси водорода в организме: Н2О2 + 2Н + + 2ē ↔ 2Н2О, а также восстановление в кислой среде многих окислителей, содержащих кислород: CrО4 2- , Cr2О7 2- , MnО4 — . Например, MnО4 — + 8Н + + 5ē = = Mn 2+ + 4Н2О. В данной полуреакции участвуют электроны и протоны.
Итак, окислительно-восстановительный потенциал (ОВП) – это потенциал системы, в которой активности окислительной и восстановительной форм данного вещества равны единице. ОВП измеряется с помощью окислительно-восстановительных электродов в сочетании со стандартными электродами сравнения.
В каждой окислительно-восстановительной реакции есть своя редокс-пара – эта пара имеет вещество в окисленной и восстановленной форме (Fe +3 /Fe +2 ).
Количественной мерой активности редокс-пары является величина ее ОВП.
Занятие №9. Электродные и редокс — потенциалы. уравнение нернста-петерса. редокс-системы в жизнедеятельности
ЗАНЯТИЕ № 9. ЭЛЕКТРОДНЫЕ И РЕДОКС — ПОТЕНЦИАЛЫ.
УРАВНЕНИЕ НЕРНСТА-ПЕТЕРСА. РЕДОКС-СИСТЕМЫ В ЖИЗНЕДЕЯТЕЛЬНОСТИ.
Необходимый базовый уровень:
1) окислительно-восстановительные реакции
2) окислитель и восстановитель
3) ЭДС окислительно-восстановительной реакции
Вопросы для подготовки к занятию:
1) Механизм возникновения электродного потенциала. Элемент Даниэля-Якоби. Уравнение Нернста.
2) Окислительно-восстановительная система: типы окислительно-восстановительных систем. Уравнение Нернста-Петерса.
3) Механизм возникновения редокс-потенциала. Факторы, влияющие на редокс-потенциалы: влияние лигандного окружения центрального атома на величину редокс-потенциала.
4) Водородный электрод: устройство, применение. Уравнение Нернста для водородного электрода.
5) Измерение ЭДС с помощью водородного электрода. Ряд напряжений металлов.
6) Ионселективные электроды: стеклянный электрод. Уравнение Нернста для стеклянного электрода.
7) Определение рН растворов с помощью водородного и стеклянного электродов.
8) ЭДС электрохимической реакции. Константа окислительно-восстановительного процесса.
Определение стандартного редокс-потенциала системы Fe3+/Fe2+ потенциометрическим методом.
НА ЗАНЯТИИ БУДЕТ ПРОВЕДЕН ВХОДНОЙ ТЕСТ-КОНТРОЛЬ!
Задачи и упражнения для самоподготовки
Вычислить потенциал серебряного электрода (Ag+/Ag0), погруженного в 0,01 М раствор AgNO3 при 250С, ?0(Ag+/Ag0) = +0,799 В. Ответ: 0,68 В. Потенциал цинкового электрода, помещенного в раствор собственной соли при Т = 298 К составил -0,819 В. Вычислить концентрацию ионов Zn2+, если ?0(Zn2+/ Zn0)=-0,76 В. Ответ: С(Zn2+)=0,01 моль/л. Рассчитать при 298 К редокс-потенциал системы Sn4+/Sn2+, содержащей смесь солей SnCl2 и SnCl4, если С(Sn2+) = 0,01 моль/л, С(Sn4+) = 0,05 моль/л. ?0(Sn4+/Sn2+) = 0,15 В. Ответ: 0,17 В. Рассчитать стандартный окислительно-восстановительный потенциал (?0(Fe3+/Fe2+) при 298 К, если ЭДС (Е) гальванического элемента, состоящего из этого редокс-электрода и насыщенного хлорсеребряного электрода, равняется +0,55 В, С(Fe2+) = 0,05 моль/л, С(Fe3+) = 0,02 моль/л, ?0(нас. хлорсер. эл.) = 0,201 В. Схема гальванической цепи:
Ag, AgCl (т) | KCl (нас.) || Fe2+, Fe3+ | Pt
При температуре 250С потенциал водородного электрода, погруженного в исследуемый раствор, ?(2Н+/Н2) = – 0,118 В. Вычислить рН этого раствора. Ответ: 2. Вычислите при 100С потенциал водородного электрода, погруженного в раствор NaOH с концентрацией 0,001 моль/л. Ответ: –0,623 В. Гальванический элемент составлен из хлорсеребряного и водородного электродов, погруженных в желудочный сок. При 370С ЭДС (Е) элемента равна 0,308 В, ?ХСЭ при этой же температуре равна 0,223В. Вычислить рН желудочного сока. Ответ: 1,38 В. Для измерения рН желчи из пузыря была составлена гальваническая цепь из водородного и хлорсеребряного электродов (?0(хлорсер. эл.) = 0,238 В). Измеренная при 250С ЭДС составила 0,577 В. Вычислите рН желчи. Ответ: 5,74. Концентрации MnO4– и Mn2+ равны между собой. Как изменится редокс-потенциал при окислении 20% ионов Mn2+ при постоянном рН и при 250С? (?0 = 1,59 В). Ответ: увеличится на 0,176 В.
Общая химия. Биофизическая химия. Химия биогенных элементов/, , ; Под ред. .- 3-е изд., стер.-М.: Высш. шк., 2002.-С.464-488. , . Общая химия.- М.: ГЭОТАР-Медиа, 2007-С.687-724. Руководство к практическим занятиям по общей химии: Методические разработки к выполнению лабораторных работ.-Ч. II / Сост. , , и др.-Ижевск, 2004.- С. 16-21.
http://megaobuchalka.ru/4/29582.html
http://pandia.ru/text/82/063/93731.php