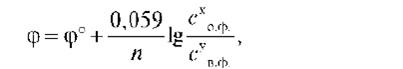Редокс-потенциалов. Уравнения Нернста-Петерса
Мерой окислительно-восстановительной способности веществ служат окислительно-восстановительные потенциалы. Рассмотрим механизм возникновения потенциала. При погружении химически активного металла (Zn, Al) в раствор его соли, например Zn в раствор ZnSO4, происходят дополнительное растворение металла в результате процесса окисления, образование пары, двойного электрического слоя на поверхности металла и возникновение потенциала пары Zn 2+ /Zn ° .
Металл, погруженный в раствор своей соли, например цинк в растворе сульфата цинка, называют электродом первого рода. Это двухфазный электрод, который заряжается отрицательно. Потенциал образуется в результате реакции окисления (рис. 5.1).
Рис. 5.1. Окисление цинка
При погружении в раствор своей соли малоактивных металлов (Cu) наблюдается противоположный процесс. На границе металла с раствором соли происходит осаждение металла в результате процесса восстановления иона, обладающего высокой акцепторной способностью к электрону, что обусловлено высоким зарядом ядра и малым радиусом иона. Электрод заряжается положительно, в приэлектродном пространстве избыточные анионы соли формируют второй слой, возникает электродный потенциал пары Cu 2+ /Cu ° . Потенциал образуется в результате процесса восстановления (рис. 5.2). Механизм, величина и знак электродного потенциала определяются строением атомов участников электродного процесса.
Рис. 5.2. Восстановление меди
Итак, потенциал, который возникает на границе раздела металла с раствором в результате окислительного и восстановительного процессов, протекающих с участием металла (электрода) и образованием двойного электрического слоя называют электродным потенциалом.
Если отводить электроны с цинковой пластины на медную, то равновесие на пластинках нарушается. Для этого соединим цинковую и медную пластины, погруженные в растворы их солей, металлическим проводником, приэлектродные растворы — электролитным мостиком (трубка с раствором K2SO4), чтобы замкнуть цепь. На цинковом электроде протекает полуреакция окисления: Zn 0 (т) — 2ē → Zn 2+ (р-р), а на медном — полуреакция восстановления: Cu 2+ (р-р) + 2ē → Cu 0 (т)
Электрический ток обусловлен суммарной окислительно-восстановительной реакцией:
Zn 0 (т) + Cu 2+ (р-р) → Zn 2+ (р-р) + Cu 0 (т)
Окислительно-восстановительные потенциалы пары зависят от природы участников электродного процесса и соотношения равновесных концентраций окисленной и восстановленной форм участников электродного процесса в растворе, температуры раствора и описываются уравнением Нернста.
Количественной характеристикой окислительно-восстановительной системы является редокс-потенциал, возникающий на границе раздела фаз платина — водный раствор. Величина потенциала в единицах СИ измеряется в вольтах (В) и рассчитывается по уравнению Нернста-Петерса:
где а(Oх) и a(Red) — активность окисленной и восстановленной форм соответственно; R — универсальная газовая постоянная; Т — термодинамическая температура, К; F — постоянная Фарадея (96500 Кл/моль); n — число электронов, принимающих участие в элементарном редокс-процессе; а — активность ионов гидроксония; m — стехиометрический коэффициент перед ионом водорода в полуреакции. Величина φ° — стандартный редокс-потенциал, т.е. потенциал, измеренный при условиях а(Oх) = a(Red) = a(H + ) = 1 и данной температуре.
Стандартный потенциал системы 2Н + /Н2 принят равным 0 В. Стандартные потенциалы являются справочными величинами, табулируются при температуре 298К. Сильнокислая среда не характерна для биологических систем, поэтому для характеристики процессов, протекающих в живых системах, чаще используют формальный потенциал, определяемый при условии а(Oх) = a(Red), pH 7,4 и температуре 310К (физиологический уровень). При записи потенциала пара указывается в виде дроби, причем окислитель записывается в числителе, а восстановитель в знаменателе.
Для 25°С (298К) после подстановки постоянных величин (R = 8,31 Дж/моль×град; F = 96500 Кл/моль) уравнение Нернста принимает следующий вид:
где φ°- стандартный окислительно-восстановительный потенциал пары, В; Со.ф. и Св.ф. — произведение равновесных концентраций окисленной и восстановленной форм соответственно; х и у — стехиометрические коэффициенты в уравнении полуреакций.
Редокс-системы делят на два типа:
1. в системе осуществляется только перенос электронов: Fe 3+ +ē = Fe 2+ , Sn 2+ — 2ē = Sn 4+ . Это изолированное окислительно-восстановительное равновесие;
2. системы, когда перенос электронов дополняется переносом протонов, т.е. наблюдается совмещенное равновесие разных типов: протолитическое (кислотно-основное) и окислительно-восстановительное с возможной конкуренцией двух частиц протонов и электронов. В биологических системах важные редокс-системы относятся к этому типу.
Примером системы второго типа является процесс утилизации перекиси водорода в организме: Н2О2 + 2Н + + 2ē ↔ 2Н2О, а также восстановление в кислой среде многих окислителей, содержащих кислород: CrО4 2- , Cr2О7 2- , MnО4 — . Например, MnО4 — + 8Н + + 5ē = = Mn 2+ + 4Н2О. В данной полуреакции участвуют электроны и протоны.
Итак, окислительно-восстановительный потенциал (ОВП) – это потенциал системы, в которой активности окислительной и восстановительной форм данного вещества равны единице. ОВП измеряется с помощью окислительно-восстановительных электродов в сочетании со стандартными электродами сравнения.
В каждой окислительно-восстановительной реакции есть своя редокс-пара – эта пара имеет вещество в окисленной и восстановленной форме (Fe +3 /Fe +2 ).
Количественной мерой активности редокс-пары является величина ее ОВП.
Применение уравнения Нернста в решении задач.
При рассмотрении вопроса об окислительно-восстановительных реакциях часто возникает необходимость расчета электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций. В справочниках обычно приведены таблицы т.н. стандартных потенциалов тех или иных процессов, рассчитанных при р=1 атм, Т=298К и активностях участников равных 1. Однако в реальных задачах условия могут значительно отличаться от указанных выше. Как быть в таком случае? Ответ дает уравнение Нернста. В оригинальном виде оно выглядит так:
Как можно заметить, в уравнении фигурируют несколько постоянных величин. Также температура в подавляющем большинстве случаев равна 298К. Кроме того, можно заменить натуральный логарифм на десятичный. Это можно сделать путем умножения на коэффициент перевода. Если собрать все постоянные в единый множитель, то приходим к несколько иному, но более знакомому по учебным пособиям виду уравнения Нернста:
Такой вариант уравнения сильно облегчает жизнь в ряде случаев, например рассмотрении рН-зависимых процессов. Используя данное уравнение можно провести вычисления в любых условиях, приведенных в задаче. Рассмотрим характерные примеры задания по данной теме.
Пример 1:
Рассчитать ЭДС гальванического элемента, составленного из медной и цинковой пластин, погруженных в растворы 0.1М CuSO4 и 0.01М ZnSO4 соответственно. Коэффициенты активности ионов Cu 2+ и Zn 2+ принять равными единице.
Решение:
Для начала запишем уравнения протекающих процессов:
Далее находим по таблице стандартные потенциалы процессов:
Если в условиях задачи ничего не сказано про коэффициенты активности ионов, то можно считать их равными единице, как и в нашем случае. Тогда активности участников процессов можно принять равными их аналитическим концентрациям.
Найдем реальные потенциалы с учетом нестандартных активностей ионов:
Далее необходимо сравнить полученные величины между собой, чтобы определить, кто из участников процесса – окислитель. Потенциал меди больше, чем у цинка, поэтому она будет окислителем. Тогда найдем ЭДС системы:
Ответ: 1.13 В
Пример 2:
Одним из лабораторных способов получения хлора является действие KMnO4 на концентрированную соляную кислоту. Можно ли провести процесс при рН=4?
Решение:
Для начала запишем уравнения протекающих процессов.
Далее находим по таблице стандартные потенциалы процессов:
Несложно заметить, что от рН в данном случае зависит только потенциал перманганата. Тогда воспользуемся уравнением Нернста и рассчитаем его реальный потенциал в условиях задачи:
Получается, что потенциал KMnO4 стал меньше, чем у хлора, а значит, реакция не пойдет.
Материал к экзамену по химии. Основные понятия термодинамики
| Название | Основные понятия термодинамики |
| Дата | 31.01.2020 |
| Размер | 1.97 Mb. |
| Формат файла |  |
| Имя файла | Материал к экзамену по химии.docx |
| Тип | Документы #106585 |
| страница | 23 из 31 |
| Подборка по базе: Лекционный материал основы монтажа и ремонта технологического об, Понятие и основные черты.docx, БӨЖ. Султан Аружан, Сүгір Аяулым. Медициналық құралдармен матери, Методические указания, практические материалы и примеры решения , Курсовая работ по теме _Анализ материальных ресурсов_ ГАЙНУЛИНА., Кудашкина Е.А. ЗСП-20 Строительные материалы (Ответы на контрол., Автомобильные эксплуатационные материалы.docx, Тест 5. Основные понятия математической статистики. Вариационные, Основные понятия и определения в области организации вычислитель, Дополнительные материалы (мультимедийные материалы, ссылки на эл Строение двойного электрического слоя. Двойной электрический слой (межфазный) (ДЭС) — слой ионов, образующийся на поверхности частиц в результате адсорбции ионов из раствора, диссоциации поверхностного соединения или ориентирования полярных молекул на границе фаз. ДЭС состоит из достаточно прочно связанных с поверхностью дисперсной фазы потенциалопределяющих ионов и эквивалентного количества противоположно заряженных ионов – противоионов, находящихся в дисперсионной среде. Потенциалопределяющие ионы вместе со связанными противоионами образуют адсорбционный слой, толщина которого невелика и измеряется несколькими ионными диаметрами. Оставшаяся часть противоионов образует диффузный слой с убывающей концентрацией. Потенциалопределяющие ионы создают на дисперсной фазе электрический заряд. Противоположный по знаку заряд сосредоточен в дисперсионной среде. Разность потенциалов между дисперсной фазой и дисперсионной средой – электротермодинамический потенциал определяется свойствами данной дисперсной системы. По мере удаления от межфазной границы его значение уменьшается. Как известно из гидродинамики, движение твёрдой и жидкой фаз относительно друг друга происходит не на границе раздела фаз, а на некотором расстоянии от границы. Поверхность, по которой происходит перемещение, называется поверхностью скольжения. Электрокинетический потенциал и его зависимость от различных факторов. Скачок потенциала на поверхности скольжения тесно связан с электрокинетическими явлениями и называется электрокинетическим потенциалом или ζ – потенциалом (дзета-потенциалом). Электрокинетический потенциал – часть электротермодинамического. Его значение определяется толщиной диффузного слоя. При сжатии диффузного слоя, например, вследствие увеличения концентрации электролитов в дисперсионной среде, часть противоионов переходит за поверхность скольжения в адсорбционный слой. Электротермодинамический потенциал при этом не изменяется, а дзета-потенциал уменьшается по абсолютному значению. При наличии многозарядных противоионов с ростом концентрации электролита дзета-потенциал не только уменьшается, но может изменить знак и происходит перезарядка коллоидных частиц. Электрокинетический потенциал зависит от температуры. С повышением температуры электрокинетический потенциал уменьшается. Билет 26. Устойчивость дисперсных систем . Седиментационная, агрегативная и конденсационная устойчивость лиозолей. Факторы, влияющие на устойчивость лиозолей. Коагуляция. Устойчивость дисперсных систем Устойчивость дисперсных систем – неизменность во времени основных параметров дисперсной системы: степень дисперсности и равномерного распределения частей дисперсной фазы в дисперсной среде. Седиментационная, агрегативная и конденсационная устойчивость лиозолей. Седиментационная устойчивость – это способность системы противодействовать оседанию частиц (силе тяжести). Агрегативная устойчивость – это способность дисперсной системы сохранять неизменной во времени степень дисперсности, т.е. размеры частиц и их индивидуальность. Конденсационная устойчивость – способность дисперсных систем сохранять неизменной с течением времени удельную поверхность. Факторы, влияющие на устойчивость лиозолей.
Повысить седиментационную устойчивость дисперсной системы можно за счет следующих факторов:
Коагуляция. Коагуляция – процесс разрушения коллоидных систем за счёт слипания частиц, образование более крупных агрегатов с потерей устойчивости и последующим разделением фаз. Коагуляция золей происходит посредством следующих факторов:
Билет 27. Окислительно-восстановительные (редокс) реакции . Механизм возникновения электродного и редокс-потенциалов. Уравнения Нернста-Петерса. Сравнительная сила окислителей и восстановителей. Стандартный электродный потенциал. Гальванический элемент. Окислительно-восстановительные (редокс) реакции Окислительно-восстановительные реакции – химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором). Механизм возникновения электродного и редокс-потенциалов. При погружении Ме в раствор, содержащий ион этого же Ме, на поверхности раздела фаз образуется двойной слой и возникает скачок равновесного потенциала – электродный потенциал. Полученная система Ме+раствор называют электродом. Обозначение (на примере цинка) Количественной характеристикой редокс-систем, в которых и окислитель, и восстановитель находятся в растворенном состоянии, является редокс-потенциал. Чем больше величина редокс-потенциала, тем сильнее окислитель и слабее сопряженный ему восстановитель. Сильный окислитель вступает в реакции с большим числом восстановителей, чем слабый, и/или вызывает более глубокое окисление восстановителей. Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар. где – электродный потенциал; – стандартный электродный потенциал; R – универсальная газовая постоянная (8,31 Дж/моль*К); Т – абсолютная температура, К; n – число электронов участвующих в электронном процессе; F – постоянная Фарадея (96500 кл/моль); а – активность ионов металла в растворе 1 моль/л Уравнение Петерса – устанавливает количественную зависимость окислительно-восстановительного потенциала от природы ОВ-системы, соотношения активностей окисленной и восстановленной форм, температуры и от активности ионов водорода: где – ОВ-потенциал, В; — стандартный ОВ-потенциал, В; z – число электронов, которое присоединяет частица окисленной формы Ox, переходя в восстановительную форму Red, — активность окисленной формы, моль/л; — активность восстановительной формы, моль/л; Сравнительная сила окислителей и восстановителей. Силу окислителей и восстановителей можно сравнить, использую значения электродных потенциалов. Окислитель – вещество или химический элемент, принимающий электроны в ОВР. Восстановитель – отдающий электрон. В этой реакции более сильным окислителем будет ток, система которого имеет больший положительный потенциал, то есть MnO4 — , а более сильным восстановителем тот, система которого имеет более отрицательный потенциал S03 2- . Стандартный электродный потенциал Стандартный потенциал (нормальный потенциал), значение электродного потенциала , измеренное в стандартных условиях относительно выбранного электрода сравнения (стандартного электрода). О существляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей) Гальванический элемент – электрохимическая система, состоящая из двух электродов любого типа и в которой самопроизвольно протекает окислительно-восстановительная реакция, энергия которой преобразуется в электрическую энергию. (химический источник тока) Гальванические элементы бывают электрохимические (источником энергии является химическая реакция) и концентрационные (источником электрической энергии служат процессы выравнивания концентраций растворов) Правило записи ГЭ. Слева пишется электрод с меньшим стандартным электродным потенциалом, он называется анодом (А), на нём происходит процесс окисления. Справа пишется электрод с большим стандартным потенциалом, называется катодом (К), на нём происходит процесс восстановления. Пример: гальванический элемент Даниэля-Якоби Zn|ZnSO4 ( =-0,76 В) — анод Cu|CuSO4 ( =0,34 В) – катод Билет 28. Прогнозирование направления редокс-процессов по величинам редокс- потенциалов. Связь ЭДС с энергией Гиббса и константой равновесия реакций, протекающих в гальваническом элементе. источники: http://scienceforyou.ru/jelektrohimija/uravnenie-nernsta http://topuch.ru/osnovnie-ponyatiya-termodinamiki-v2/index23.html |