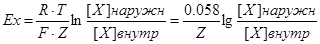Уравнение нернста потенциал нернста его природа
При наличии разности потенциалов по обе стороны мембраны ионы движутся через нее, даже если отсутствует движущая сила в виде разницы концентраций. Положительный заряд притягивает отрицательные ионы, а отрицательный — отталкивает их. В результате происходит общая диффузия слева направо. Со временем направо переходит достаточно большое количество отрицательных ионов, благодаря чему, возникает разность концентраций ионов, действующая на ионы в направлении, противоположном действию электрического потенциала.
Разность концентраций теперь способствует движению ионов справа налево, в то время как электрический потенциал заставляет их двигаться слева направо. Когда разность концентраций становится достаточно высокой, оба процесса уравновешивают друг друга. При 37°С, что соответствует нормальной температуре тела, электрический потенциал, уравновешивающий данную разницу концентраций одновалентных ионов, например ионов натрия, можно определить по следующей формуле, называемой уравнением Нернста:
ЭДС(MB)=±61*log(C1/C2), где ЭДС — электродвижущая сила (разность потенциалов) между сторонами 1 и 2, С1 и С2 — концентрации на сторонах 1 и 2, соответственно. Это уравнение чрезвычайно важно для понимания передачи нервных импульсов.
Влияние различий давления по обе стороны мембраны.
Иногда между двумя сторонами доступной для диффузии мембраны развивается значительная разность давления. Это, например, характерно для мембраны кровеносных капилляров всех тканей организма. Внутри капилляра давление примерно на 20 мм рт. ст. выше, чем снаружи. Фактически давление представляет собой сумму всех сил различных молекул, сталкивающихся с мембраной в конкретный момент времени, в расчете на единицу поверхности. Следовательно, когда давление на одной стороне мембраны выше, чем на другой, это значит, что сумма сил всех молекул, сталкивающихся с каналами, с одной стороны мембраны больше, чем с другой.
В большинстве случаев это связано с тем, что количество молекул, ударяющихся о мембрану в секунду, с одной ее стороны больше, чем с другой. В результате со стороны высокого давления количество имеющейся энергии больше, что обеспечивает общее движение молекул в область низкого давления. Созданное с помощью поршня высокое давление с одной стороны поры ведет к столкновению с этой стороной большего числа молекул, в связи с чем больше молекул диффундирует к другой стороне поры.
Осмос — диффузия воды
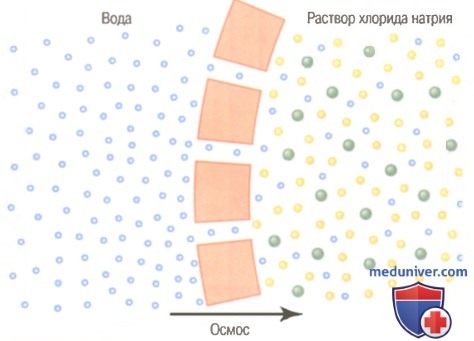
Известно, что самым распространенным веществом, диффундирующим через клеточную мембрану, является вода. Обычно количество воды, проходящей в каждом направлении через мембрану эритроцита в секунду, эквивалентно 100 объемам клетки. Однако в норме количество воды, диффундирующее в обоих направлениях, сбалансировано настолько точно, что общая диффузия воды равна нулю. Следовательно, объем клетки остается постоянным. Однако при определенных условиях может возникать различие в концентрации воды по обе стороны мембраны точно так же, как и различия в концентрации для других веществ.
Когда это случается, через клеточную мембрану действительно происходит направленное движение воды, приводящее к набуханию или сморщиванию клетки, в зависимости от направления этого движения. Этот процесс направленного движения воды, связанный с различием ее концентрации, называют осмосом.
Пример осмоса представлен на рисунке, где с одной стороны мембраны — чистая вода, а с другой — раствор хлорида натрия. Молекулы воды через клеточную мембрану проходят легко, тогда как ионы натрия и хлора — с трудом. Следовательно, раствор хлорида натрия фактически является смесью проникающих через мембрану молекул воды и не проникающих через нее ионов натрия и хлора. Про такую мембрану говорят, что она избирательно проницаема для воды, но гораздо менее проницаема для ионов натрия и хлора.
В то же время присутствие ионов натрия и хлора вытесняет часть молекул воды со стороны мембраны, где представлены эти ионы, и поэтому концентрация молекул воды здесь меньше, чем в чистой воде. В результате, больше молекул воды ударяются оканалы с левой стороны, чем с правой, где концентрация воды снижена. Так происходит общее движение воды слева направо, т.е. осуществляется осмос из чистой воды в раствор хлорида натрия.
Применение уравнения Нернста в решении задач.
При рассмотрении вопроса об окислительно-восстановительных реакциях часто возникает необходимость расчета электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций. В справочниках обычно приведены таблицы т.н. стандартных потенциалов тех или иных процессов, рассчитанных при р=1 атм, Т=298К и активностях участников равных 1. Однако в реальных задачах условия могут значительно отличаться от указанных выше. Как быть в таком случае? Ответ дает уравнение Нернста. В оригинальном виде оно выглядит так:
Как можно заметить, в уравнении фигурируют несколько постоянных величин. Также температура в подавляющем большинстве случаев равна 298К. Кроме того, можно заменить натуральный логарифм на десятичный. Это можно сделать путем умножения на коэффициент перевода. Если собрать все постоянные в единый множитель, то приходим к несколько иному, но более знакомому по учебным пособиям виду уравнения Нернста:
Такой вариант уравнения сильно облегчает жизнь в ряде случаев, например рассмотрении рН-зависимых процессов. Используя данное уравнение можно провести вычисления в любых условиях, приведенных в задаче. Рассмотрим характерные примеры задания по данной теме.
Пример 1:
Рассчитать ЭДС гальванического элемента, составленного из медной и цинковой пластин, погруженных в растворы 0.1М CuSO4 и 0.01М ZnSO4 соответственно. Коэффициенты активности ионов Cu 2+ и Zn 2+ принять равными единице.
Решение:
Для начала запишем уравнения протекающих процессов:
Далее находим по таблице стандартные потенциалы процессов:
Если в условиях задачи ничего не сказано про коэффициенты активности ионов, то можно считать их равными единице, как и в нашем случае. Тогда активности участников процессов можно принять равными их аналитическим концентрациям.
Найдем реальные потенциалы с учетом нестандартных активностей ионов:
Далее необходимо сравнить полученные величины между собой, чтобы определить, кто из участников процесса – окислитель. Потенциал меди больше, чем у цинка, поэтому она будет окислителем. Тогда найдем ЭДС системы:
Ответ: 1.13 В
Пример 2:
Одним из лабораторных способов получения хлора является действие KMnO4 на концентрированную соляную кислоту. Можно ли провести процесс при рН=4?
Решение:
Для начала запишем уравнения протекающих процессов.
Далее находим по таблице стандартные потенциалы процессов:
Несложно заметить, что от рН в данном случае зависит только потенциал перманганата. Тогда воспользуемся уравнением Нернста и рассчитаем его реальный потенциал в условиях задачи:
Получается, что потенциал KMnO4 стал меньше, чем у хлора, а значит, реакция не пойдет.
Природа и значение потенциала покоя клеток. Уравнение Нернста.
Методы исследования в нейрофизиологии.
Модели на животных (моллюски имеют очень крупные нейроны и аксоны, до 1 мм в диаметре);
Микроэлектродная техника (металлические (вольфрамовые) электроды, стеклянные электроды);
Метод фиксации потенциала;
Метод изучения последствий локальных поражений структур головного мозга;
Томографические методы (компьютерная томография (КТ), магнитно-резонансная томография (МРТ), позитронно-эмиссионная томография (ПЭТ));
Электрофизиологические методы (электроэнцефалография (ЭЭГ), вызванные потенциалы (ВП)).
Структурно-функциональные особенности клеточной мембраны. Роль белков, липидов и углеводов.
Большая часть массы приходится на долю белков и липидов. В мембранах выявлены компоненты, как нуклеиновые кислоты, полиамины и неорганические ионы, а также связанная вода. Соотношение основных структурных компонентов — белков и липидов — значительно колеблется в зависимости от вида мембраны. Так, в мембранах митохондрии массовая доля белка составляет 60 — 65%, а липидов — 35 — 40%. В миелиновой оболочке нерва содержится всего 20 — 40% белка, остальные 60 — 80% составляют липиды. Образование мембранных структур представляет собой динамический процесс усложнения числа монослоев липидов в мембране. Бислой — мембрана, состоящая из двух слоев молекул липида, — биологическая мембрана. Асимметрия и симметрия биологической мембраны: Симметрия – белки (трансмембранные протеины – каналы и ферменты), липиды (липидный бислой и холестерин). Асимметрия – белки (белковая часть гликопротеинов, второстепенные протеины и рецепторы), углеводы (углеводные части гликолипидов и гликопротеинов). Функции мембраны: барьерная (защитная), восприятие изменений внутренней среды (рецепторы), создание электрического заряда клетки, передача сигналов от клетки к клетке (синапсы), транспортная (электрический и концентрационный градиенты). Белки в мембране: рецепторы гормонов и нейромедиаторов (снаружи), ферменты (внутри), каналы (пронизывающие). Фосфолипиды (глицерин + два углеводородных хвоста + фосфорная к-та): в водном растворе образуют капли и двуслойные пленки — основу всех биологических мембран (строительная функция + энерге-
тическая и запасающая).
Биохимические особенности нервной ткани.
Белковый и аминокислотный состав (синтез белка, нейроспецифические белки)
Липидный состав (биол. мембрана, миелиновая оболочка, синтез гормонов)
Углеводы (энергия, синтез биологически активных соединений)
Потребление кислорода (по массе мозг – 2%, по потреблению кислорода – 25%)
Генетический материал (РНК, ДНК, активность генов)
Функции нейроглии и гематоэнцефалический барьер.
Нейроглия: астроциты, олигодендроциты, микроглия (фагоциты), эпендима. Участвуют в гематоэнцефалическом барьере (связывание с сосудом — астроциты) и образовывают миелиновые оболочки аксонов (олигодендроциты). Гематоэнцефалический барьер создает выборочную проницаемость клетки. В понятие гематоэнцефалического барьера входят все виды транспорта. Постоянно открытый белок-канал: встроен в мембрану клетки; диффузия (по градиенту концентрации), как правило, мелких частиц (молекул воды, ионов калия и др.). Белок-канал со створкой: встроен в мембрану клетки; отверстие перекрыто петлей-створкой; открывается при определенных условиях (электрическое или химическое воздействие). Натрий-калиевый насос: работа против градиента концентрации с затратой энергии АТФ.
Ионный состав внутреклеточной среды и межклеточного вещества и мембранный потенциал.
Внутриклеточная среда Внеклеточная среда
Ca2+ В основном в связанном виде
(Aминокислоты)- много мало
Клетка заряжена отрицательно по сравнению с внеклеточной средой. Заряд создают преимущественно анионы крупных белковых молекул. Мембранный потенциал – разность зарядов между наружной и внутренней сторонами мембраны клетки.
Природа и значение потенциала покоя клеток. Уравнение Нернста.
Потенциал покоя – мембранный потенциал возбудимой клетки в состоянии покоя. Мембранный потенциал – разность зарядов между наружной и внутренней сторонами мембраны клетки.
Ex – равновесный потенциал для иона х
R – газовая постоянная (8,31 Дж/м К)
T – абсолютная температура, Кельвин (+273°С),
F – число Фарадея (96500 Кл/моль)
Z – валентность иона
ПП есть у всех живых клеток и находится в пределах [-100;-50] мВ. Зависит от: диффузии K+ из клетки, диффузии Na+ в клетку, работы Na+/K+-АТФазы.
Первопричина ПП – разность концентраций ионов K+ и Na+ внутри и снаружи нейрона. Эту разность создает работа Na+-К+-насоса. Наличие ПП – результат жизнедеятельности нейрона, совместного функционирования всех биополимеров и органоидов клетки. Расчет ПП по уравнению Нернста: расчет равновесного ионного потенциала калия.
http://scienceforyou.ru/jelektrohimija/uravnenie-nernsta
http://megapredmet.ru/1-14693.html