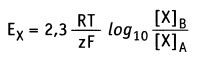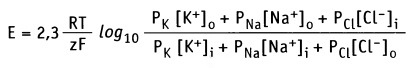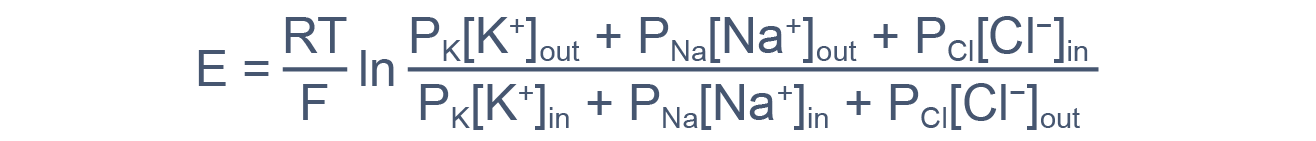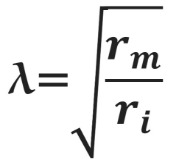Уравнение нернста позволяет определить мембранный потенциал
• Мембранный потенциал возникает за счет электрохимического градиента, который существует по обеим сторонам мембраны, селективно проницаемой для ионов
• Величина мембранного потенциала как функции концентрации ионов рассчитывается по уравнению Нернста
• В клетке поддерживается отрицательное значение мембранного потенциала покоя. При этом внутренняя среда клетки, по сравнению с внешней, характеризуется несколько большим отрицательным зарядом
• Существование мембранного потенциала является необходимым условием генерации электрических сигналов, а также направленного транспорта ионов через мембрану
Важным свойством клеток является способность поддерживать такие внутриклеточные концентрации метаболитов, которые существенно отличаются от их содержания во внеклеточной среде. В случае ионов, различия в их концентрации по обеим сторонам мембраны приводят к различиям в электрическом заряде: внутриклеточная среда заряжена несколько более отрицательно, чем среда снаружи клетки. Совместное действие разности зарядов и концентраций проводит к возникновению электрохимического градиента. Электрохимический градиент поддерживается за счет действия селективных каналов и белков переносчиков в плазматической мембране.
Для того чтобы понять, каким образом возникает электрохимический градиент, вначале рассмотрим простой случай, когда мембрана оказывается проницаемой только для одного вида ионов. На рисунке ниже представлены два компартмента, А и В, разделенные тонкой мембраной. Эти компартменты содержат раствор КС1 разной концентрации. В растворе хлорид калия диссоциирован на гидратированные ионы К+ и Cl-. Поскольку оба компартмента содержат эквимолярные концентрации ионов, то каждый обладает нейтральным зарядом.
Если бы мембрана была непроницаема для ионов, то величина ее электрического потенциала, измеренная с помощью вольтметра, равнялась бы нулю.
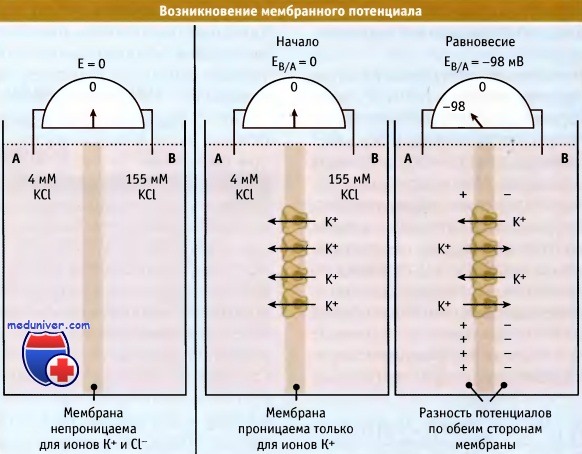
Теперь рассмотрим случай, когда мембрана проницаема только для ионов калия (например, когда в мембране находятся К+-каналы). Диффузия растворенных веществ по градиенту концентрации является энергетически выгодным процессом (выражается в виде отрицательной величины разности энергии AG). Поэтому ионы К+ будут диффундировать в сторону более низкой их концентрации, т. е. из компартмента В в компартмент А. При этом распределение заряда на мембране будет меняться. По мере накопления в компартменте А положительно заряженных ионов, возрастают силы отталкивания между ними. Эти силы затрудняют переход ионов К+ в компартмент А.
Когда в системе достигается электрохимическое равновесие, градиенты концентрации и электрических зарядов взаимно уравновешиваются, и движение ионов К+ через мембрану прекращается. При этом транспорт ионов К+ из одного компартмента сдерживается их транспортом из другого компартмента.
Однако в компартменте А содержится больше положительно заряженных ионов, чем в компартменте В. Этот избыток ионов К+ (в компартменте А) взаимодействует с избытком ионов Cl- (в компартменте В) через тонкую мембрану, в результате чего по обеим ее сторонам выстраиваются электрические заряды. Разница зарядов по обеим сторонам мембраны выражается в виде разности потенциалов и называется мембранный потенциал. Равновесный (мембранный) потенциал компартмента В по отношению к компартменту А имеет отрицательное значение.
Этот пример иллюстрирует необходимость наличия двух условий, необходимых для возникновения мембранного потенциала клетки, не равного нулю:
• различные концентрации ионов по обеим сторонам мембраны, которые приводят к разделению зарядов и
• мембрана, обладающая селективной проницаемостью по крайней мере к одному виду ионов.
Поэтому величина мембранного потенциала является функцией концентрации ионов. В состоянии равновесия эту функцию для ионов X можно выразить количественно с помощью уравнения Нернста:
• Е — равновесный потенциал (в вольтах)
• R — универсальная газовая постоянная (2 кал моль -1 К -1 )
• Т — абсолютная температура (К; 37 °С = 307,5 К)
• z — валентность ионов (электрический заряд)
• F — число Фарадея (2,3 х 10 4 кал вольт -1 моль -1 )
• [Х]А — концентрация свободных ионов X в компартменте А
• [Х]в — концентрация свободных ионов X в компартменте В
В формировании мембранного потенциала в клетках животных, главным образом, участвуют ионы К+, Na+ и Cl-. Ионы Са2+ и Mg2+ в меньшей степени участвуют в формировании мембранного потенциала покоя. Плазматическая мембрана обладает селективной проницаемостью к перечисленным ионам (т. е. мембрана содержит ионные каналы, селективные к каждому типу ионов). Это обстоятельство, а также мембранная проницаемость (Р) для каждого иона учитывается в уравнении Гольдмана-Ходжкина-Каца, которое представляет собой расширенную форму уравнения Нернста.
Для основных ионов это уравнение выражает мембранный потенциал как функцию их проницаемости и концентрации внутри (i) и снаружи (о) клетки:
Величина отрицательного мембранного потенциала покоя зависит от типа клеток и колеблется от -200 мВ до -20 мВ. В клетках млекопитающих мембранный потенциал покоя в основном создается при работе К+-каналов и ионного насоса, который называется Na+/К+-АТФаза. Основной вклад в формирование отрицательного мембранного потенциала вносит небольшой поток ионов К+ через плазматическую мембрану. Этот поток осуществляется через К+-каналы, лишенные воротного механизма (т. н. калиевые каналы покоя).
В отличие от большинства других К+-каналов, которым необходим сигнал для открытия, эти каналы в клетке, обладающей определенным потенциалом покоя, открыты постоянно. В покоящейся клетке также открыты несколько каналов для других ионов. Движение ионов К+ из клетки, по направлению электрохимического градиента, помогает клеточному содержимому поддерживать отрицательный заряд. Пока мы не знаем всех источников ионов калия, которые участвуют в этом процессе. В некоторых клетках, например у растений и бактерий, а также в митохондриях, мембранный потенциал покоя создается за счет градиента протонов, а не ионов К+.
Для того чтобы происходила диффузия ионов К+ из клетки через К+-каналы, их концентрация в клетке должна быть выше, чем в окружающей среде. Градиент концентрации создается в результате работы Na+/К+-АТФа-зы, которая закачивает в клетку два иона калия на каждые три иона натрия, которые этот ионный насос удаляет из клетки. Поэтому насос функционирует как генератор заряда: удаляется больше электрических зарядов, чем привносится к клетку. Таким образом, наряду с K+-каналами, лишенными воротного механизма, Na+/К+-АТФазы участвуют в создании отрицательного внутриклеточного потенциала. Если происходит инактивация Na+/K+-АТФаз, то концентрации ионов Na+ и К+ по обе стороны мембраны уравниваются. Это происходит потому, что липидный бислой очень плохо пропускает ионы. Иными словами, без прохождения первичных процессов активного транспорта с участием Na+/К+-АТФаз значение мембранного потенциала равнялось бы нулю.
Мембранный потенциал покоящейся клетки представляет собой довольно постоянную величину. Однако при связывании лигандов, механическом стрессе или при изменении электрического заряда происходит открытие специфических ионных каналов, и мембранный потенциал изменяется. Если ионные каналы находятся под контролем электрического заряда, то изменения мембранного потенциала влияют на прохождение через них ионов. Открытие и закрытие канала контролируются воротным механизмом (гейтингом). Мембранный потенциал зависит от тех ионов, для которых каналы в основном, открыты. Например, при открытии Na+- или Са2+-каналов происходит деполяризация мембраны.
При этом соответствующие ионы начинают поступать в клетку в направлении их электрохимического градиента. Это приводит к тому, что мембранный потенциал становится более положительным. Напротив, при реполяризации мембраны (гиперполяризации) потенциал становится еще более отрицательным. Это происходит при открытии калиевых каналов и выходе из клетки ионов К+ в направлении градиента, что и влечет за собой увеличение отрицательного мембранного потенциала. Движение ионов по ионным каналам происходит быстро и исчисляется миллисекундами. Для изменения мембранного потенциала достаточны лишь незначительные различия в концентрации ионов по сторонам мембраны, и основная концентрация их в клетке не меняется.
Поток лишь 10 -12 моль К+ через 1 см2 мембраны приводит к ее быстрой гиперполяризации и к установлению мембранного потенциала, равного -100 мВ. Локальное передвижение относительно небольших зарядов через мембрану позволяет цитозолю и внеклеточной среде оставаться электрически нейтральными и сводит к минимуму электрическое отталкивание зарядов.
С энергетической точки зрения, мембранный потенциал представляет собой некий энергетический резервуар, энергию которого можно использовать для выполнения определенной работы. По расположению отрицательно заряженных ионов в цитозоле и положительно заряженных на наружной стороне мембраны, клетка напоминает электрический конденсатор или батарею, т. е. приспособление, способное сохранять электрическую энергию и служить ее источником. Энергия высвобождается в виде ионов, мигрирующих по направлению их электрохимического градиента, и может использоваться в процессах транспорта других ионов или метаболитов против градиента концентрации.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
БИОЛОГИЧЕСКИЙ ОТДЕЛ ЦЕНТРА ПЕДАГОГИЧЕСКОГО МАСТЕРСТВА
Потенциал покоя и потенциал действия
Автор статьи Зыбина А.М.
Мембрана всех живых клеток поляризована. Внутренняя сторона мембраны несет отрицательный заряд по сравнению с межклеточным пространством (рис. 1). Величина заряда, который несет мембрана называется мембранным потенциалом (МП). В невозбудимых тканях МП низкий, и составляет около -40 мВ. В возбудимых тканях он высокий, около -60 — -100 мВ и называется потенциалом покоя (ПП).
Потенциал покоя, как и любой мембранный потенциал формируется за счет избирательной проницаемости клеточной мембраны. Как известно, плазмолемма состоит из липидного бислоя, через который движение заряженных молекул затруднено. Белки, встроенные в мембрану, могут избирательно изменять проницаемость мембраны для различных ионов, в зависимости от приходящих стимулов. При этом, для формирования потенциала покоя ведущую роль играют ионы калия, кроме них важны ионы натрия и хлора.
Рис. 1. Концентрации и распределение ионов с внутренней и внешней стороны мембраны.
Большинство ионов распределяются неравномерно с внутренней и внешней стороны клетки (рис. 1). Внутри клетки концентрация ионов калия выше, а натрия и хлора – ниже, чем снаружи. В состоянии покоя мембрана проницаема для ионов калия и практически непроницаема для ионов натрия и хлора. Несмотря на то, что калий может свободно выходить из клетки, его концентрации остаются неизменными благодаря отрицательному заряду на внутренней стороне мембраны. Таким образом, на калий действуют две силы, находящиеся в равновесии: осмотические (градиент концентрации К + ) и электрические (заряд мембраны), благодаря чему число входящих в клетку ионов калия равно выходящим. Движение калия осуществляется через калиевые каналы утечки, открытые в состоянии покоя. Величину заряда мембраны, при которой ионы калия находятся в равновесии можно вычислить по уравнению Нернста:
где Ек — равновесный потенциал для К + ; R — газовая постоянная; Т — абсолютная температура; F — число Фарадея; n — валентность К + (+1), [К + н] — [К + вн] — наружная и внутренняя концентрации К + .
Если подставить в уравнение значения из таблицы на рис. 43, то мы получим величину равновесного потенциала, равную примерно -95 мВ. Это значение вписывается в диапазон мембранного потенциала возбудимых клеток. Отличия ПП разных клеток (даже возбудимых) могут возникать по трем причинам:
- отличия внутриклеточной и внеклеточной концентраций ионов калия в разных тканях (в таблице приведены данные по среднестатистическому нейрону);
- натрий-калиевая АТФаза может вносить свой вклад в значение заряда, так как она выводит из клетки 3 Na + в обмен на 2 К + ;
- несмотря на минимальную проницаемость мембраны для натрия и хлора, эти ионы все-таки могут попадать в клетки, хоть и от 10 до 100 раз хуже, по сравнению с калием.
Чтобы учесть проникновение других ионов в клетку существует уравнение Нернста-Гольдмана:
, где Еm — мембранный потенциал; R — газовая постоянная; Т — абсолютная температура; F — число Фарадея; РK , PNa и РCl — константы проницаемости мембраны для К + Na + и Сl, соответственно; [К + н], [K + вн], [Na + н], [Na + вн], [Сl — н] и [Сl — вн ]- концентрации K + , Na + и Сl снаружи (н) и внутри (вн) клетки.
Такое уравнение позволяет установить более точную величину ПП. Обычно, мембрана оказывается на несколько мВ менее поляризована, по сравнению с равновесным потенциалом для К + .
Потенциал действия (ПД) может возникать в возбудимых клетках. Если на нерв или мышцу нанести раздражение выше порога возбуждения, то ПП нерва или мышцы быстро уменьшится и на короткий промежуток времени (миллисекунда) произойдет кратковременная перезарядка мембраны: ее внутренняя сторона станет заряженной положительно относительно наружной, после чего восстановится ПП. Это кратковременное изменение ПП, происходящее при возбуждении клетки называется потенциалом действия.
Возникновение ПД возможно благодаря тому, что в отличие от ионов калия, ионы натрия далеки от равновесия. Если подставить в уравнение Нернста натрий вместо калия, то мы получим равновесный потенциал, равный примерно +60 мВ. Во время ПД, происходит кратковременное увеличение проницаемости для Na + . При этом, натрий начнет проникать в клетку под действием двух сил: по градиенту концентрации и по заряду мембраны, стремясь подстроить заряд мембраны под свой равновесный потенциал. Движение натрия осуществляется по потенциал-зависимым натриевым каналам, которые открываются в ответ на смещение мембранного потенциала, после чего сами инактивируются.
Рис. 2. Потенциал действия нервного волокна (А) и изменение проводимости мембраны для ионов натрия и калия (Б).
На записи ПД выглядит как кратковременный пик (рис. 44), имеющий несколько фаз.
- Деполяризация (фаза нарастания) (рис. 44) – увеличение проницаемости для натрия из-за открытия натриевых каналов. Натрий стремится к своему равновесному потенциалу, но не достигает его, так как канал успевает инактивироваться.
- Реполяризация – возвращение заряда к величине потенциала покоя. Помимо калиевых каналов утечки здесь подключаются потенциал-зависимые калиевые каналы (активируются от деполяризации). В это время калий выходит из клетки, возвращаясь к своему равновесному потенциалу.
- Гиперполяризация (не всегда) – возникает в случаях, если равновесный потенциал по калию превышает по модулю ПП. Возвращение к ПП происходит после возвращения к равновесному потенциалу по К + .
Во время ПД происходит изменение полярности заряда мембраны. Фаза ПД, при которой заряд мембраны положителен, называется овершутом (рис. 2).
Для генерации ПД оказывается очень важной система активации и инактивации потенциал-управляемых натриевых каналов (рис. 3). Эти каналы имеют две створки: активационную (М-ворота) и инактивационную (Н-ворота). В состоянии покоя М-ворота открыты, а Н-ворота закрыты. Во время деполяризации мембраны М-ворота быстро открываются, а Н-ворота начинают закрываться. Ток натрия в клетку возможен пока М-ворота уже открыты, а Н-ворота еще не закрылись. Вход натрия приводит к дальнейшей деполяризации клетки, приводя к открытию большего количества каналов и запуская цепочку положительной обратной связи. Деполяризация мембраны будет продолжаться до тех пор, пока все потенциал-управляемые натриевые каналы не окажутся инактивированными, что происходит на пике ПД. Минимальная величина стимула, приводящая к возникновению ПД называется пороговой. Таким образом, возникший ПД будет подчиняться закону «все или ничего» и его величина не будет зависеть от величины стимула, вызвавшего ПД.
Благодаря Н-воротам инактивация канала происходит раньше, чем потенциал на мембране достигнет равновесной величины по натрию. После прекращения поступления натрия в клетку, происходит реполяризация за счет выходящих из клетки ионов калия. При этом к каналам утечки в этом случае подключаются еще и потениал-активируемые калиевые каналы. Во время реполяризации, в быстром натриевом канале быстро закрываются М-ворота. Н-ворота открываются гораздо медленнее и остаются закрытыми еще некоторое время после возвращения заряда к потенциалу покоя. Этот период принято называть периодом рефрактерности.
Рис. 3. Работа потенциал-управляемого натриевого канала.
Концентрации ионов внутри клетки восстанавливает натрий-калиевая АТФаза, которая с затратой энергии в виде АТФ откачивает из клетки 3 иона натрия и закачивает 2 иона калия.
По немиелинизированному волокну или по мембране мышцы потенциал действия распространяется непрерывно. Возникший потенциал действия за счет электрического поля способен деполяризовать мембрану соседнего участка до порогового значения, в результате чего на соседнем участке возникает деполяризация. Главную роль в возникновении потенциала на новом участке мембраны предыдущий участок. При этом на каждом участки сразу после ПД наступает период рефрактерности, за счет которое ПД распространяется однонаправленно. При прочих равных условиях распространение потенциала действия по немиелинизированному аксону происходит тем быстрее, чем больше диаметр волокна. У млекопитающих скорость составляет 1-4 м/с. Поскольку у беспозвоночных животных отсутствует миелин, в гигантских аксонах кальмара скорость ПД может достигать 100 м/c.
По миелинизированному волокну потенциал действия распространяется скачкообразно (сальтаторное проведение). Для миелинизированных волокон характерна концентрация потенциалзависимых ионных каналов только в областях перехватов Ранвье; здесь их плотность в 100 раз больше, чем в мембранах немиелинизированных волокон. В области миелиновых муфт потенциалзависимых каналов почти нет. Потенциал действия, возникший в одном перехвате Ранвье, за счет электрического поля деполяризует мембрану соседних перехватов до порогового значения, что приводит к возникновению в них новых потенциалов действия, то есть возбуждение переходит скачкообразно, от одного перехвата к другому. В случае повреждения одного перехвата Ранвье потенциал действия возбуждает 2-й, 3-й, 4-й и даже 5-й, поскольку электроизоляция, создаваемая миелиновыми муфтами, уменьшает рассеивание электрического поля. Сальтаторное проведение увеличивает скорость проведения ПД 15-20 раз до 120 м/с.
Работа нейронов
Нервная система состоит из нейронов и глиальных клеток. Однако, главную роль в проведении и передаче нервных импульсов играют нейроны. Они получают информацию от множества клеток по дендритам, анализируют ее и передают или не передают на следующий нейрон.
Передача нервного импульса с одной клетки на другую осуществляется с помощью синапсов. Различают два основных типа синапсов: электрические и химические (рис. 4). Задача любого синапса – передать информацию с пресинаптической мембраны (мембрана аксона) на постсинаптическую (мембрана дендрита, другого аксона, мышцы или другого органа-мишени). Большинство синапсов нервной системы образуется между окончанием аксонов и дендритами, которые в области синапса образуют дендритные шипики.
Преимущество электрического синапса состоит в том, что сигнал с одной клетки на другую переходит без задержки. Кроме того, такие синапсы не утомляются. Для этого пре- и постсинаптические мембраны соединены поперечными мостиками, через которые ионы из одной клетки могут перемещаться в другую. Однако, существенным минусом такой системы является отсутствие однонаправленной передачи ПД. То есть, он может передаваться как с пресинаптической мембраны на постсинаптическую, так и наоборот. Поэтому, такая конструкция встречается достаточно редко и в основном – в нервной системе беспозвоночных.
Рис. 4. Схема строения химического и электрического синапсов.
Химический синапс весьма распространен в природе. О устроен сложнее, так как необходима система преобразования электрического импульса в химический сигнал, затем, вновь в электрический импульс. Все это приводит к возникновению синаптической задержки, которая может составить 0,2-0,4 мс. Кроме того, может произойти истощение запасов химического вещества, что приведет к утомлению синапса. Однако, такой синапс обеспечивает однонаправленность передачи ПД, что является его главным преимуществом.
Рис. 5. Схема работы (а) и электронная микрофотография (б) химического синапса.
В состоянии покоя окончание аксона, или пресинаптическое окончание, содержит мембранные пузырьки (везикулы) с нейромедиатором. Поверхность везикул заряжена отрицательно, чтобы предотвратить связывание с мембраной, и покрыта специальными белками, и принимающими участие в высвобождении везикул. В каждом пузырьке находится одинаковое количество химического вещества, которое называется квантом нейромедиатора. Нейромедиаторы весьма разнообразны по химическому строению, однако, большинство из них производятся прямо в окончании. Поэтому, в нем могут находиться системы, для синтеза химического посредника, а также аппарат Гольджи и митохондрии.
Постсинаптическая мембрана содержит рецепторы к нейромедиатору. Рецепторы могут быть в виде как ионных каналов, открывающихся при контакте со своим лигандом (ионотропные), так и мембранными белками, запускающими внутриклеточный каскад реакций (метаботропные). Один нейромедиатор может иметь несколько как ионотропных, так и метаботропных рецепторов. При этом, часть из них может быть возбуждающими, а часть – тормозными. Таким образом, реакцию клетки на нейромедиатор будет определять тип рецептора на ее мембране, и разные клетки могут совершенно по-разному реагировать на одно и то же химическое вещество.
Между пре- и постсинаптической мембраной располагается синаптическая щель, шириной 10-15 нм.
При приходе ПД на пресинаптическое окончание, на нем открываются потенциал-активируемые кальциевые каналы и ионы кальция входят в клетку. Кальций связывается с белками на поверхности везикул, что приводит к их транспортировке к пресинаптической мембране с последующим слиянием мембран. После такого взаимодействия нейромедиатор оказывается в синаптической щели (рис. 5) и может связаться со своим рецептором.
Ионотропные рецепторы – это лиганд-активируемые ионные каналы. Это значит, что канал открывается только в присутствии определенного химического вещества. Для разных нейромедиаторов это могут быть натриевые, кальциевые или хлорные каналы. Ток натрия и кальция вызывает деполяризацию мембраны, поэтому такие рецепторы называют возбуждающими. Хлорный ток приводит к гиперполяризации, что затрудняет генерацию ПД. Следовательно, такие рецепторы называют тормозными.
Метаботропные рецепторы к нейромедиаторам относят к классу рецепторов, ассоцированных с G-белками (GPCR). Эти белки запускают разнообразные внутриклеточные каскады реакций, приводящих в конечном итоге либо к дальнейшей передачи возбуждения, либо к торможению.
После передачи сигнала необходимо быстро удалить нейромедиатор из синаптической щели. Для этого в щели присутствуют либо ферменты расщепляющие, нейромедиатор, либо на пресинаптическом окончании или соседних глиальных клетках могут располагаться транспортеры, закачивающие медиатор в клетки. В последнем случае он может использоваться повторно.
Каждый нейрон получает импульсы от 100 до 100 000 синапсов. Одиночная деполяризация на одном дендрите не приведет к дальнейшей передаче сигнала. На нейрон могут приходит одновременно множество как возбуждающих, так и тормозных стимулов. Все они суммируются на соме нейрона. Такая суммация называется пространственной. Далее, может возникнуть или не возникнуть (в зависимости от пришедших сигналов) ПД в области аксонного холмика. Аксонный холмик – это область аксона, примыкающая к соме и обладающая минимальным порогом ПД. Далее импульс распространяется по аксону, конец которого может сильно ветвиться и образовывать синапсы со множеством клеток. Помимо пространственной, существует временная суммация. Она происходит в случае, поступления часто повторяющихся импульсов от одного дендрита.
Помимо классических синапсов между аксонами и дендритами или их шипиками, существуют также синапсы, модулирующие передачу в других синапсах (рис. 6). К ним относят аксо-аксональные синапсы. Такие синапсы способны усиливать или тормозить синаптическую передачу. То есть, если на окончание аксона, образующего аксо-шипиковый синапс, пришел ПД, а в это время по аксо-аксональному синапсу на него пришел тормозный сигнал, высвобождения нейромедиатора в аксо-шипиковом синапсе не произойдет. Аксо-дендритные синапсы могут изменять проведение мембраной ПД на пути от шипика к соме клетки. Также существуют аксо-соматические синапсы, которые могут влиять на суммацию сигнала в области сомы нейрона.
Таким образом, существует огромное многообразие различных синапсов, отличающихся по составу нейромедиаторов, рецепторов и их местоположению. Все это обеспечивает разнообразие реакций и пластичность нервной системы.
Рис. 6. Разнообразие синапсов в нервной системе.
Мембранный потенциал
Химический состав живых клеток отличается от внешней среды, причем различия есть не только в сложных молекулах, таких как белки и нуклеиновые кислоты, но и в ионах. Например, во внеклеточной среде преобладают ионы натрия, а в клетке — ионы калия, причем последних на порядок больше. Сама по себе плазматическая мембрана клеток практически непроницаема для ионов, и поэтому для их переноса через мембрану существуют специальные транспортные механизмы — встроенные в мембрану белки. В геноме человека более 800 генов ионных каналов и транспортеров, а общую долю генов, вовлеченных в трансмембранный транспорт, оценивают в 10 % от всех генов, кодирующих белки [1] . В этой серии статей мы рассмотрим механизмы трансмембранного переноса ионов и разнообразие реализуемых ими клеточных функций. Мы также уделим внимание патологиям, вызванным мутациями в генах, кодирующих соответствующие каналы и транспортеры.
Потенциал покоя
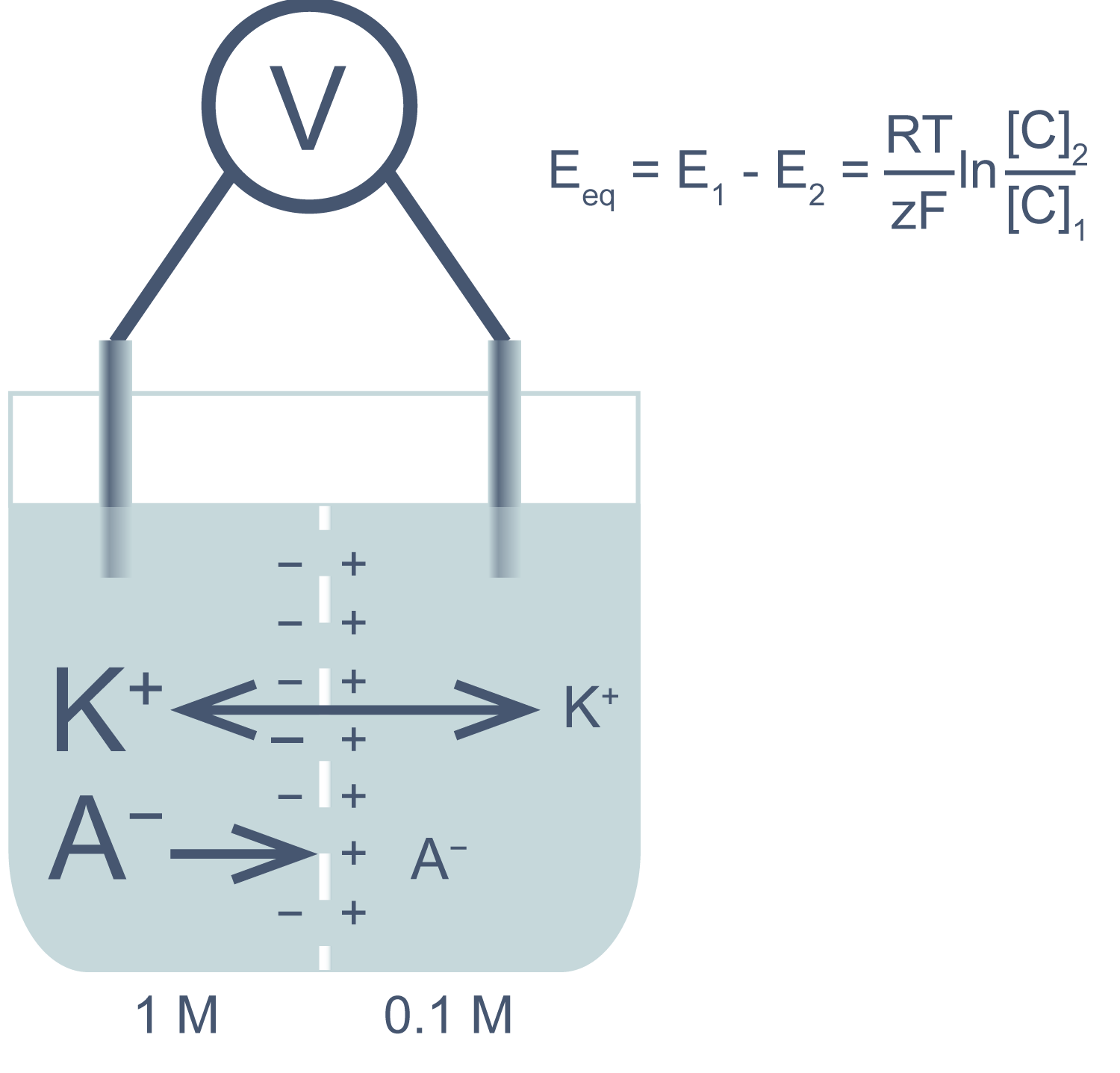
Представим себе электрохимическую ячейку — сосуд, разделенный пополам полупроницаемой мембраной, в левой части которого находится 1,0 М раствор KCl, а в правой — 0,1 М KCl. Через мембрану могут проходить катионы K + , но не анионы Cl − . Ионы K + в результате процесса диффузии будут переходить из левого отсека в правый по градиенту концентрации*, тогда как ионы Cl − , неспособные последовать за катионами, останутся в исходном отсеке. Благодаря такому разделению зарядов на мембране будет накапливаться электрохимический потенциал: избыток анионов с левой стороны мембраны и избыток катионов с правой. Этот потенциал можно измерить, опустив в отсеки электроды, подсоединенные к вольтметру.
Асимметричный поток катионов не будет продолжаться бесконечно: накопленный электрический потенциал (с избытком положительного заряда с левой стороны мембраны) будет противодействовать диффузии ионов калия в левый отсек. Через некоторое время поток ионов K + из правого отсека в левый сравняется по скорости с потоком из левого отсека в правый, и система достигнет равновесия. Для математического описания подобного равновесия применяют уравнение Нернста (рис. 1).
Рисунок 1 | Электрохимическая ячейка. V — вольтметр. Справа приведено уравнение Нернста, где Eeq — равновесный потенциал; E1 – E2 — разность потенциалов по обе стороны мембраны; R = 8,314 Дж/(моль·K) — универсальная газовая постоянная; T — абсолютная температура (в кельвинах); F = 96485,55 Кл·моль –1 — константа Фарадея; z — степень окисления иона (его заряд); [C]1, 2 — равновесные концентрации ионов по обе стороны мембраны.
Если принять, что равновесные концентрации ионов K + в нашем примере равны начальным, разность потенциала на мембране при 25 °C приблизительно равна –58 мВ.
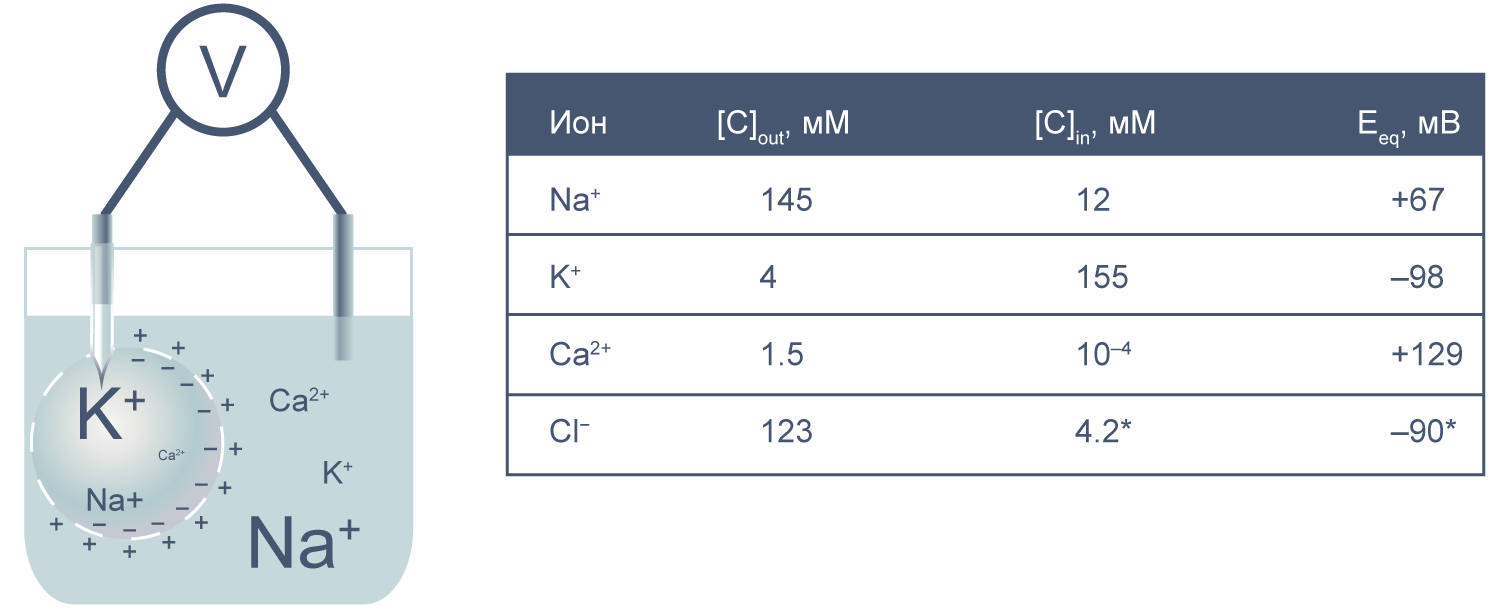
Рисунок 2 | Клетка как электрохимическая ячейка. Справа приведены концентрации основных ионов внутри и вне клетки [2] .
Теперь представим, что левая часть нашей электрохимической ячейки — это живая клетка, а правая — внешняя среда. Добавим к этой картине концентрации других физиологически значимых ионов. На мембране клетки также будет накапливаться электрохимический потенциал. Величину электрической составляющей мембранного потенциала измеряют относительно потенциала вне клетки, принимая его за ноль.
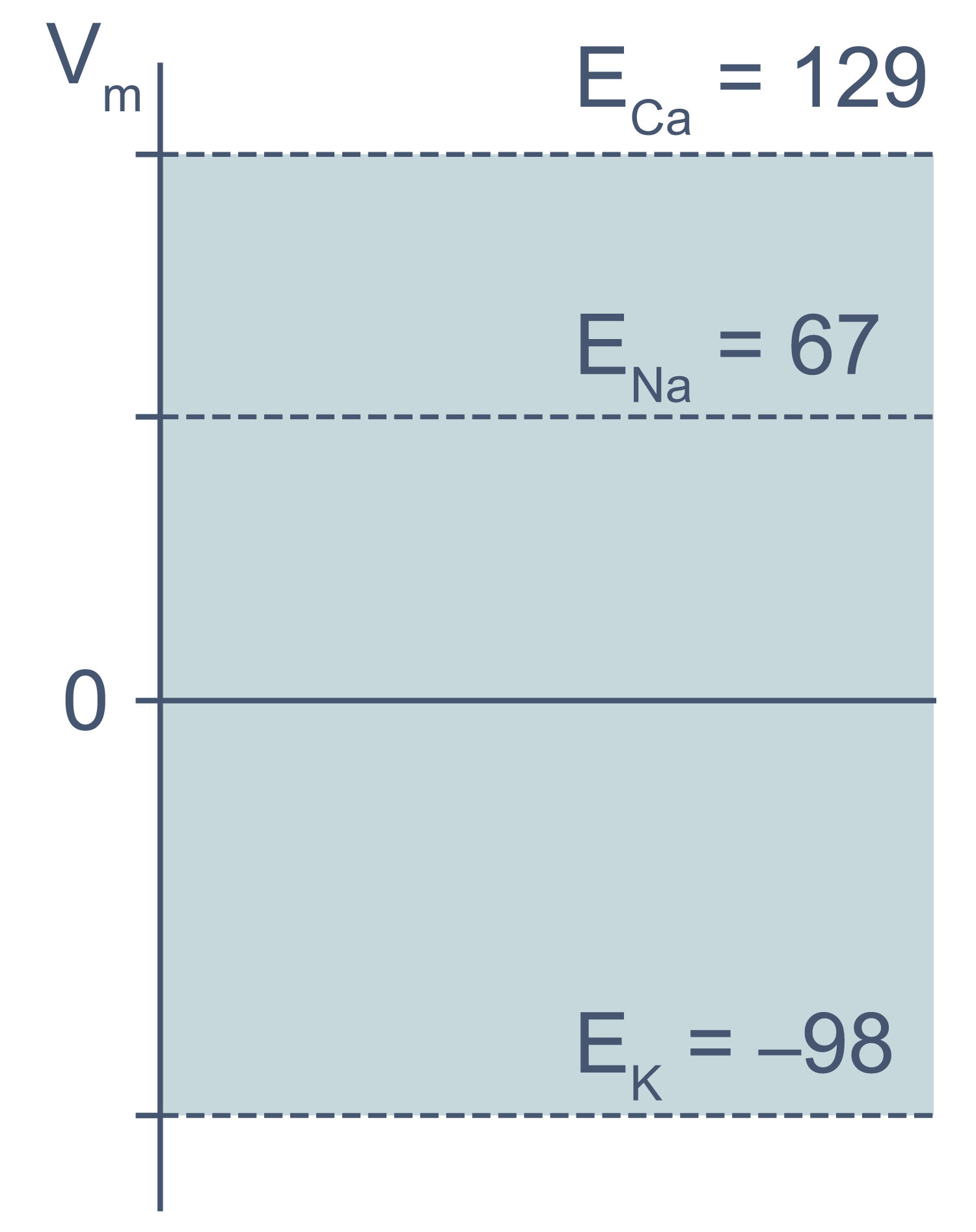
В первом приближении можно сказать, что мембрана клетки проницаема для калия и непроницаема для других катионов (Na + , Ca 2+ ) и анионов (в первую очередь для Cl – и отрицательно заряженных участков макромолекул). Ионы калия, выходя из клетки, создают потенциал покоя. Его величина достаточно близка к значению равновесного потенциала для K + , однако строго не равна ему, поскольку в реальности другие катионы и Cl – могут участвовать в формировании потенциала покоя в различных типах клеток. Вычислив равновесные потенциалы для основных ионов, мы получим динамический диапазон величины потенциала на мембране клетки: он не может быть более отрицательным, чем EK, и не может достигать более положительных значений на пике потенциала действия, чем ECa. Причина такого поведения кроется в том, что система стремится к равновесию, и при малейших отклонениях мембранного потенциала в сторону более отрицательных значений, чем EK, K + будет двигаться по электрохимическому градиенту внутрь клетки, возвращая мембранный потенциал к равновесному потенциалу для калия.
Рисунок 3 | Диапазон возможных значений мембранного потенциала от ЕK до ECa (показан голубым цветом).
Величина потенциала покоя зависит от типа клеток и равна около –30 мВ в невозбудимых клетках и около –80 мВ в возбудимых клетках (нейроны, мышечные и эндокринные клетки). Когда мембранный потенциал более отрицателен, чем потенциал покоя, говорят, что мембрана гиперполяризована, а когда он приближается к нулю или даже принимает положительные значения, говорят о деполяризации мембраны.
В общем случае мембранный потенциал можно вычислить согласно уравнению Гольдмана-Ходжкина-Катца, которое принимает в расчет все основные катионы и анионы:
где E — мембранный потенциал; R = 8,314 Дж/(моль·K) — универсальная газовая постоянная; T — абсолютная температура; F = 96485,55 Кл·моль –1 — константа Фарадея; PX — проницаемость мембраны для иона X; [C]in, out — равновесные концентрации ионов внутри и вне клетки. N.B.: для анионов внеклеточная концентрация стоит в знаменателе, а внутриклеточная — в числителе.
Что же обеспечивает проницаемость мембраны для ионов? Заряженные частицы не могут самостоятельно пересекать гидрофобный внутренний слой плазматической мембраны, и поэтому требуются специальные белки, образующие гидрофильную пору, через которую ионы могут двигаться через мембрану. Такие белки называются ионными каналами. Основной вклад в поддержание потенциала покоя вносят калиевые каналы семейств Kir (inward rectifying K + channels — калиевые каналы внутреннего выпрямления) и K2P (two—pore domain K + channels — калиевые каналы с двумя поровыми доменами, которые часто называют каналами утечки), а каналы других семейств могут обеспечивать быстрое изменение мембранного потенциала в возбудимых клетках. Каналы могут селективно пропускать определенный тип ионов, например, K + (как каналы семейства Kir), или более широкий спектр веществ, как, например, коннексины — белки щелевых контактов.
Каналы бывают потенциал-зависимые (потенциал-управляемые), лиганд-зависимые, термо- и механочувствительные — в зависимости от стимула, который управляет открытием и закрытием канала. В роли стимула, таким образом, могут выступать изменения мембранного потенциала, химические агенты, температура, свет, механические и другие стимулы. Один и тот же канал может открываться под действием различных эндо- и экзогенных стимулов. Так, канал TRPV1 активируется повышением температуры более 43 °C [3] , кислым pH [4] и разнообразными химическими веществами: капсаицином (алкалоид из перцев рода Capsicum) [3] , эндоканнабиноидом анандамидом [5] , окситоцином [6] и др.
Физиологическая роль каналов крайне важна. К примеру, мутации в генах, кодирующих белки ионных каналов, лежат в основе патогенеза многих заболеваний человека: некоторых видов эпилепсии [7] , муковисцидоза [8] , некоторых аритмий [9, 10] и др. Ионные каналы служат мишенями действия многих лекарств, ядов и токсинов.
Однако для формирования потенциала покоя недостаточно одних лишь каналов, ведь нужно создавать и поддерживать концентрационные градиенты на мембране. Основной механизм поддержания градиентов концентрации калия и натрия — это Na/K-АТФаза, фермент, за счет гидролиза одной молекулы АТФ переносящий три Na + наружу и два K + внутрь клетки. Она осуществляет электрогенный транспорт: в каждом транспортном цикле при переносе одного дополнительного положительного заряда наружу генерируется некоторая разность потенциалов на мембране. Чтобы оценить этот вклад Na/K-АТФазы в поддержание потенциала покоя, можно заблокировать работу фермента алкалоидом оубаином. Тогда мембрана деполяризуется примерно на 10 мВ [11] .
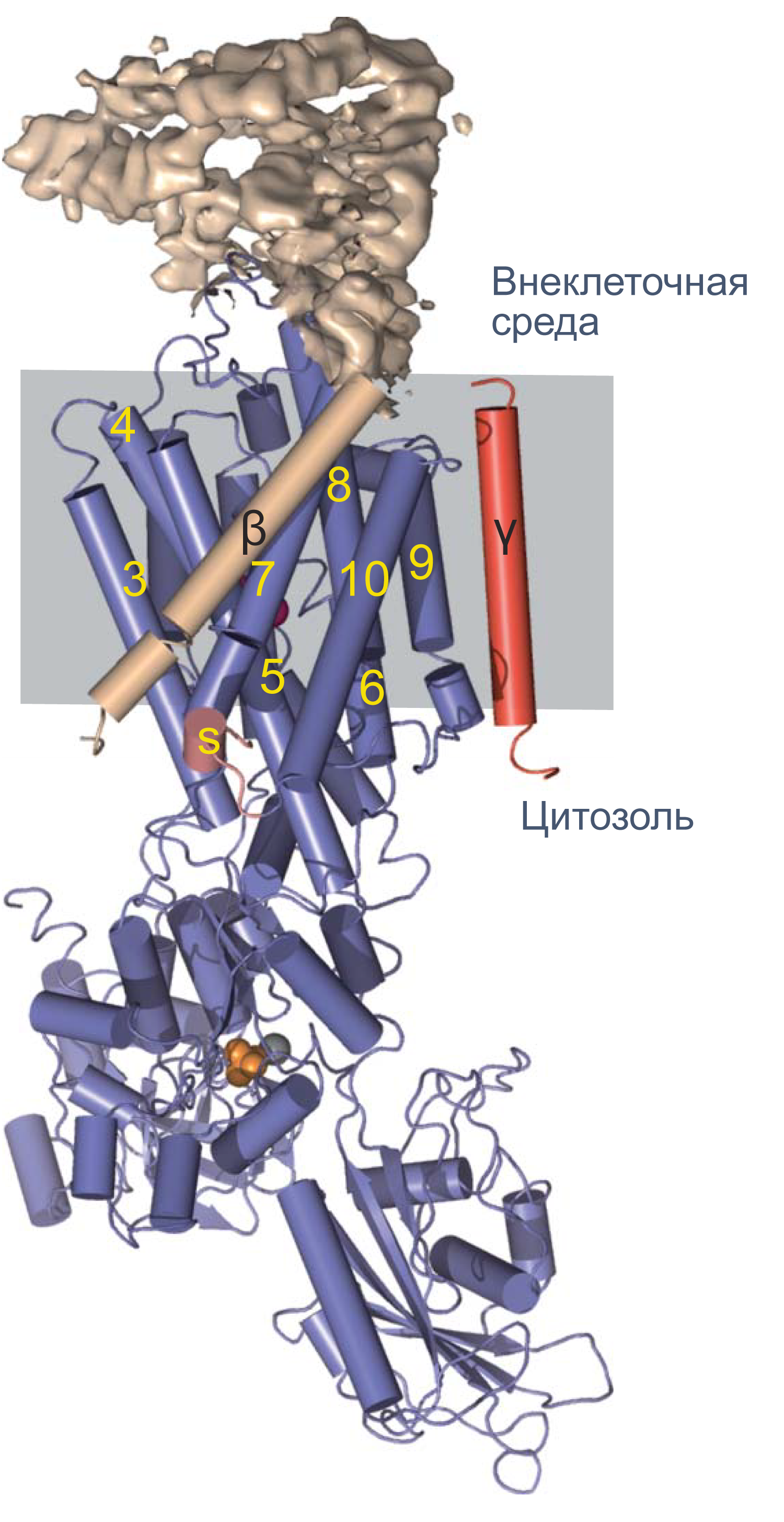
Рисунок 4 | Структура Na/K-АТФазы, полученная методом рентгеновской кристаллографии. Синим цветом показана α-субъединица, красным — γ-субъединица; β-субъединица показана бежевым цветом. Внеклеточная часть β-субъединицы показана в виде электронной плотности. Альфа-спирали изображены цилиндрами, бета-слои — плоскими стрелками [12] .
Активный и пассивный транспорт веществ через мембрану
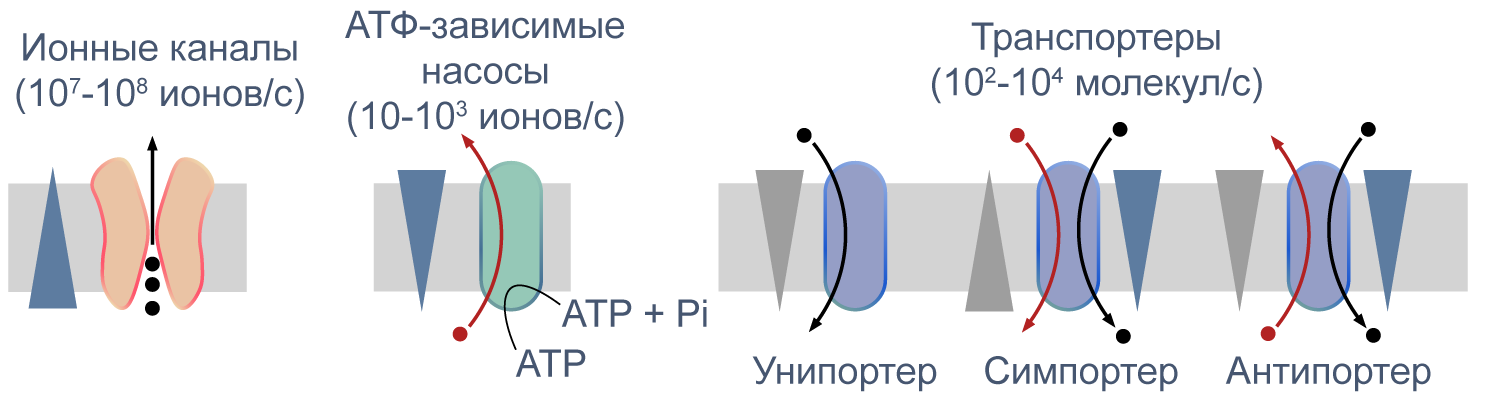
Процессы транспорта веществ через мембрану можно классифицировать по источнику энергии для транспорта. Пассивный транспорт — это движение вещества через канал или транспортер по градиенту концентрации*, то есть за счет энергии электрохимического градиента. Таким способом через калиевые каналы пассивно движутся ионы калия, или осуществляется перенос глюкозы через транспортер GLUT4 (такой тип транспорта еще называют облегченной диффузией, а транспортеры, переносящие только один субстрат — унипортерами). Кроме пассивного транспорта, существует активный транспорт, при котором субстраты переносятся против градиента концентрации с затратой энергии, запасенной клеткой в виде АТФ (например, Na/K-АТФаза).
Некоторые транспортеры сопрягают перенос ионов или молекул против градиента концентрации с движением ионов по градиенту концентрации. Симпортеры переносят различные частицы в одном направлении (например, KCC2 — K—Cl cotransporter 2 — K/Cl котранспортер 2), а антипортеры, или обменники, — в противоположных (например, NHE-1 — Na/H exchanger 1 — Na/H обменник, участвующий в поддержании клеточного pH). Такой транспорт называется вторично-активным.
Рисунок 5 | Пассивный и активный транспорт веществ через мембрану. Треугольниками показаны концентрационные градиенты. Черными стрелками показано движение по градиенту концентрации, красными — против градиента концентрации. По [13], с изменениями.
В старой литературе можно встретить концепцию «белков-переносчиков»: до открытия молекулярной идентичности многих каналов и транспортеров (т. е. какая молекула опосредует данный ионный ток и какой ген ее кодирует) существовало представление о переносчиках как о челноках, связывающих субстраты с одной стороны мембраны, диффундирующих через мембрану и высвобождающих субстраты с другой стороны. Однако, когда стали известны аминокислотные последовательности транспортных белков, стало понятно, что все они часто содержат многочисленные трансмембранные домены и образуют сквозной путь через мембрану.
Различия между каналами, транспортерами и насосами заключаются в механизме их работы и регуляции. Каналы представляют собой более или менее селективную пору, через которую ионы могут свободно диффундировать, не вызывая конформационных изменений в белке канала. При токе через отдельный канал в 1 пА по нему проходят 6×10 6 одновалентных ионов в секунду. Транспортер, связываясь с субстратом, изменяет свою конформацию для переноса субстрата. При ко-транспорте повышается аффинность транспортера в новой конформации к второму субстрату, и субстраты переносятся через мембрану сопряженно. Насосы, также называемые АТФазами, (ауто)фосфорилируются АТФ, и это фосфорилирование значительно изменяет их конформацию и приводит к транслокации субстратов через мембрану. Электрическая проводимость насосов очень мала: Na/K-АТФаза переносит всего около 300 Na + и 200 K + в секунду.
Граница между молекулами каналов и транспортеров не всегда строга. Например, семейство хлоридных каналов и транспортеров ClC (англ. Chloride Channel) включает в себя гомологичные друг другу каналы (ClC-1, 2, Ka и Kb) и Cl/H-обменники (ClC-3–7), которые можно превратить в каналы, внеся мутацию в единственный остаток глутамата (т. н. gating glutamate — воротный глутамат) [14]. Na/K-АТФазу также можно превратить в простую пору, например, с помощью палитоксина [15] . Хлоридный канал CFTR относится к группе ABC-транспортеров, однако он использует энергию АТФ не для транспорта ионов, а для регуляции открытия и закрытия канала [16] . Кроме того, существуют данные о том, что везикулярный транспортер глутамата VGLUT1 кроме обмена глутамата на протоны также опосредует не сопряженный с обменом ток Cl − [17] .
Клеточная мембрана как электрическая цепь
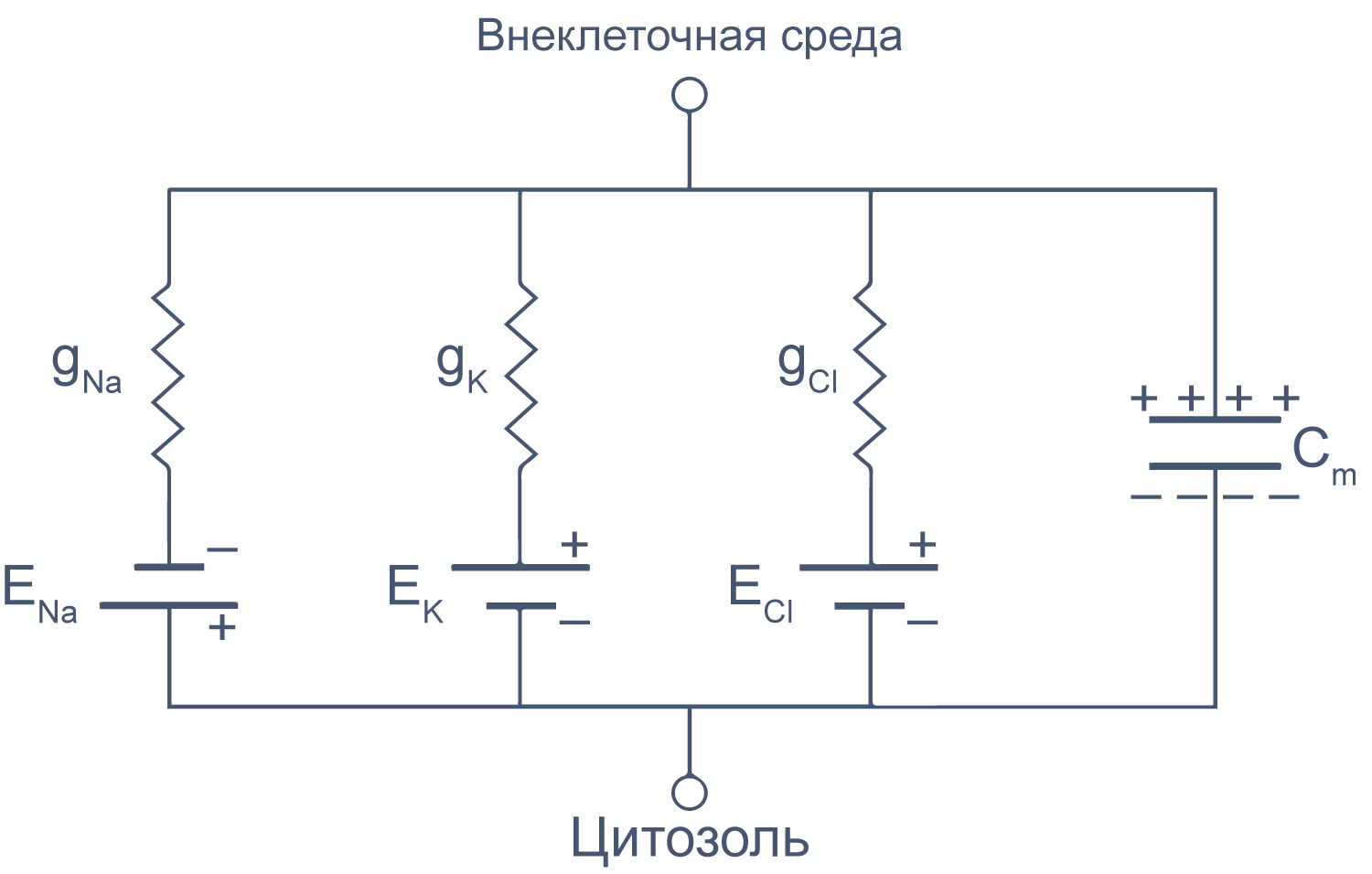
Липидный бислой мембраны можно представить как резистор (сопротивление) и конденсатор (емкость), соединенные параллельно. Величина сопротивления зависит от плотности каналов в мембране и их функционального состояния. Электроемкость возникает из-за разделения зарядов по обе стороны мембраны тонким слоем диэлектрика (гидрофобными хвостами фосфолипидов).
Рисунок 6 | Плазматическая мембрана, представленная в виде RC схемы. gNa, gK, gCl — проводимость** мембраны для ионов Na + , K + и Cl – , соответственно; ENa, EK, ECl — электродвижущая сила, или равновесные потенциалы для соответствующих ионов, Сm — электроемкость мембраны.
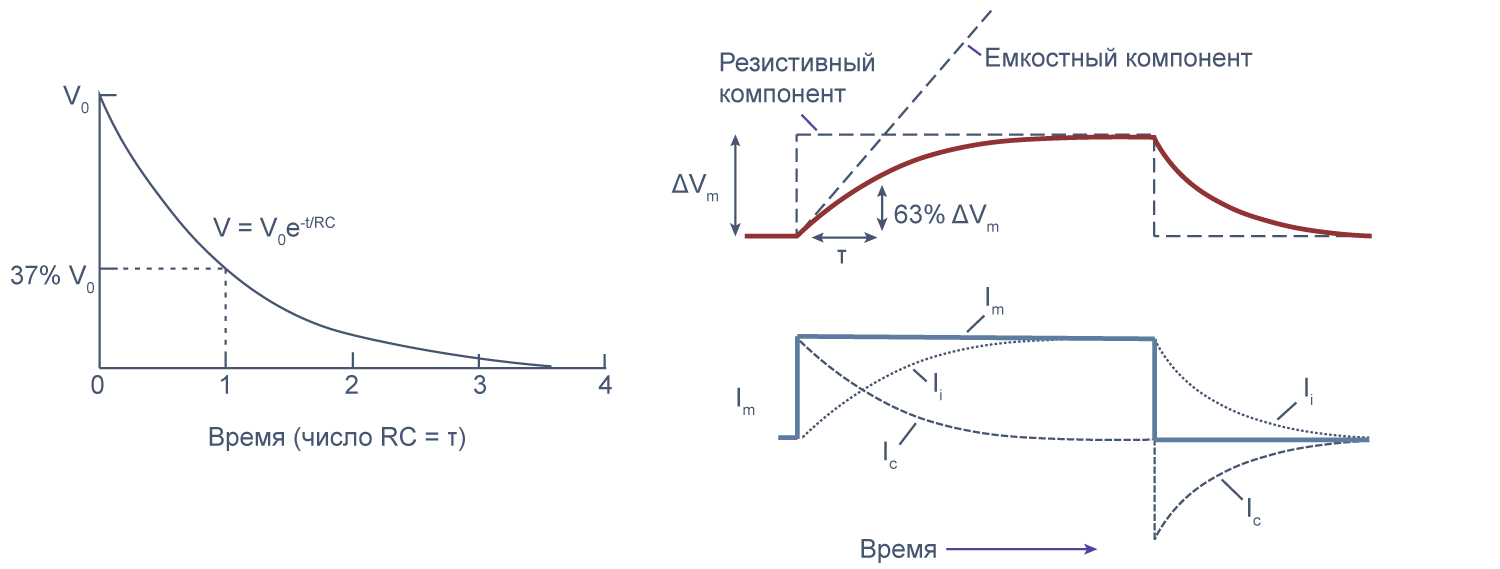
Можно считать, что проводимость (величина, обратная сопротивлению, измеряемая в сименсах) характеризует проницаемые для ионов компоненты структуры мембраны, а емкость — не проницаемые для ионов структуры. Удельная емкость мембраны составляет приблизительно 1 мкФ/см 2 или 0,01 пФ/мкм 2 *** и мало зависит от типа клеток [2] . Это позволяет оценить размер клетки по ее электрическим характеристикам. Высокая электроемкость клеточных мембран задерживает изменения потенциала в ответ на ток. Эту задержку можно выразить через постоянную времени τ, которая равна произведению емкости и параллельно соединенного с ней сопротивления (RC). Если конденсатор зарядить на некоторую величину, а затем дать ему разрядиться через резистор, то потенциал будет убывать экспоненциально согласно формуле V = V0e –t/RC , то есть за каждые τ = RC секунд потенциал будет падать в 1/e раз (на 37 % от исходной величины). Этот расчет применим и к клеточной мембране: падение напряжения при разрядке мембраны будет подчиняться экспоненциальному закону. То есть, если приложить гипер- или деполяризующий стимул, то мембранный потенциал через время τ достигнет 63 % конечного сдвига.
Рисунок 7 | Падение напряжения при разрядке мембраны. Изменение мембранного потенциала при деполяризации мембраны на ΔVm [22] , Ic — емкостный ток, Ii — ионный ток, Im — суммарный ток через мембрану. Пояснения в тексте.
Потенциал действия
Возбудимые клетки могут быстро изменять потенциал на мембране и этим запускать внутриклеточные процессы, например, мышечное сокращение или экзоцитоз везикул. Кратковременный локальный скачок мембранного потенциала от приблизительно –80 мВ (значения потенциала покоя) до 0…+20 мВ за счет изменения проницаемости мембраны для ионов называется потенциалом действия.
Для начала рассмотрим потенциал действия в аксонах нейрона на примере гигантского аксона кальмара. Выбор столь экзотического объекта обусловлен историческими причинами. Современная микроэлектродная техника — использование тонких стеклянных микропипеток, заполненных раствором электролита, — была предложена лишь в 1949 году Дж. Лингом и Р. Джерардом [18] . До этого поместить электрод, представлявший собой тонкую проволоку, внутрь клетки, не разрушив ее, можно было только в случае ее крупных размеров. Гигантский аксон кальмара стал идеальным модельным объектом для изучения потенциала действия: его диаметр может достигать 0,5–1 мм. Этот отросток служит для быстрой передачи нервных импульсов у беспозвоночных, у которых отсутствует миелинизация. Внутренним содержимым аксона легко манипулировать, заменяя ионный состав внутриклеточного раствора, а внутрь такого аксона можно поместить электрод для регистрации мембранного потенциала.
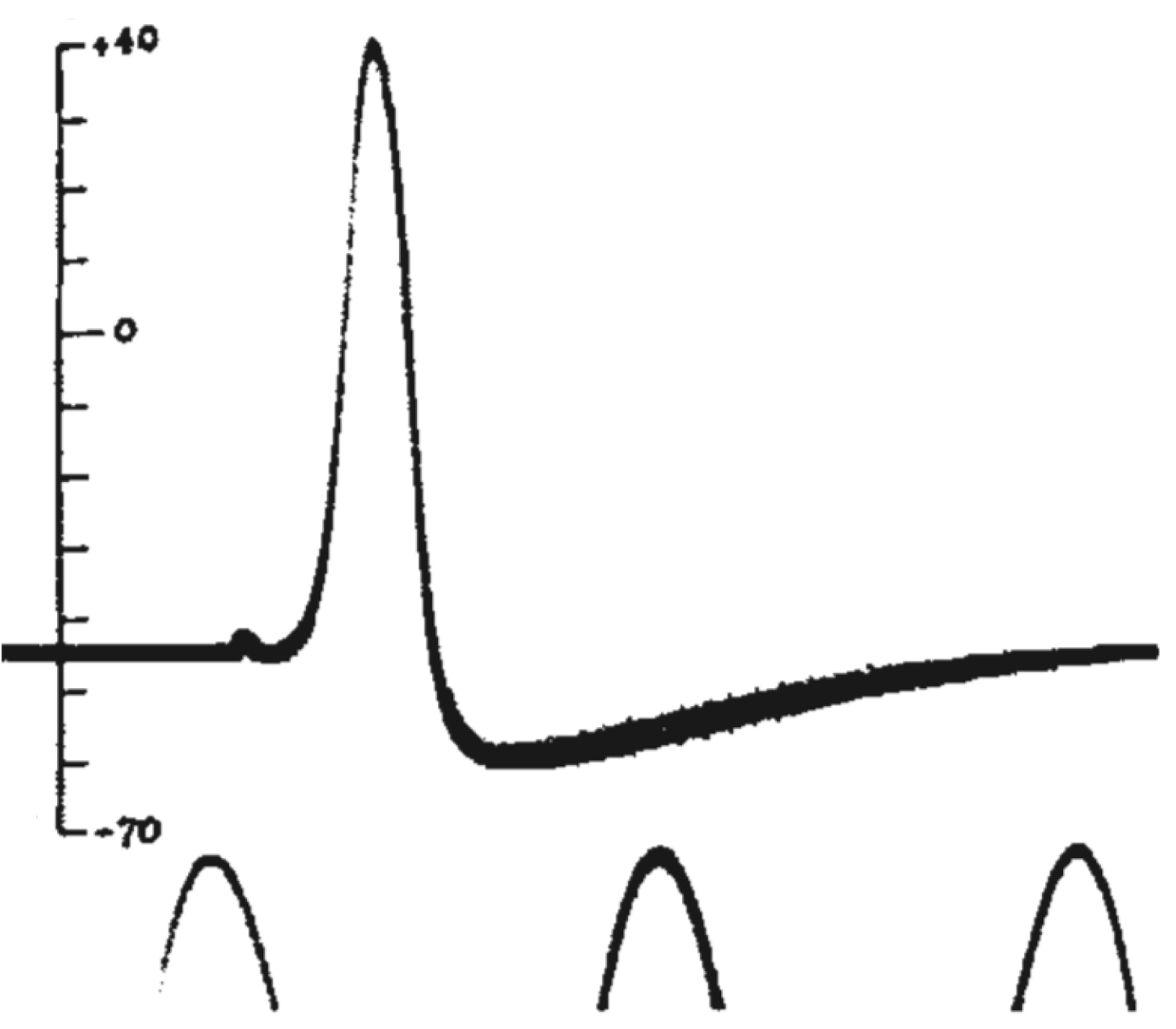
Так, в 1939 году А. Ходжкин и Э. Хаксли опубликовали в журнале Nature короткую заметку «Потенциалы действия, зарегистрированные внутри нервного волокна» [19] , в которой они описали первый эксперимент по внутриклеточному измерению мембранного потенциала на гигантском аксоне кальмара. Посмотрим на потенциалы действия, которые зарегистрировали исследователи.
Рисунок 8 | Потенциал действия из статьи А. Ходжкина и Э. Хаксли 1939 года [19] . Потенциал действия был зарегистрирован как разность потенциала между внутренней средой аксона и внешней средой. Пики внизу рисунка — это фрагменты синусоидального сигнала с частотой 500 Гц. Вертикальной чертой отмечен потенциал внутреннего электрода в милливольтах, потенциал морской воды снаружи аксона был принят за ноль.
Мы видим резкую деполяризацию мембраны до положительных значений, а затем более плавное возвращение потенциала к отрицательным значениям, зачастую более отрицательным, чем величина потенциала покоя. Из этих наблюдений следовало два важных вывода: 1) потенциал действия генерируется мембраной клетки, что не было очевидно в 1930-е годы; 2) поскольку измеренная амплитуда потенциала действия была больше величины мембранного потенциала, генерация потенциала действия — это активный процесс, который нельзя объяснить временным «пробоем» в мембране (каким бы наивным такое представление нам не казалось сегодня, в 1930-е так думали многие физиологи). В том же году К. С. Коул и Х. Дж. Кертис [20] зарегистрировали кратковременное изменение проводимости мембраны с 1 мСм/см 2 до 40 мСм/см 2 при генерации потенциала действия. Эти данные также свидетельствовали о тонкой регуляции этого процесса.
После Второй мировой войны Ходжкин и Хаксли вернулись к своим исследованиям. В 1945 году они опубликовали статью с несколькими дополнительными экспериментами, подтверждающими сформулированные ранее выводы. Но и тогда ионные механизмы потенциала действия оставались неясными.
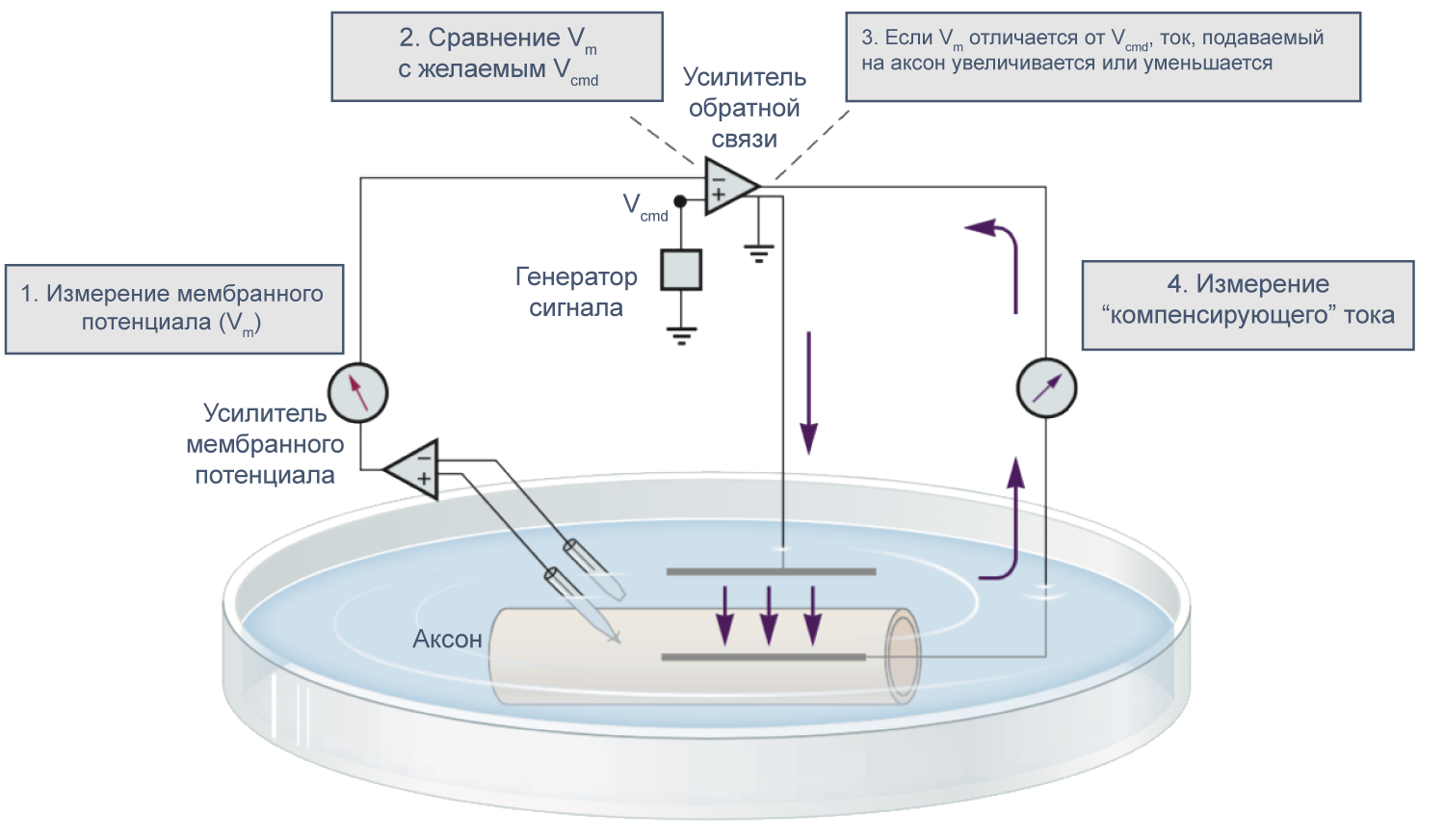
В 1952 году вышла серия статей, посвященных разгадке механизма генерации потенциала действия. Ведущую роль в этом открытии сыграл новый метод фиксации потенциала с помощью двух электродов (в англоязычной литературе TEVC — two-electrode voltage clamp), разработанный в конце 1940-х годов К. С. Коулом и Дж. Мармонтом [21] . Этот метод позволяет измерять не только потенциал, но и токи при заданном значении мембранного потенциала. Как же осуществляется фиксация потенциала с помощью двух электродов на заданном уровне (Vcmd — «командный потенциал»)? В клетку помещают два электрода, один из которых измеряет потенциал (относительно внеклеточного электрода сравнения) и передает его значение на специальный усилитель, который сравнивает измеренный потенциал со значением командного потенциала. Это устройство вычисляет ток, необходимый для компенсации этой разницы, и подает через второй внутриклеточный электрод ток такой величины, чтобы потенциал на мембране клетки стал равен Vcmd (Vm = Vcmd). Из амплитуды тока, необходимого для компенсации сдвига потенциала до Vcmd, можно сделать вывод о токе через мембрану при данном значении мембранного потенциала. Ток при данном значении потенциала равен току, подаваемому на второй электрод, взятому с обратным знаком.
Рисунок 9 | Схема фиксации потенциала с помощью двух электродов [21] .
В 1970–80-х годах Эрвин Неер и Берт Сакман (Erwin Neher, Bert Sakmann) предложили метод локальной фиксации потенциала (англ. patch clamp), позволяющий работать с мелкими клетками и токами малой амплитуды и даже регистрировать активность отдельных каналов. Тем не менее, метод фиксации потенциала двумя электродами в микроэлектродной конфигурации используется и сегодня при работе с такими крупными клетками, как ооциты лягушки Xenopus laevis.
Временной ход потенциала действия
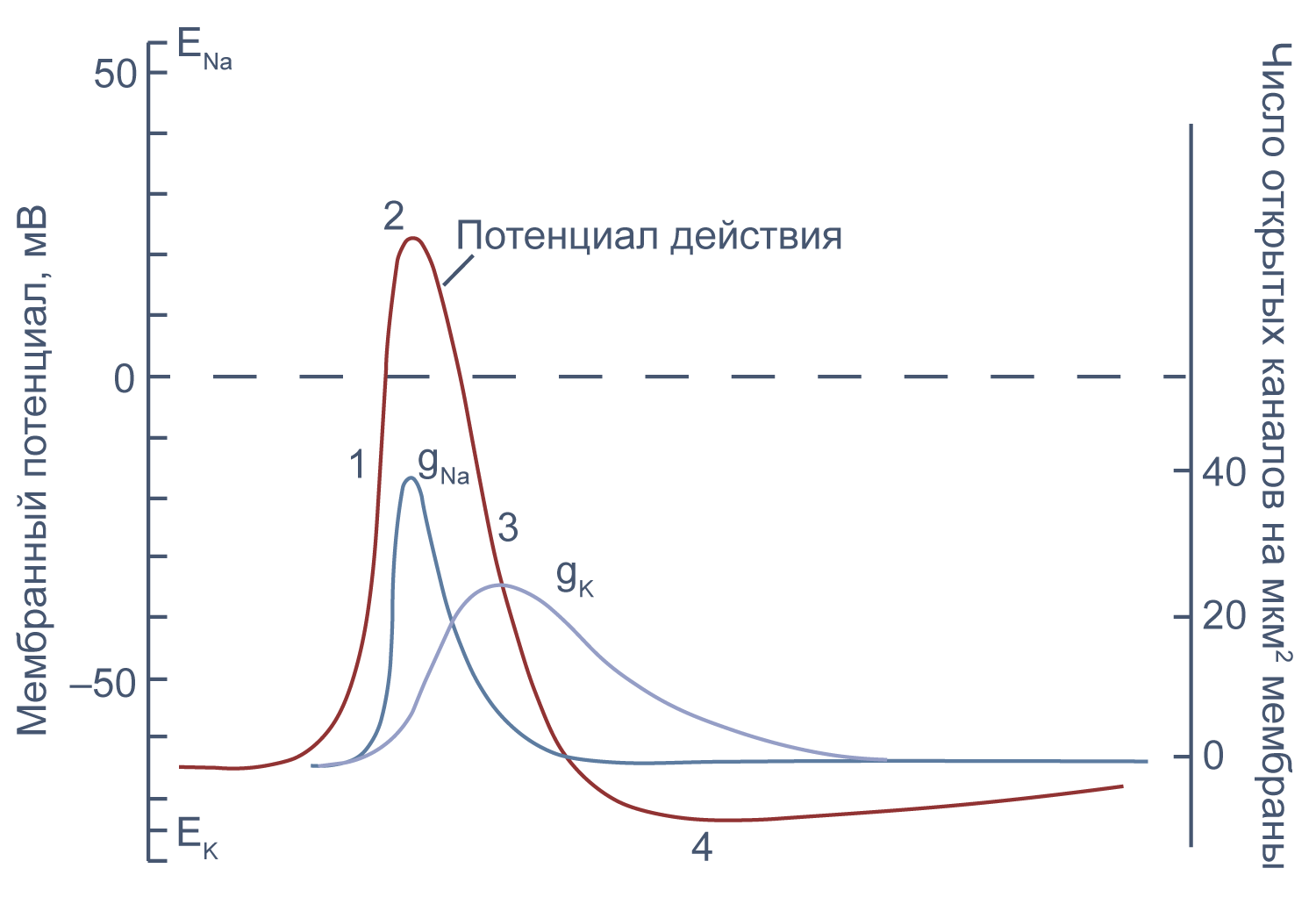
Потенциал действия в аксоне можно разделить на 1) фазу быстрой деполяризации до 2) положительных значений (овершута, от англ. overshoot), 3) фазу реполяризации, в которой потенциал возвращается к потенциалу покоя или даже до несколько более отрицательных значений — 4) следовая гиперполяризация.
Рисунок 10 | Потенциал действия и изменения проводимости мембраны для Na + и K + в гигантском аксоне кальмара. Из [22], с изменениями.
Изменяя ионный состав внутри- и внеклеточного раствора, можно изолировать ионные токи, которые опосредуют изменение мембранного потенциала при потенциале действия. Так, помещая аксон в раствор, в котором натрий заменен на холин, можно изолировать натриевый и калиевый компонент потенциала действия, то есть отдельно измерить калиевый ток [20] . Этого же можно достичь применением блокаторов потенциал-зависимых натриевых и калиевых каналов — тетродотоксина и тетраэтиламмония (TEA).
Чтобы понять взаимосвязь ионных токов и вызванных ими изменений потенциала, рассмотрим всю цепь событий при генерации потенциала действия. Сначала мембрана деполяризуется под действием внешнего стимула: поступления в клетку катионов через лиганд-управляемые каналы, закрытия калиевых каналов или электрической стимуляции в эксперименте. Если деполяризация достигает порогового значения для потенциалзависимых натриевых каналов (Nav), они открываются, натрий по градиенту своей концентрации входит в клетку, и мембрана деполяризуется еще сильнее. Дальнейшая деполяризация влечет за собой лавинообразное открытие все новых натриевых каналов, ток через которые приводит к еще большей деполяризации. Однако эта петля положительной обратной связи не работает бесконечно: открывшись на некоторое время, натриевые каналы инактивируются и не могут открыться вновь, пока мембранный потенциал не вернется к отрицательным значениям.
Механизм инактивации был предложен еще в математической модели Ходжкина и Хаксли [23] на основании кинетических характеристик тока. Они предположили, что в натриевом канале есть три активационные частицы m и одна инактивационная частица h. Когда стала известна аминокислотная последовательность канала, выяснилось, что канал на самом деле имеет четыре гомологичных активационных домена и один инактивационный, однако один из активационных доменов срабатывает значительно медленнее остальных трех, и его влияние на кинетические характеристики тока маскируется происходящей в то же время инактивацией канала (например, [24]).
В то же время деполяризация мембраны приводит к активации потенциал-зависимых калиевых каналов (Kv), которые открываются медленнее, чем натриевые, калий выходит из клетки, и потенциал возвращается к потенциалу покоя и может даже временно стать более отрицательным: пока натриевые каналы инактивированы, потенциал становится ближе к калиевому равновесному потенциалу, и это явление называется следовой гиперполяризацией.
Генерация потенциала действия происходит по принципу «все или ничего». Если деполяризующий стимул не достиг порогового значения, потенциал действия не генерируется. Если же порог был достигнут, положительная обратная связь обеспечивает открытие всех доступных натриевых каналов, и потенциал действия достигает своей максимальной амплитуды.
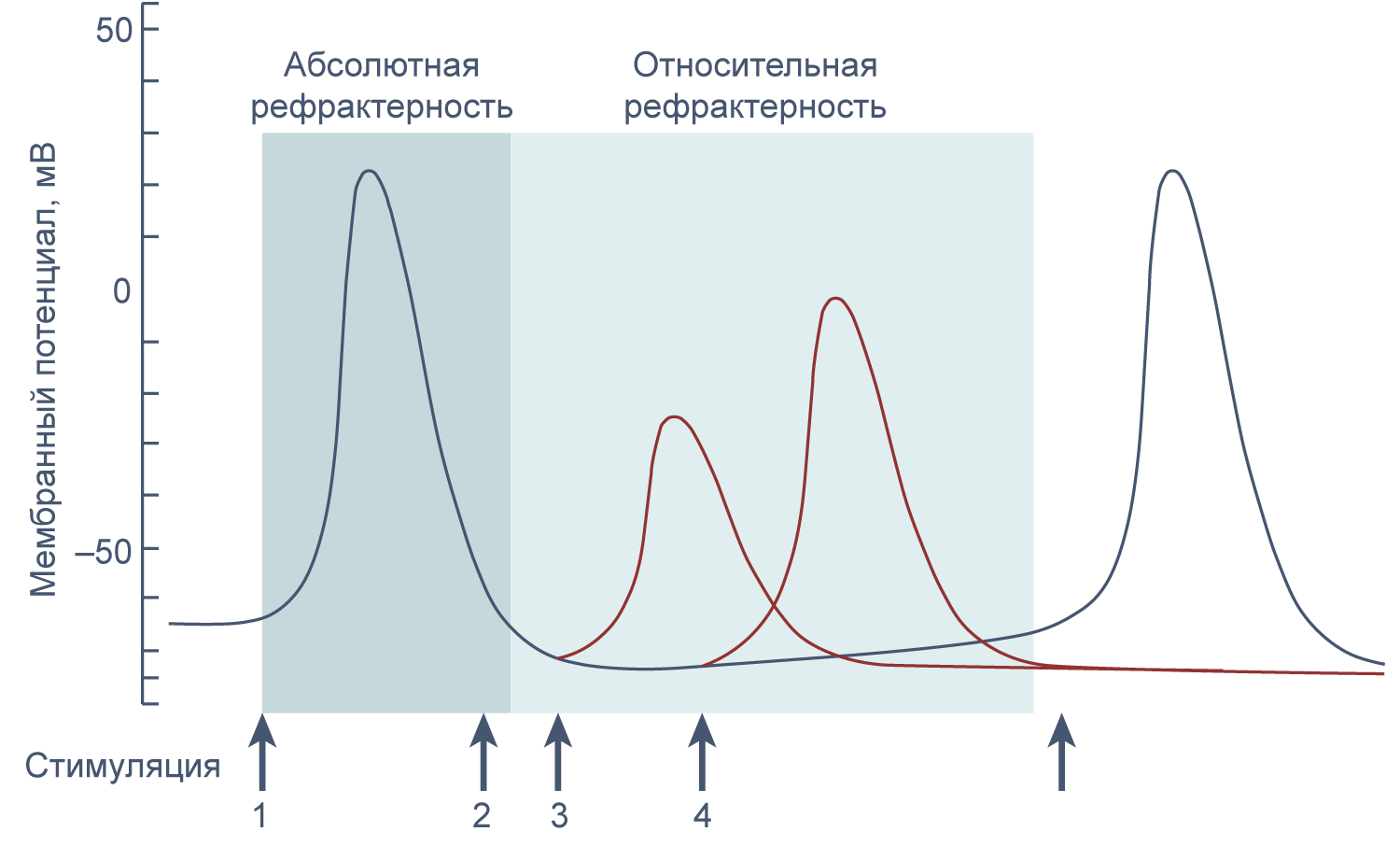
Если новый стимул приходит во время или сразу после генерации потенциала действия, второй потенциал действия не возникает или обладает меньшей амплитудой, чем первый. Это явление называется рефрактерностью. Стимул, возникший в период абсолютной рефрактерности, не вызывает генерации потенциала действия, а пришедшийся на период относительной рефрактерности вызывает потенциал действия уменьшенной амплитуды, так как часть натриевых каналов все еще инактивирована.
Рисунок 11 | Абсолютная и относительная рефрактерность. Стимуляция в период абсолютной рефрактерности (2) не ведет к генерации потенциала действия, а стимуляция в период относительной рефрактерности (3 и 4) приводит к генерации потенциала действия сниженной амплитуды.
Стоит отметить, что внутриклеточная концентрация физиологически значимых ионов при генерации потенциала действия не меняется, и ионные токи задействуют пренебрежимо малую долю от общего числа Na + и K + . Это можно проиллюстрировать следующим примером. Рассчитаем число ионов, которое должно пересечь мембрану для деполяризации на 100 мВ. Заряд на мембране равен произведению емкости мембраны и потенциала: Q = CmVm. Удельная емкость мембраны близка к 1 мкФ/см 2 , а сдвиг потенциала в нашем случае равен 0,1 В. Тогда количество разделенных зарядов равно Q = 10−6 Ф/см 2 × 0,1 В = 10−7 Кл/см 2 . Величина заряда одного иона Na + или K + (элементарного заряда) равна 1,6 × 10−19 Кл, тогда количество переносимых через мембрану ионов равно 10−7 Кл/см 2 / 1,6 × 10−19 Кл = 6,25 × 1011 ионов/см 2 , или 6250 ионов/мкм 2 . Для клетки диаметром 10 мкм площадь поверхности мембраны будет приблизительно равна 4πr 2 = 314 мкм 2 (в этом расчете для простоты мы считаем клетку гладкой сферой), а объем — 4πr 3 /3 = 524 мкм 3 . При внутриклеточной концентрации Na + 10 мМ, а K + 150 мМ содержание этих ионов в цитозоле будет равно 3,2 × 109 и 4,7 × 1010 соответственно. В течение одного потенциала действия приблизительно 314 мкм 2 × 6,250 ионов/мкм 2 ≈ 2 000 000 ионов Na + входит в клетку в фазе деполяризации и примерно столько же ионов K + выходит из клетки в фазе реполяризации, что составляет всего 0,06 % от общего числа ионов натрия в клетке. Токи такой величины обычно не изменяют макроскопические концентрации ионов в клетке, поскольку работа Na/K-АТФазы компенсирует эти незначительные изменения. Однако при определенных условиях концентрации Na + и K + все же могут измениться, например, при продолжительной стимуляции аксонов с малым диаметром [25] .
Распространение возбуждения по аксону
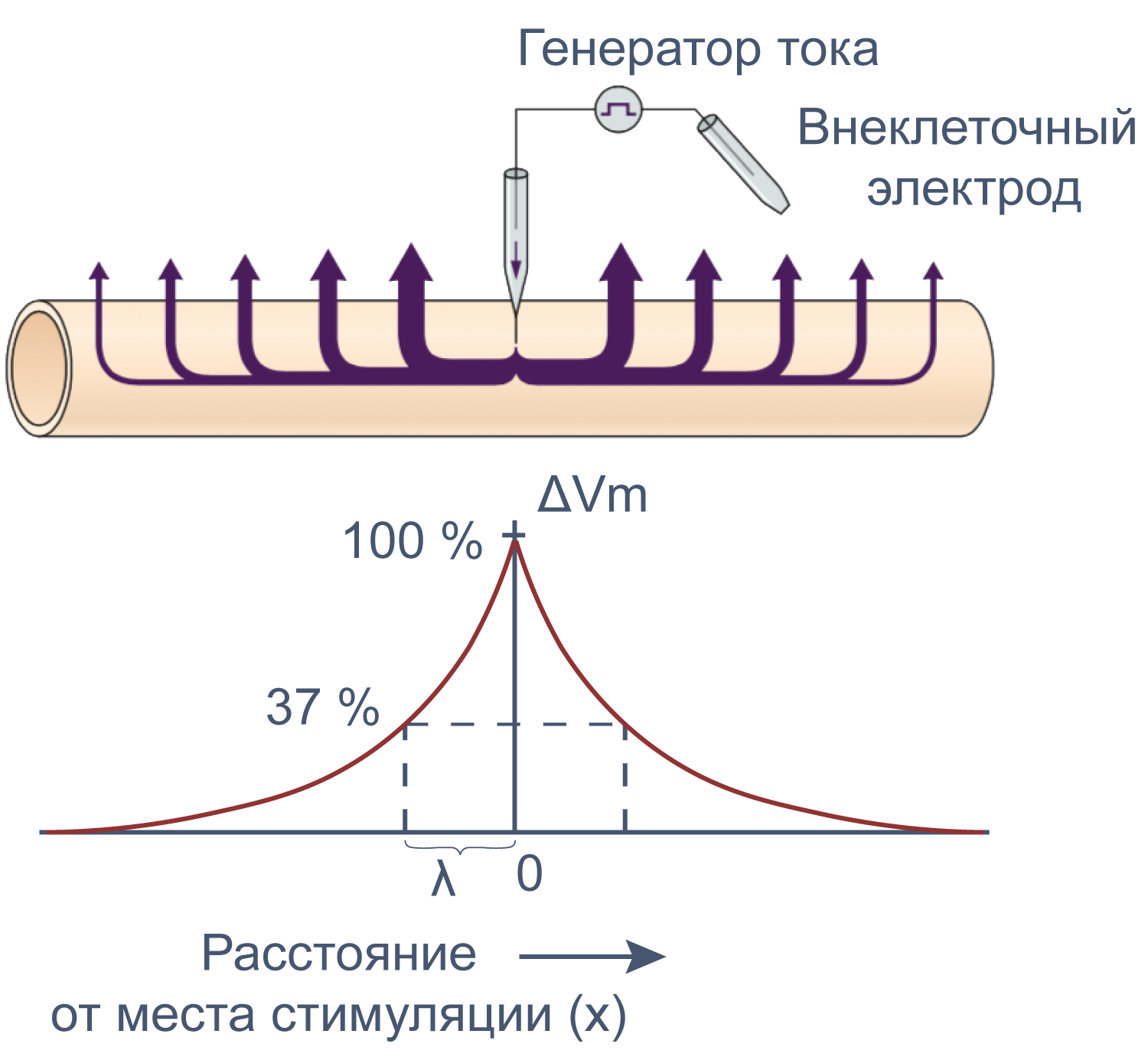
Электрические свойства мембраны помогают понять изменения мембранного потенциала не только во времени, но и в пространстве. Пассивное, или электротоническое распространение возбуждения по мембране происходит без изменения проводимости потенциал-зависимых каналов. Для распространения потенциала действия важен как активный (изменение проводимости натриевых и калиевых каналов), так и пассивный механизмы, поскольку деполяризация, вызывающая открытие новых потенциал-зависимых натриевых каналов, должна достигнуть нового невозбужденного участка аксона, и происходит это благодаря электротоническому распространению возбуждения.
Рисунок 12 | Электротоническое распространение возбуждения. Пояснения в тексте [22].
Сдвиг потенциала в точке, отстоящий на x от места стимуляции, можно вычислить как Ex = E0e –x/λ , где E0 — это сдвиг потенциала в точке стимуляции, а λ — постоянная длины.
Постоянная длины возрастает с увеличением сопротивления мембраны (rm) и уменьшается с возрастанием сопротивления аксоплазмы (ri), которое в свою очередь зависит от концентрации подвижных зарядов в объеме аксона. Знание этих закономерностей позволяет понять зависимость скорости распространения возбуждения от радиуса (R) аксона. Сопротивление мембраны rm пропорционально 1/2πR, сопротивление аксоплазмы ri — 1/πR 2 , а емкость мембраны Cm пропорциональна R. По мере увеличения радиуса аксона и rm, и ri уменьшаются, но ri уменьшается сильнее. Постоянная длины увеличивается, следовательно, сдвиг потенциала может распространяться по более крупному аксону дальше. Кроме того, увеличение радиуса аксона ведет к увеличению емкости мембраны, однако этот эффект нивелируется тем, что емкость с увеличением радиуса растет линейно, а уменьшение ri пропорционально квадрату радиуса. Таким образом, проводимость аксоплазмы увеличивается быстрее (при снижении ri), чем растет емкость мембраны, и это позволяет току быстрее достигать невозбужденных участков мембраны более крупного аксона.
Зависимость скорости распространения потенциала действия по аксону от его диаметра объясняет необходимость в гигантских аксонах у кальмара. Однако у позвоночных гигантских аксонов нет, и достаточная скорость проведения нервных импульсов достигается с помощью миелинизации аксонов. Миелиновые оболочки образованы специальными глиальными клетками: олигодендроцитами в центральной нервной системе и клетками Шванна в периферической. Эти клетки оборачивают аксон, образуя вокруг него плотный чехол из десятков слоев плазматической мембраны, который работает как изолятор. Под миелиновой оболочкой очень мало или почти нет натриевых каналов. Они оказываются расположены на небольших участках мембраны аксона между двумя соседними шванновскими клетками или олигодендроцитами — в перехватах Ранвье. Миелиновая оболочка увеличивает скорость проведения потенциала действия благодаря повышению сопротивления мембраны rm. При этом снижаются потери тока через мембрану, и деполяризация может пассивно распространяться на бо́льшие расстояния. Кроме того, из-за снижения емкости мембраны Cm, меньшая доля тока тратится на перезарядку мембраны. Миелинизация делает передачу потенциала действия не только быстрее, но и эффективнее, поскольку натриевые каналы располагаются только в перехватах Ранвье, благодаря чему меньшее количество ионов натрия входит в клетку и меньше энергии требуется на работу Na/K АТФ-азы для поддержания концентрационного градиента.
Потенциалы действия в других возбудимых клетках
Минималистичный натриево-калиевый потенциал действия характерен только для аксонов нейронов. В других частях нейрона и в иных типах возбудимых клеток в генерации потенциала действия принимают участие разнообразные ионные каналы, в том числе калиевые каналы других семейств и кальциевые каналы плазматической мембраны и эндоплазматического ретикулума (ЭПР является внутриклеточным депо кальция; общая концентрация Ca 2+ в нем достигает миллимолярных значений, а концентрация свободного кальция находится в микромолярном диапазоне [26] ; эти значения на несколько порядков выше, чем 100 нМ свободного Ca 2+ в цитозоле в состоянии покоя). Различия в экспрессии генов ионных каналов в различных типах возбудимых клеток порождают разнообразие потенциалов действия, различающихся ионными механизмами, длительностью (от 1,5 мс в аксонах до 500 мс в кардиомиоцитах желудочков), необходимостью внешнего стимула для генерации или наличием собственного ритма. Многие ионные каналы, не участвуя напрямую в генерации потенциала действия, влияют на возбудимость клеток и таким образом вносят вклад в разнообразие электрической активности клеток.
* Принятое в физиологической литературе употребление фраз «по» или «против градиента концентрации» расходится с физическим понятием градиента. В математике и физике градиент направлен в сторону наибольшей скорости возрастания функции или величины; так, если вещество движется в направлении этого вектора, то физиологи говорят о движении «против градиента концентрации», а если в противоположном направлении — то «по градиенту концентрации». Такое словоупотребление прочно закрепилось в литературе, но пусть оно не сбивает вас с толку, когда вы размышляете, откуда взялся минус перед градиентом концентрации в уравнении диффузионного потока (уравнении Фика): J = — D dC/dx, где J — диффузионный поток [моль∙см -2 ∙с -1 ], D — коэффициент диффузии [см 2 ∙с -1 ], а dC/dx— градиент концентрации.
** Проводимость (g = 1/R) — это характеристика скорости движения любых зарядов через мембрану, а проницаемость (P) отражает, насколько легко частицы могут двигаться через мембрану независимо от того, движутся они или нет. Для ионов эти величины связаны. Например, в фазе быстрой деполяризации при потенциале действия возрастает как проводимость, так и проницаемость мембраны для ионов натрия. Однако зачастую, если проницаемость канала для какого-то иона высока из-за высокого сродства участков поры канала для этого иона, такие ионы будут двигаться через канал медленнее, и проводимость будет ниже, чем для других ионов, для которых канал менее проницаем.
*** Удельная емкость чистого липидного бислоя составляет около 0,8 мкФ/см 2 , разница между электроемкостью мембраны и липидного бислоя возникает из-за обилия встроенных в мембрану белков.
http://biocpm.ru/potencial-pokoya-i-potencial-deystviya
http://medach.pro/post/1458